Bac Amérique du nord 2021 Sujet 1
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1AN1
Sujet et corrigé
Mots clés : gaz parfait ; titrage conductimétrique ; titre massique d’une solution.
Utilisé pour dissoudre les impuretés et les défauts qui sont à l’origine de l’oxydation de la surface métallique, le décapage permet aux pièces métalliques d’améliorer leur résistance contre la corrosion et d’augmenter leur durée de vie. Ainsi, l’acide chlorhydrique est couramment utilisé dans l’industrie pour décaper des métaux.
Dans cet exercice, on étudie la préparation d’une solution d’acide chlorhydrique, puis son action lors du décapage d’une pièce en aluminium.
Données :
Masses molaires atomiques : M(H) = 1,0 g·mol-1 ; M(Aℓ) = 27,0 g·mol-1 ; M(Cℓ) = 35,5 g·mol-1
Constante des gaz parfaits : R = 8,32 Pa·m3·mol-1·K-1
La température T en kelvin est reliée à la température θ en degré Celsius par : T(K) = θ(°C) + 273,15.
A. Préparation d’une solution d’acide chlorhydrique
Pour préparer une solution S d’acide chlorhydrique, on dissout un volume de 150 L de chlorure d’hydrogène gazeux HCℓ(g) dans de l’eau pour obtenir 1,00 L de solution aqueuse d’acide chlorhydrique.
Le chlorure d’hydrogène est assimilé à un gaz parfait et l’expérience se déroule sous une pression atmosphérique de 1 013 hPa et à une température ambiante de 20 °C.
A.1. Écrire l’équation de dissolution du chlorure d’hydrogène dans l’eau.
Réponse :
« Le chlorure d’hydrogène gazeux HCℓ(g) dans de l’eau pour obtenir 1,00 L de solution aqueuse d’acide chlorhydrique.»
Une solution aqueuse d’acide chlorhydrique est composé d’ions H3O+ et Cl–.
L’équation de dissolution du chlorure d’hydrogène dans l’eau s’écrit :
HCℓ(g) + H2O → H3O+ + Cl–.
A.2. Déterminer la concentration en quantité de matière de chlorure d’hydrogène apportée CS de la solution S ainsi préparée.
Réponse :
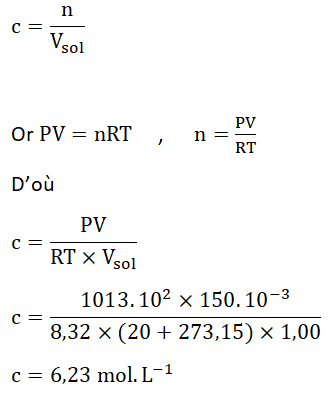
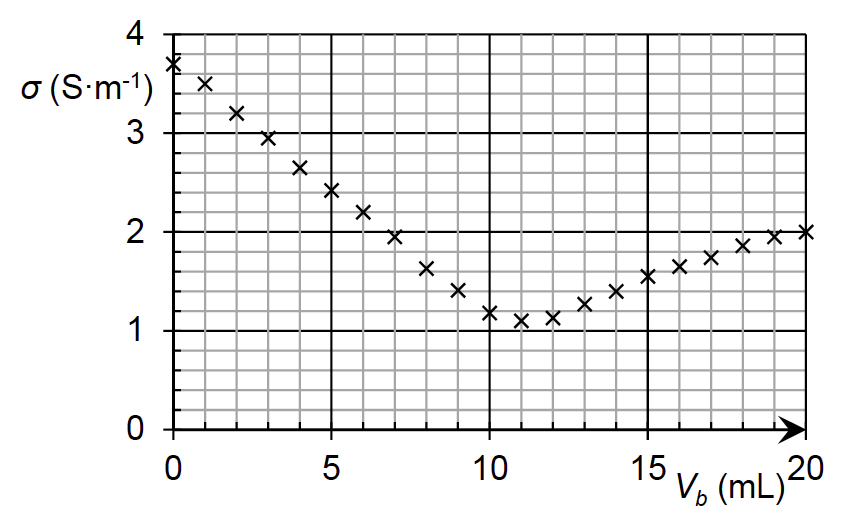
Pour contrôler la concentration en quantité de matière de la solution obtenue, on procède à un titrage conductimétrique par une solution aqueuse d’hydroxyde de sodium. Après dilution de la solution précédemment obtenue, on met en œuvre le titrage et on obtient le graphique suivant.
Courbe de titrage conductimétrique d’une solution d’acide chlorhydrique par une solution d’hydroxyde de sodium
Conductivités ioniques molaires :
| Ion | sodium | chlorure | oxonium | hydroxyde |
| λ (S·cm2·mol-1) | 50 | 76 | 350 | 200 |
A.3. Justifier, en développant le raisonnement, l’évolution qualitative de la pente de la courbe au cours du titrage.
Réponse :
H3O++ HO– → 2 H2O
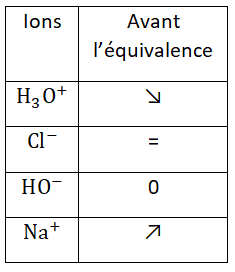
Avant l’équivalence :
- [H3O+] diminue car les ions H3O+ réagissent
- [Cl–] ne varie par car les ions Cl– sont spectateurs
- [HO–] est nulle car les ions HO– sont en défaut avant l’équivalence
- [Na+] augmente car les ions Na+ sont spectateurs et ajoutés au cours du titrage.
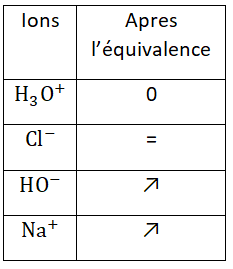
Apres l’équivalence :
- [H3O+] est nulle car les ions H3O+ n’existent plus dans la solution, ils ont tous réagit
- [Cl–] ne varie par car les ions Cl– sont spectateurs
- [HO–] augmente car les ions HO– sont en excès après l’équivalence et ils ne réagissent plus
- [Na+] augmente car les ions Na+ sont spectateurs et ajoutés au cours du titrage.
Avant l’équivalence [H3O+] Diminue et [Na+] augmente Or λNa+<λH3O+ donc la conductivité diminue.
Apres l’équivalence, la concentration des ions augmente donc la conductivité augmente.
B. Décapage à l’acide chlorhydrique
Une pièce d’aluminium de 350 g est décapée dans 1,00 L d’une solution d’acide chlorhydrique. Une réaction chimique a lieu à la surface, éliminant une partie de l’aluminium qui passe en solution. Un dégagement gazeux incolore et extrêmement inflammable est observé.
L’équation chimique modélisant la réaction de l’acide chlorhydrique sur l’aluminium s’écrit :
2 Aℓ (s) + 6 H3O+ (aq) → 2 Aℓ3+ (aq) + 3 H2 (g) + 6 H2O (ℓ)
On considèrera que cette transformation est totale.
B.1. Indiquer si l’équation chimique ci-dessus traduit une réaction acido-basique ou une réaction d’oxydoréduction. Justifier la réponse.
Réponse :
Une réaction acido-basique est une réaction au cours de laquelle se produit transfert d’un proton (H+) d’une espèce, l’acide, à une autre, la base.
Une réaction d’oxydoréduction ou réaction redox est une réaction chimique au cours de laquelle se produit un transfert d’électrons.
Al se transforme en Aℓ3+ : Aℓ (s) = Aℓ3+ (aq) + 3e–
H3O+ se transforme en H2 : 2 H3O+ (aq) + 2 e–= H2 (g) + 2 H2O (ℓ)
Il s’agit donc d’une réaction d’oxydoréduction.
Dans la situation étudiée, on souhaite que le décapage cesse lorsque 0,10 % de la masse d’aluminium a réagi.
B.2. Déterminer la concentration, notée C, en quantité de matière d’ions H3O+(aq) de la solution d’acide chlorhydrique à utiliser pour décaper correctement la pièce en aluminium considérée.
Réponse :

A la fin de la réaction il doit rester 99,90% de Al soit 0,999×nAli car on souhaite que le décapage cesse lorsque la 0,10% de la masse d’Aluminium a réagit.
A la fin de la réaction il ne reste plus de H3O+ car on souhaite que le décapage cesse.
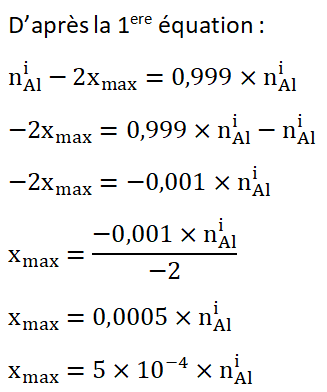
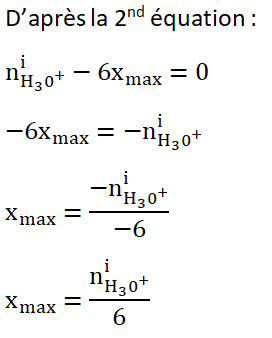
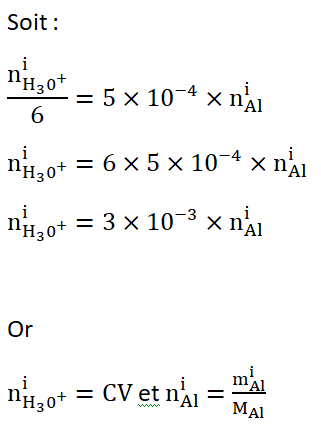
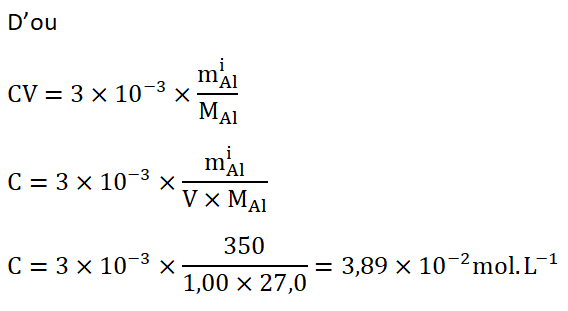
Le pourcentage massique d’une solution d’acide chlorhydrique est la masse de gaz chlorure d’hydrogène dissous pour obtenir 100 g de solution. Ainsi 100 g de solution d’acide chlorhydrique à 10 % ont été fabriqués en dissolvant 10 g de chlorure d’hydrogène.
On dispose d’une solution commerciale à 23 % en masse d’acide chlorhydrique. La masse volumique ρsol de cette solution est égale à 1,15 g·mL-1.
B.3. Déterminer la dilution à appliquer à la solution commerciale à 23 % pour décaper correctement la pièce d’aluminium.

Calculons le volume de solution mère à prélever :
Lors d’une dilution la masse se conserve :
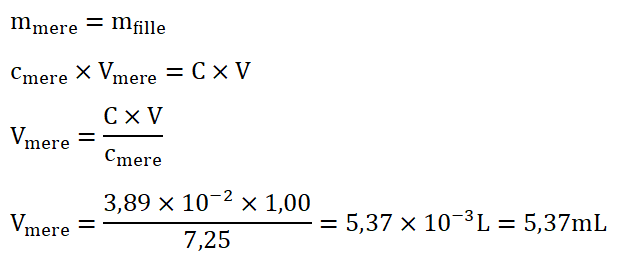
Protocole de dilution à appliquer pour décaper correctement la pièce :
- On prélève 5,37 mL de la solution commerciale à l’aide d’une pipette graduée
- Etant donné que c’est un acide concentré, on met l’acide dans l’eau et non l’inverse. Ainsi on prend une fiole jaugée de 1,00L qu’on rempli à moitié avec de l’eau distillé.
- On insert ce prélèvement dans la fiole jaugée.
- On complète avec de l’eau distillée
- On homogénéise
