Bac Métropole Mars 2021 Sujet 1
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet et corrigé
EXERCICE B – UNE BOISSON DE RÉHYDRATATION
Mots-clés : réactions acide-base ; réactions d’oxydoréduction ; dosage par étalonnage
Une boisson de réhydratation, obtenue par dissolution dans l’eau d’un médicament commercialisé sous forme de poudre, est composée principalement d’eau, de glucose (sucre) et de chlorure de sodium (sel). Elle peut être utilisée pour réhydrater rapidement un enfant souffrant de diarrhée.
L’objectif de cet exercice est de vérifier la teneur en glucose d’une de ces boissons par la spectrophotométrie UV-visible.
Données :
- différentes formes de l’acide tartrique :
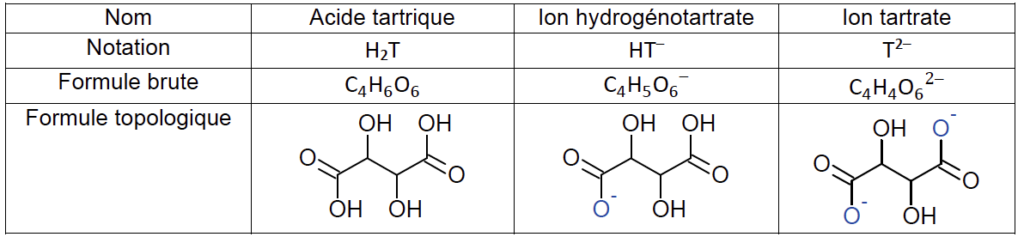
- pKA de couples acide-base à 25°C :
– H2T(aq) / HT–(aq) : pKA1 = 3,5 ;
– HT–(aq) / T2–(aq) : pKA2 = 4,2 ;
– H2O(ℓ) / HO–(aq) : pKE = 14 ;
- couple oxydant-réducteur ion gluconate / glucose : C5H11O5 − CO2–(aq) / C5H11O5 − CHO(aq);
- composition d’un médicament permettant la réhydratation commercialisée en pharmacie :
| Espèces chimiques | Analyse moyenne pour un sachet |
| Glucose (C6H12O6) Saccharose (C12H22O11) Sodium (Na+) Potassium (K+) Chlorure (Cl –) Bicarbonate (HCO3 –) Gluconate (C6H11O7 –) | 4 g 4 g 0,226 g 0,199 g 0,181 g 0,289 g 0,995 g |
1. Étude de la liqueur de Fehling
Pour doser le glucose présent dans un médicament permettant la réhydratation, on prépare au préalable une solution de liqueur de Fehling en mélangeant :
- une solution aqueuse (A) contenant des ions cuivre Cu2+(aq) ;
- une solution aqueuse (B) obtenue lors du mélange d’une solution d’acide tartrique H2T(aq) et d’une solution aqueuse d’hydroxyde de sodium. La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12.
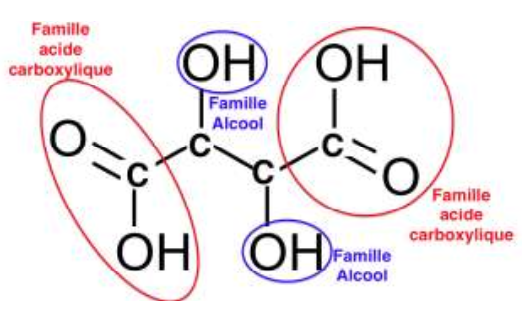
1.1. Écrire la formule semi-développée de la molécule d’acide tartrique. Entourer les groupes caractéristiques de la molécule, en précisant pour chacun d’eux la famille fonctionnelle correspondante.
1.2. Déterminer la forme prédominante dans la solution (B) parmi les espèces H2T(aq), HT–(aq) et T2–(aq).
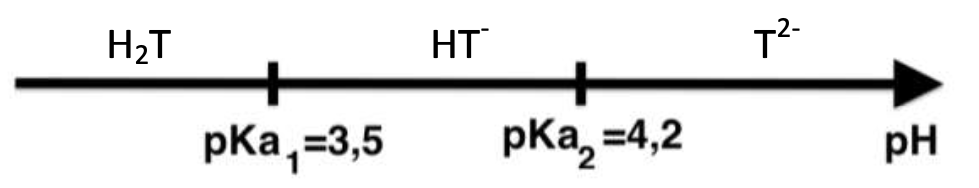
« La solution (B) ainsi obtenue est très basique, son pH est supérieur à 12. » la forme prédominante est donc T2-.
1.3. En déduire l’équation de la réaction chimique modélisant la transformation ayant lieu lors de la préparation de la solution (B).
« Une solution aqueuse (B) obtenue lors du mélange d’une solution d’acide tartrique H2T(aq) et d’une solution aqueuse d’hydroxyde de sodium »
$$H_2T_{(aq)}+2{\rm HO}_{(aq)}^-\rightarrow T_{(aq)}^{2-}+2H_2O_{(l)}$$
Lors du mélange des solutions (A) et (B), les ions Cu2+(aq) réagissent avec les ions tartrate T2–(aq) pour former des ions de formule CuT22–(aq), seuls responsables de la coloration bleue de la liqueur de Fehling.
1.4. Écrire l’équation de la réaction chimique modélisant la transformation ayant lieu lors du mélange des solutions (A) et (B).
$${\rm Cu}_{(aq)}^{2+}+2T_{(aq)}^{2-}\rightarrow {\rm CuT}_{2(aq)}^{2-}$$
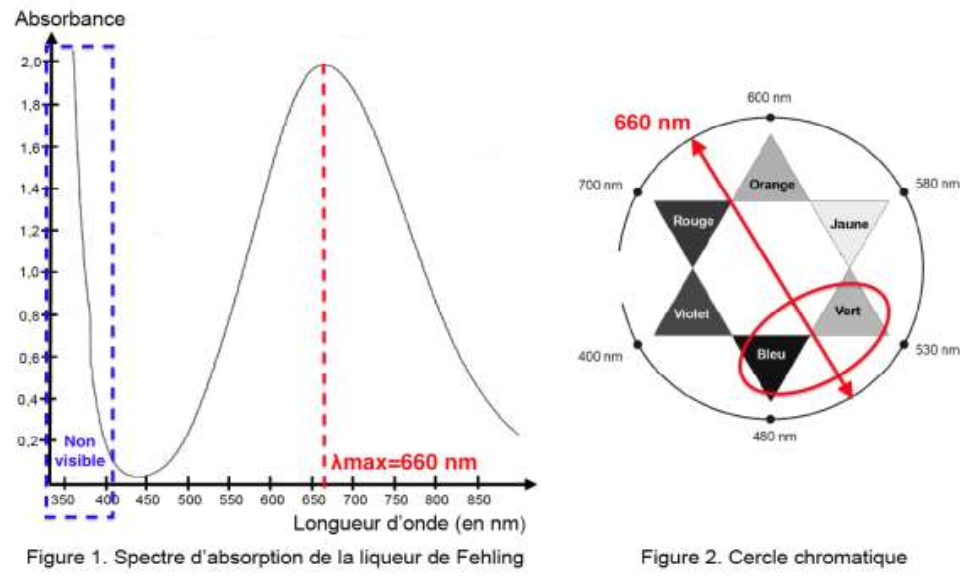
Le spectre d’absorption de la liqueur de Fehling (figure 1) est donné ci-après ainsi qu’un cercle chromatique (figure 2) :
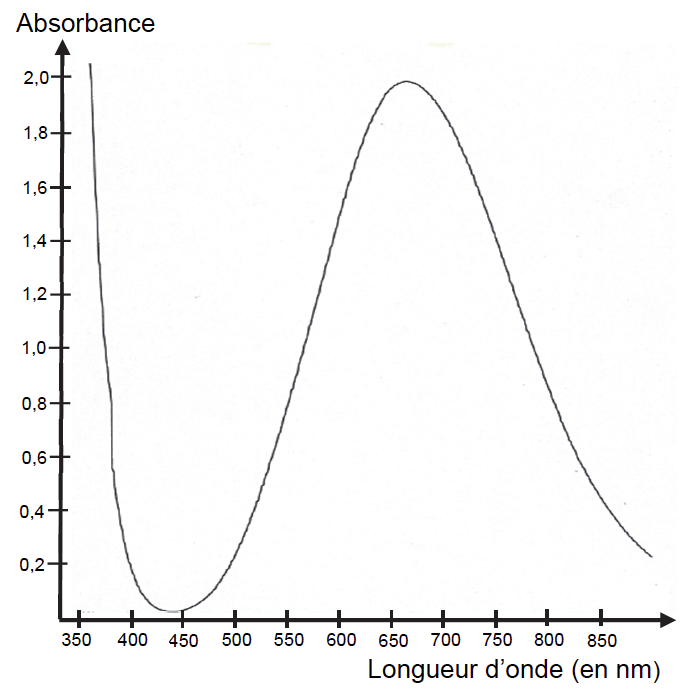
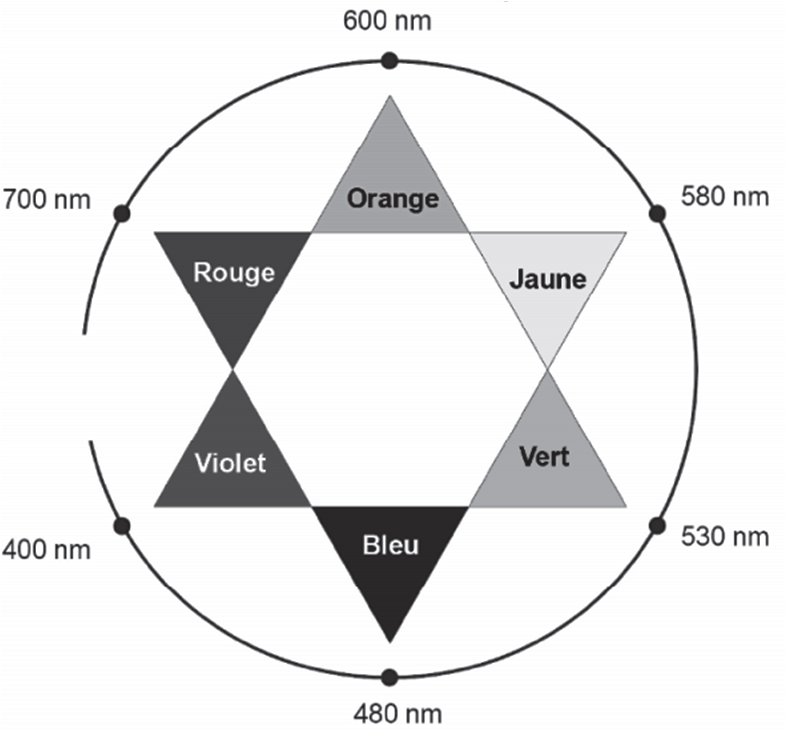
1.5. Justifier la couleur de la solution de liqueur de Fehling.
$$\mathbf{\lambda}_{\mathbf{max}}=\mathbf{660}\ \mathbf{nm}$$
Sa couleur est la couleur complémentaire : Bleu-vert.
2. Dosage du glucose
Le médicament permettant la réhydratation contient, entre autres, du glucose qui possède des propriétés réductrices. On souhaite utiliser ces propriétés pour réaliser un dosage par étalonnage utilisant la spectrophotométrie.
On réalise une courbe d’étalonnage selon le protocole expérimental suivant :
- préparer une gamme de solutions aqueuses étalons de concentrations en masse Cm de glucose connues ; ces solutions étalons sont incolores ;
- faire réagir, une à une, 10,0 mL de ces solutions étalons avec 5,0 mL de liqueur de Fehling dans un bain-marie bouillant pendant 15 min ; il se forme le précipité rouge-brique Cu2O ;
- éliminer le précipité du mélange par filtration. Le filtrat obtenu est de couleur bleue ;introduire ce filtrat dans une fiole jaugée de 25,0 mL et ajuster le trait de jauge avec de l’eau distillée ;
- mesurer avec un spectrophotomètre l’absorbance de la solution obtenue de couleur bleue.
Le glucose contenu dans le médicament permettant la réhydratation réagit avec les ions CuT22– contenus dans la liqueur de Fehling. Cette transformation chimique est totale et produit l’ion gluconate et l’oxyde de cuivre Cu2O(s), de couleur rouge-brique. L’équation de la réaction modélisant cette transformation est :
2 CuT22–(aq) + C5H11O5 − CHO(aq)+ 5 HO– (aq) → Cu2O(s) +C5H11O5 − CO2–(aq) + 4 T2– (aq) + 3 H2O(l)
glucose ion gluconate
2.1. Justifier le caractère réducteur du glucose dans cette réaction à l’aide d’une demi-équation électronique.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
$$glucose\∶\ C_5H_{11}O_5-CHO_{(aq)}$$
$$ion\ gluconate\∶\ C_5H_{11}O_5-CO_{2(aq)}^-$$
$$C_5H_{11}O_5-CHO_{(aq)}\ +\ H_2O_{(l)}\rightarrowC_5H_{11}O_5-CO_{2(aq)}^-+3H^++{2e}^-$$
Le glucose est donc un réducteur.
2.2. À l’issue de la réaction entre une solution étalon de glucose et la solution de liqueur de Fehling, le filtrat est de couleur bleue. Identifier le réactif limitant.
$« {\rm CuT}_{2(aq)}^{2-}$, seuls responsables de la coloration bleue de la liqueur de Fehling. »
« À l’issue de la réaction entre une solution étalon de glucose et la solution de liqueur de Fehling, le filtrat est de couleur bleue. »
Le ${\rm CuT}_{2(aq)}^{2-}$ est en excès, le réactif limitant est donc le glucose.
2.3. Proposer une longueur d’onde optimale pour régler le spectrophotomètre afin de réaliser les mesures.
$$\lambda_{max}=660\ nm$$
La courbe d’étalonnage est obtenue à partir des mesures de l’absorbance des filtrats des différents mélanges. Elle est modélisée par une droite d’équation :
A = – 0,39 × Cm + 0,88 avec Cm en g·L–1.
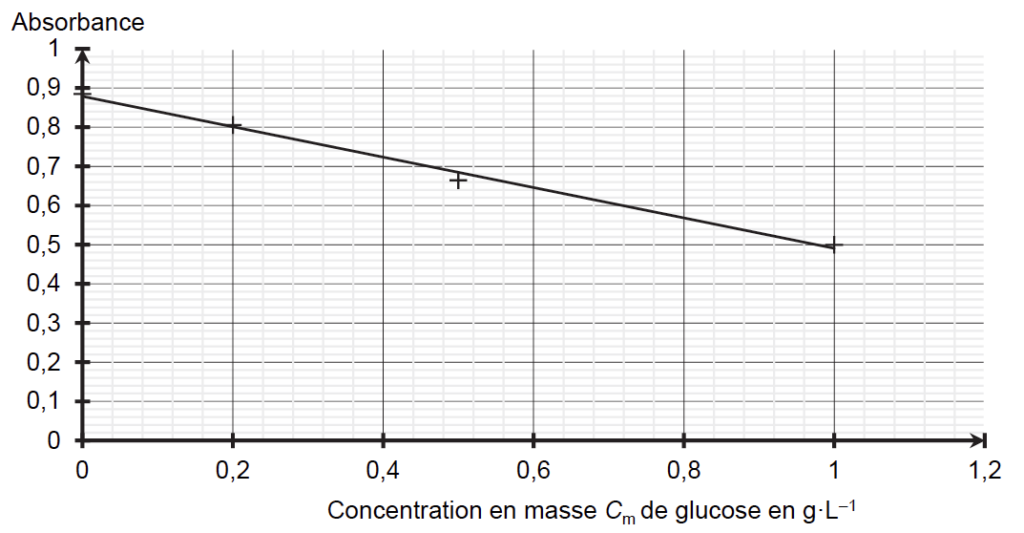
2.4. Expliquer pourquoi l’absorbance du filtrat diminue lorsque la concentration en masse de glucose augmente.
A = – 0,39 × Cm + 0,88
Le coefficient directeur est négatif : lorsque Cm augmente, A diminue.
Physiquement : lorsqu’on ajoute du glucose, la concentration en ${\rm CuT}_{2(aq)}^{2-}$ diminue. Or c’est le ${\rm CuT}_{2(aq)}^{2-}$ qui est responsable de la couleur et donc de l’absorbance de la solution. Ainsi, lorsque la concentration en glucose augmente, l’absorbance diminue.
Afin de déterminer la masse de glucose contenue dans un sachet de médicament permettant la réhydratation, on réalise l’expérience suivante :
- une solution (S1) de volume V1 = 500,0 mL est préparée en dissolvant le contenu d’un sachet de médicament dans de l’eau distillée ;
- la solution (S1) est ensuite diluée d’un facteur 10 pour obtenir la solution (S2) ;
- en réalisant le même protocole expérimental que pour les solutions étalons, on mesure une absorbance A = 0,59 lorsqu’on utilise 10,0 mL de solution (S2) à la place de 10,0 mL de solution étalon.
2.5. Déterminer la masse de glucose contenue dans le sachet de médicament permettant la réhydratation et commenter le résultat obtenu.
A =0,59
$$A\ =\ -0,39\ \times C_m\ +\ 0,88$$
$$-0,39\ \times \ C_m+\ 0,88=A$$
$$-0,39\ \times \ C_m\ =A-0,88$$
$$C_m\ =\frac{A-0,88}{-0,39}$$
$$C_m\ =\frac{0,59-0,88}{-0,39}$$
$$C_m\ =0,74\ g.L^{-1}$$
Or « la solution (S1) est ensuite diluée d’un facteur 10 pour obtenir la solution (S2) »
$$C_{m1}=10 \times C_m\$$
$$C_{m1}=10 \times 0,74$$
$$C_{m1}=7,4\ g.L^{-1}$$
$$C_{m1}=\frac{m}{V}$$
$$m=C_{m1} \times V$$
$$m=7,4 \times 500.{10}^{-3}$$
m=3,7 g

La valeur est proche de la valeur indiquée.
