ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH104 et n°SPEPHCH113
Télécharger l’exercice en PDF :
L’acide oxalique, de formule brute H2C2O4, est couramment utilisé pour le traitement de surface des métaux.
En traitement antirouille, les solutions d’acide oxalique sont utilisées à une concentration de 3,3 x 10-1 mol·L-1.
Dans un laboratoire, une technicienne dispose d’une solution d’acide oxalique de concentration inconnue et elle cherche à déterminer si celle-ci peut convenir pour un traitement anti rouille.
Pour le savoir, elle veut déterminer, à l’aide d’un titrage, la concentration en quantité de matière d’acide oxalique. Celui-ci peut être réalisé à l’aide d’une solution aqueuse colorée de permanganate de potassium de formule (K+(aq) + MnO4–(aq)) de concentration en quantité de matière connue en ions MnO4–(aq).
À noter que la solution de permanganate de potassium utilisée doit être acidifiée. On utilise une solution d’acide sulfurique à cette fin.
Concentration en quantité de matière de la solution titrante.
La concentration en quantité de matière en ions permanganate de la solution disponible peut être obtenue par spectrophotométrie. Pour cela, quatre solutions étalons de concentration connue en ions permanganate sont choisies et leur absorbance respective mesurée. Les résultats expérimentaux obtenus sont consignés dans le tableau suivant :
| Solution | S1 | S2 | S3 | S4 |
| Concentration c (mmol·L-1) | 2,50 | 5,00 | 7,50 | 10,00 |
| Absorbance A | 0,45 | 0,92 | 1,35 | 1,85 |
Données :
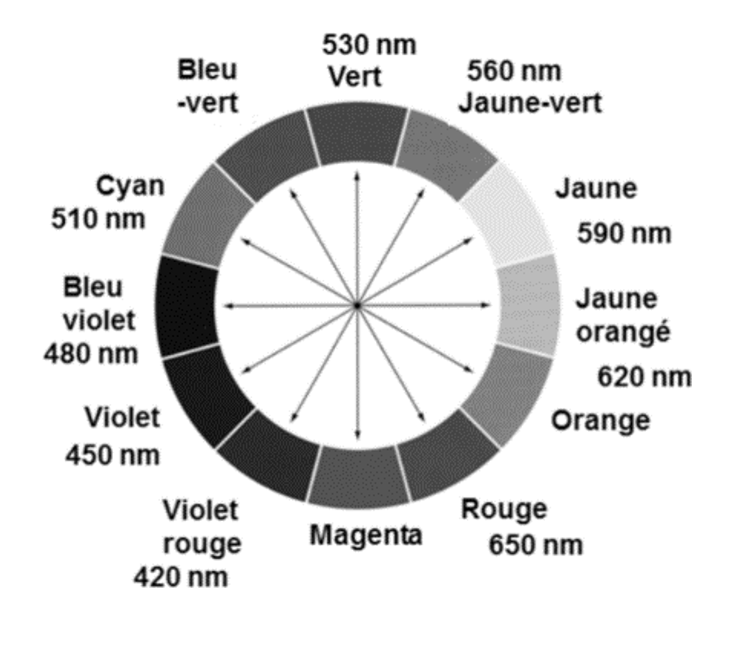
- Cercle chromatique
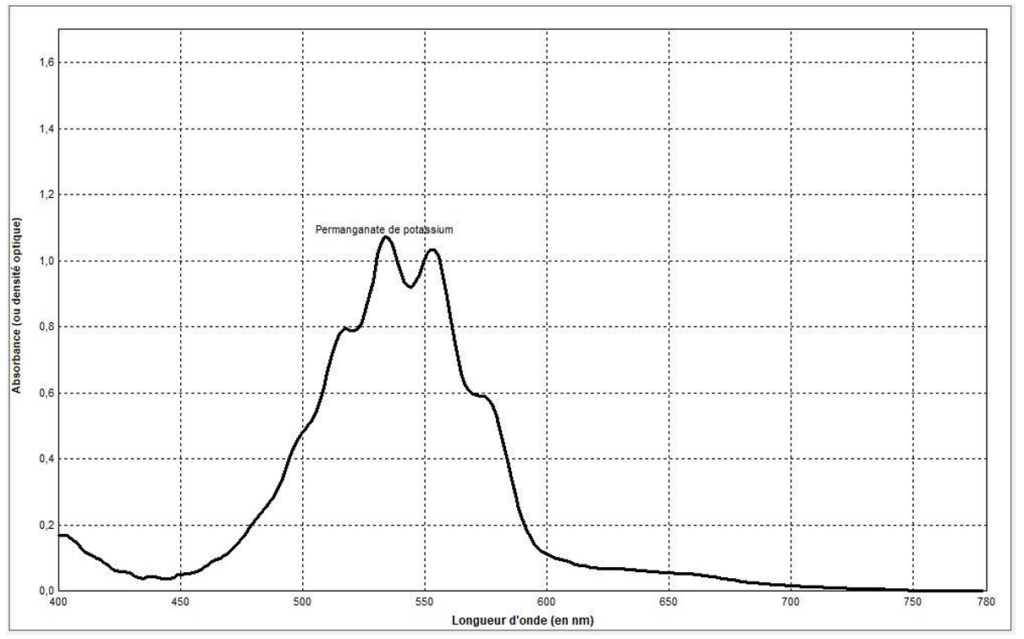
- Spectre d’absorption UV-Visible d’une solution de permanganate de potassium.
1. Prévoir la couleur de la solution de permanganate de potassium.
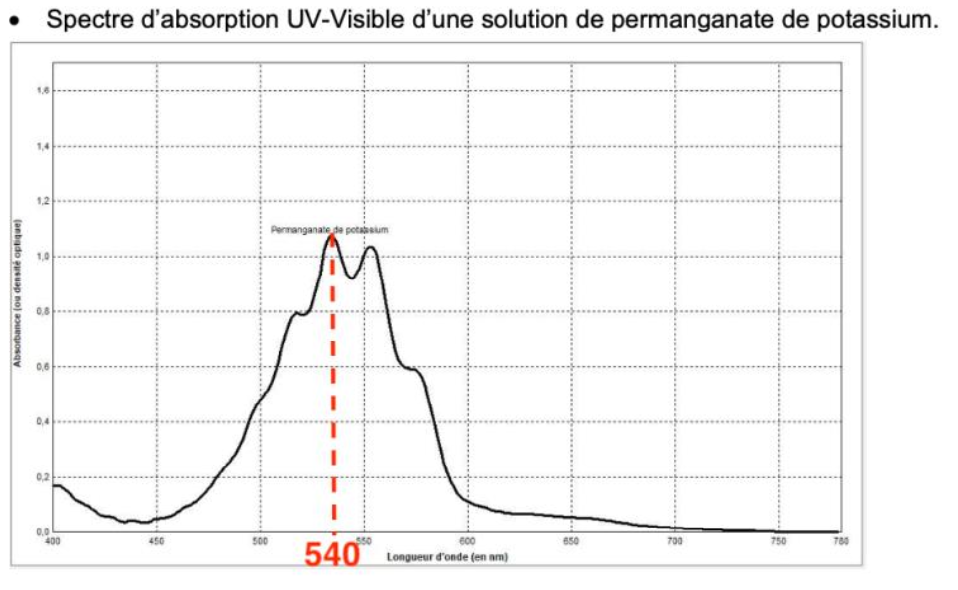
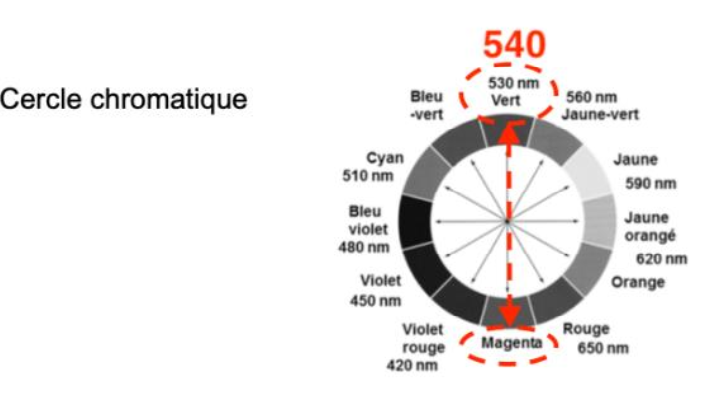
La couleur absorbée par de la solution de permanganate de potassium correspond à λmax= 540 nm : couleur vert.
La couleur de la solution de permanganate de potassium est la couleur complémentaire du vert (couleur opposée sur le cercle chromatique) : le magenta.
2. Proposer le protocole permettant de préparer 100 mL de la solution S2, à partir d’une solution de concentration égale à 100 mmol·L-1.
Lors d’une dilution la quantité de matière se conserve :
\[ \mathrm{ n_0 = n_2}\]
\[ \mathrm{ c_0 \times V_0 = c_2 \times V_2}\]
\[ \mathrm{ V_0 = \frac{c_2 \times V_2}{c_0}}\]
\[ \mathrm{ V_0 = \frac{5,00 \times 10^{-3} \times 100 \times 10^{-3}}{100 \times 10^{-3}}}\]
\[ \mathrm{ V_0 = 5,00 \times 10^{-3} \, \text{L}}\]
\[ \mathrm{ V_0 = 5,00 \, \text{mL}}\]
Protocole de la dilution :
- Prendre une fiole jaugée de volume V2=100 mL.
- À l’aide d’une pipette jaugée, ajouter V0=5,0 mL de la solution mère dans la fiole jaugée.
- Ajouter jusqu’au ¾ de l’eau distillée. Agiter.
- Ajuster avec de l’eau distillée jusqu’au trait de jauge.
- Homogénéiser
3. Déterminer, en vous appuyant sur les résultats expérimentaux consignés dans le tableau précédent et en expliquant avec soin votre démarche, la concentration en quantité de matière en ions permanganate de la solution titrante, sachant que son absorbance mesurée dans les mêmes conditions que celles utilisées pour S1, S2, S3 et S4, est égale à 1,50.
Méthode 1 :
On trace A=f(c)
La courbe est une droite passant par l’origine : A=Kc
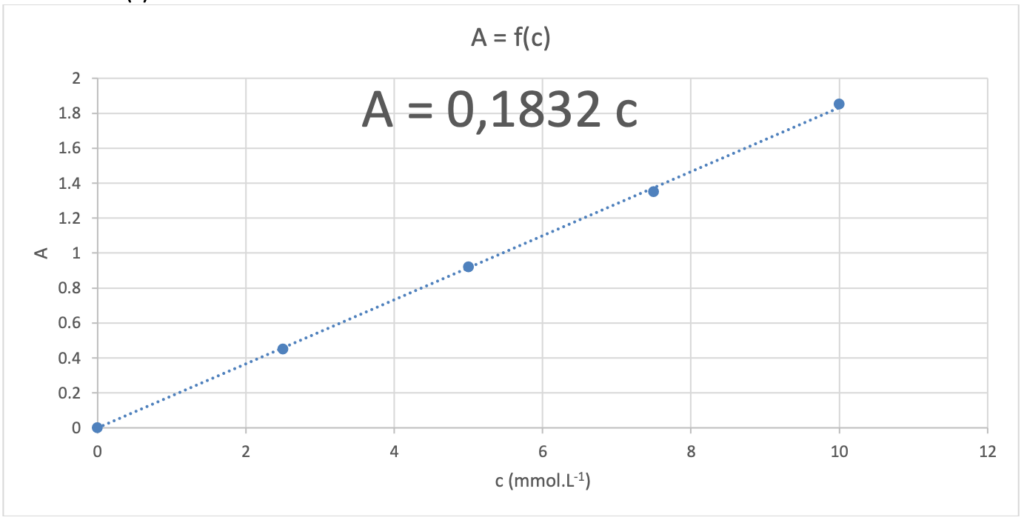
Option 1 : Calcul du coefficient directeur
\[ \mathrm{ k = \frac{y_B – y_A}{x_B – x_A}}\]
\[ \mathrm{ k = \frac{1{,}83 – 0}{10 – 0} = 0{,}183 \, \text{L} \cdot \text{mmol}^{-1}}\]
Ainsi, l’équation de la droite est :
\[ \mathrm{ A = 0{,}183 \times c}\]
Option 2 : Utilisation du tableur (non disponible le jour de l’examen)
Le tableur donne l’équation du graphique sous la forme :
\[ \mathrm{ A = 0{,}1832 \times c}\]
Pour déterminer la concentration c lorsque A = 1,50 :
\[ \mathrm{ 0{,}183 \times c = A}\]
\[ \mathrm{ c = \frac{A}{0{,}183} = \frac{1{,}50}{0{,}183} =8{,}20 \, \text{mmol} \cdot \text{L}^{-1}}\]
Option 3 : Lecture graphique
On lit graphiquement la valeur de la concentration pour A = 1,50, ce qui donne :
\[ \mathrm{ c = 8{,}2 \, \text{mmol} \cdot \text{L}^{-1}}\]
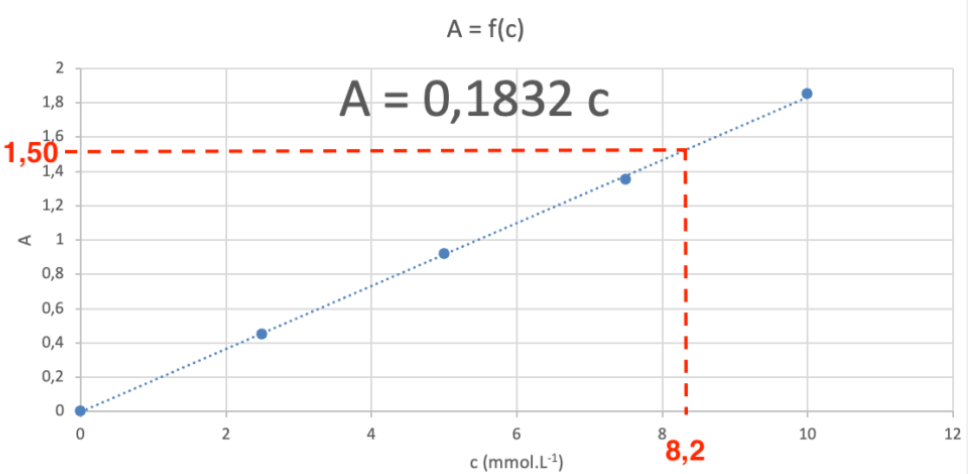
Méthode 2 : On calcule le rapport A/c pour chaque valeur
| A | 0,45 | 0,92 | 1,35 | 1,85 |
| c (mmol.L-1) | 2,5 | 5 | 7,5 | 10 |
| A/C(L.mmol-1) | 0,180 | 0,184 | 0,180 | 0,185 |
Pour trouver k, on fait la moyenne :
\[ \mathrm{ k = \frac{0{,}180 + 0{,}184 + 0{,}180 + 0{,}185}{4} }\]
\[ \mathrm{ k = 0{,}182 \, \text{L.mmol}^{-1} }\]
Ainsi :
\[ \mathrm{ A = 0{,}182 \times c }\]
\[ \mathrm{ 0{,}182 \times c = A }\]
\[ \mathrm{ c = \frac{A}{0{,}182} }\]
\[ \mathrm{ c = \frac{1{,}50}{0{,}182}}\]
\[ \mathrm{ c = 8{,}24 \, \text{mmol.L}^{-1}}\]
4. Écrire, avec un nombre adapté de chiffres significatifs, le résultat de la mesure de la concentration en quantité de matière de la solution titrante, sachant que l’incertitude- type associée à ce dosage est : uC = 0,04 mmol·L-1.
Prenons le résultat de la méthode 1 (la plus précise) : \( c = 8{,}20 \, \text{mmol} \cdot \text{L}^{-1} \)
Avec l’incertitude :
\[ \mathrm{ c = 8{,}20 \pm 0{,}04 \, \text{mmol} \cdot \text{L}^{-1} }\]
Réaction d’oxydo-réduction entre les ions permanganate et l’acide oxalique.
La réaction d’oxydo-réduction entre les ions permanganate et l’acide oxalique peut être modélisée par un transfert d’électrons entre les deux couples oxydant-réducteur associés aux deux demi-équations électroniques suivantes :
\[ \mathrm{ \text{MnO}_4^-\, (aq) + 8H^+\,(aq) + 5e^- \rightarrow \text{Mn}^{2+}\,(aq) + 4H_2O\,(l) }\]
\[ \mathrm{ 2CO_2\,(aq) + 2H^+\,(aq) + 2e^- \rightarrow H_2C_2O_4\,(l) }\]
5. Établir l’équation de la réaction modélisant la transformation chimique se produisant entre les ions permanganate et l’acide oxalique.
Réaction modélisant la transformation chimique se produisant entre les ions permanganate \(\text{MnO}_4^- \, (\text{aq})\) et l’acide oxalique \(\text{H}_2\text{C}_2\text{O}_4 \, (\text{l})\).
\[ \mathrm{ \text{MnO}_4^- \, (\text{aq}) + 8\text{H}^+ \, (\text{aq}) + 5\text{e}^- = \text{Mn}^{2+} \, (\text{aq}) + 4\text{H}_2\text{O} \, (\text{l}) }\]
\[ \mathrm{ 2\text{CO}_2 \, (\text{aq}) + 2\text{H}^+ \, (\text{aq}) + 2\text{e}^- = \text{H}_2\text{C}_2\text{O}_4 \, (\text{l}) }\]
\(\times 2\)
\[ \mathrm{ 2\text{MnO}_4^- \, (\text{aq}) + 16\text{H}^+ \, (\text{aq}) + 10\text{e}^- = 2\text{Mn}^{2+} \, (\text{aq}) + 8\text{H}_2\text{O} \, (\text{l}) }\]
\(\times 5\)
\[ \mathrm{ 5\text{H}_2\text{C}_2\text{O}_4 \, (\text{l}) = 10\text{CO}_2 \, (\text{aq}) + 10\text{H}^+ \, (\text{aq}) + 10\text{e}^- }\]
Réaction globale :
$2\text{MnO}_4^- \, (\text{aq}) + 16\text{H}^+ \, (\text{aq}) + 5\text{H}_2\text{C}_2\text{O}_4 \, (\text{l}) \rightarrow 2\text{Mn}^{2+} \, (\text{aq}) + 8\text{H}_2\text{O} \, (\text{l}) + 10\text{CO}_2 \, (\text{aq}) + 10\text{H}^+ \, (\text{aq}) $
On simplifie les \(\text{H}^+\) de part et d’autre de l’équation :
$2\text{MnO}_4^- \, (\text{aq}) + 6\text{H}^+ \, (\text{aq}) + 5\text{H}_2\text{C}_2\text{O}_4 \, (\text{l}) \rightarrow 2\text{Mn}^{2+} \, (\text{aq}) + 8\text{H}_2\text{O} \, (\text{l}) + 10\text{CO}_2 \, (\text{aq}) $
6. Préciser quelle espèce chimique est l’oxydant et laquelle est le réducteur.
Un oxydant est une espèce capable de capter un ou plusieurs électrons. MnO4–(aq) capte des électrons : c’est l’oxydant.
Un réducteur est une espèce capable de céder un ou plusieurs électrons. H2C2O4(l) cède des électrons : c’est le réducteur.
Titrage de la solution d’acide oxalique diluée et conclusion.
Avant de réaliser le titrage, la technicienne réalise une expérience préalable pour visualiser les changements de couleur. Quand elle verse quelques gouttes de solution colorée de permanganate de potassium dans un bécher contenant de l’acide oxalique incolore sur environ 1 cm de hauteur, elle observe après quelques instants, une décoloration de la solution de permanganate de potassium.
Ensuite, elle dilue au centième la solution d’acide oxalique disponible au laboratoire.
Enfin, la technicienne doit verser un volume VE = 12,5 mL dans un volume V1 = 100 mL de la solution d’acide oxalique disponible au laboratoire, préalablement dilué au centième, pour atteindre l’équivalence. La concentration en quantité de matière de la solution de permanganate de potassium utilisée par la technicienne est : c = 8,2 mmol·L-1.
On rappelle que les ions H+(aq) sont en excès et qu’il ne faut pas en tenir compte.
7. Faire un schéma légendé du dispositif de titrage.
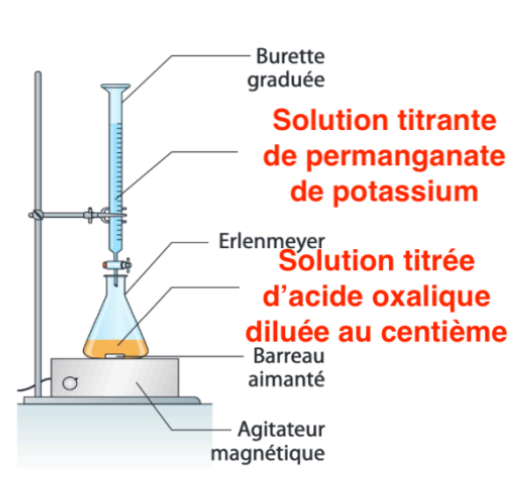
8. Indiquer le changement de couleur observé à l’équivalence.
L’acide oxalique est incolore et le permanganate de potassium est magenta (question 1).
Avant l’équivalence, le permanganate de potassium est le réactif limitant et l’acide oxalique le réactif en excès. Le mélange est de la couleur du réactif en excès : il est incolore.
Après l’équivalence, le permanganate de potassium est le réactif en excès et l’acide oxalique le réactif limitant. Le mélange est de la couleur du réactif en excès : il est magenta.
Ainsi, à l’équivalence on observe un changement de couleur de l’incolore au magenta.
9. Montrer que la relation entre les quantités de matière de réactifs introduites pour atteindre l’équivalence correspond à l’expression suivante :
\[ \mathrm{ n(\text{MnO}_4^-)_{vE} = \frac{2}{5}n(\text{H}_2\text{C}_2\text{O}_4) }\]
$n(\text{MnO}_4^-)_{vE}$ étant la quantité de matière en ions permanganate qu’il faut ajouter pour obtenir l’équivalence.
\[ 2 \text{MnO}_4^- \, (\text{aq}) + 6 \text{H}^+ \, (\text{aq}) + 5 \text{H}_2 \text{C}_2 \text{O}_4 \, (\text{l}) \rightarrow 2 \text{Mn}^{2+} \, (\text{aq}) + 8 \text{H}_2 \text{O} \, (\text{l}) + 10 \text{CO}_2 \, (\text{aq}) \]
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
\[ \frac{n(\text{MnO}_4^-)}{2} = \frac{n(\text{H}_2 \text{C}_2 \text{O}_4)}{5} \]
Ainsi :
\[ n(\text{MnO}_4^-) = \frac{2}{5} n(\text{H}_2 \text{C}_2 \text{O}_4) \]
10. Déterminer si la solution d’acide oxalique de concentration inconnue disponible au laboratoire, peut ou ne peut pas convenir pour un traitement anti rouille. Conclure en faisant preuve d’esprit critique.
D’après l’énoncé : « En traitement antirouille, les solutions d’acide oxalique sont utilisées à une concentration de \(3{,}3 \times 10^{-1} \, \text{mol} \cdot \text{L}^{-1}\). »
Calculons la concentration de la solution d’acide oxalique :
\[ \frac{n(\text{MnO}_4^-)}{2} = \frac{n(\text{H}_2 \text{C}_2 \text{O}_4)}{5} \]
\[ \frac{2}{5} n(\text{H}_2 \text{C}_2 \text{O}_4) = n(\text{MnO}_4^-) \]
\[ n(\text{H}_2 \text{C}_2 \text{O}_4) = \frac{5}{2} n(\text{MnO}_4^-) \]
Or
\[ n = cV \]
D’où
\[ c_1 V_1 = \frac{5}{2} c V_E \]
\[ c_1 = \frac{5}{2} \times \frac{c V_E}{V_1} \]
\[ c_1 = \frac{5}{2} \times \frac{8{,}2 \times 10^{-3} \times 12{,}5}{100} \]
\[ c_1 = 2{,}6 \times 10^{-3} \, \text{mol} \cdot \text{L}^{-1} \]
Or la solution d’acide oxalique disponible au laboratoire, préalablement diluée au centième.
Ainsi :
\[ c_0 = 100 \times c_1 \]
\[ c_0 = 100 \times 2{,}6 \times 10^{-3} \]
\[ c_0 = 2{,}6 \times 10^{-1} \, \text{mol} \cdot \text{L}^{-1} \]
La concentration trouvée \(2{,}6 \times 10^{-1} \, \text{mol} \cdot \text{L}^{-1}\) est inférieure à celle utilisée pour le traitement antirouille \(3{,}3 \times 10^{-1} \, \text{mol} \cdot \text{L}^{-1}\).
Ainsi, la solution d’acide oxalique de concentration inconnue disponible au laboratoire ne peut pas convenir pour un traitement anti-rouille.
La concentration trouvée est néanmoins du même ordre de grandeur. Il faut vérifier si la dilution, le prélèvement et le dosage ont été effectués avec précision.
