Bac Amérique du nord 2024 Sujet 2
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°24-PYCJ2AN1
Sujet et corrigé
EXERCICE 3 : acidité totale du vin (4 points)
Dans cet exercice, on s’intéresse à l’étude d’un acide faible présent dans le vin puis à la détermination d’une grandeur imposée par la réglementation viticole : l’acidité totale.
1. Étude de l’acide tartrique
On donne la formule de l’acide tartrique, l’un des acides faibles présents dans le vin :
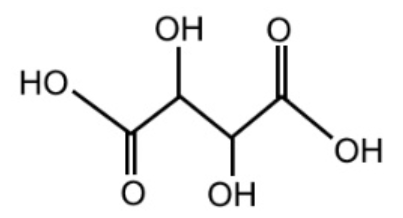
Q.1. Reproduire sur votre copie la formule topologique de l’acide tartrique et entourer les groupes caractéristiques.
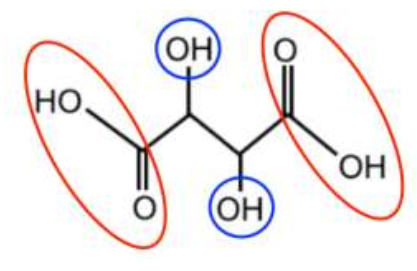
Q.2. Nommer les familles fonctionnelles correspondantes.
COOH : Famille acide carboxylique
OH : Famille alcool
2. Acidité totale du vin
Données :
– pKA (H2CO3(aq) / HCO3−(aq)) = 6,4
– pKA (HCO3−(aq) / CO2−(aq)) = 10,3
– masse molaire de l’acide sulfurique H2SO4 : M(H2SO4) = 98,1 g·mol-1
– masse molaire de l’acide tartrique : M = 150,0 g·mol-1
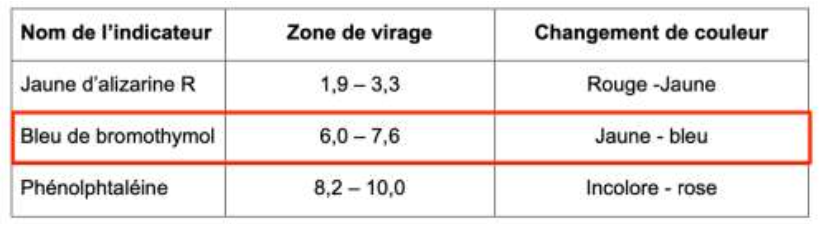
– zones de virage de plusieurs indicateurs colorés :
| Nom de l’indicateur | Zone de virage | Changement de couleur |
| Jaune d’alizarine R | 1,9 – 3,3 | Rouge -Jaune |
| Bleu de bromothymol | 6,0 – 7,6 | Jaune – bleu |
| Phénolphtaléine | 8,2 – 10,0 | Incolore – rose |
– incertitude-type $u(\overline{X})$ sur la valeur moyenne $\overline{X}$ d’une série de mesure :
$$ u(\overline{X})=\frac{s(X)}{\sqrt{n}} $$
où
$u(\overline{X})$ est l’incertitude-type de la moyenne
$s(X)$ est l’écart-type expérimental
$n$ le nombre de mesures réalisées
– pour comparer le résultat d’une mesure $X_{mes}$ à une valeur de référence $X_{ref}$, on utilise le quotient $\frac{\left|X_{mes}-X_{ref}\right|}{u(X)}$ où $u(X)$ est l’incertitude-type associée au résultat.
Le dioxyde de carbone se dissout dans l’eau du vin. Cette dissolution aboutit à la formation d’acide carbonique H2CO3(aq). L’acide carbonique est un diacide faible dont les bases associées sont les ions hydrogénocarbonate HCO3−(aq) et les ions carbonate CO32−(aq).
Cet acide n’entrant pas en compte dans la définition de l’acidité du vin ; il est nécessaire de l’éliminer avant le titrage de l’acidité totale du vin. Le protocole expérimental de détermination de l’acidité totale est donné ci-dessous :
- 1ère étape : protocole d’élimination de l’acide carbonique
On place un volume de 50 mL de vin dans un erlenmeyer relié à une trompe à vide. On agite sous vide pendant deux ou trois minutes pour éliminer l’acide carbonique du vin.
- 2ème étape : protocole de titrage Dans un erlenmeyer, on place :
– un volume VA de vin dont on a éliminé l’acide carbonique ;
– 10 mL d’eau distillée ;
– 4 à 5 gouttes d’indicateur coloré.
On ajoute une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)) de concentration connue. L’équivalence est supposée atteinte lorsque le pH vaut 7,0.
Le pH d’un vin doit être compris entre 2,70 et 3,70.
Q.3. Représenter le diagramme de prédominance faisant intervenir les couples H2CO3(aq) / HCO3−(aq) et HCO3−(aq) / CO32−(aq).
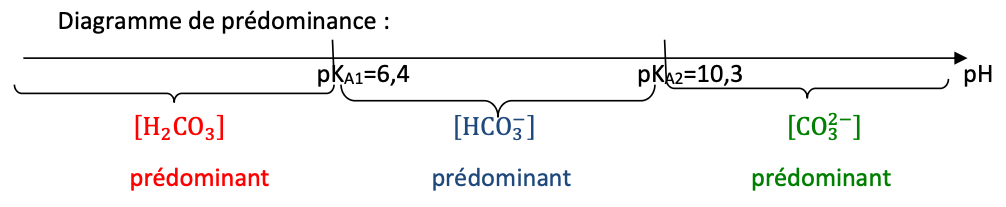
Q.4. En déduire pourquoi il est nécessaire lors d’une première étape d’éliminer l’acide carbonique du vin.
Le pH du vin doit être compris entre 2,70 et 3,70. Dans cette zone de pH, l’acide carbonique H2CO3 est prédominant.
Ainsi, pour qu’il n’intervienne pas dans le dosage, ii est nécessaire lors d’une première étape d’éliminer l’acide carbonique du vin.
Q.5. Indiquer en justifiant le nom de l’indicateur coloré à utiliser dans l’étape 2 du protocole.
L’équivalence est supposée atteinte lorsque le pH vaut 7,0.
Pour choisir un indicateur coloré, il faut que le pH à l’équivalence soit compris dans sa zone de virage.
Nous choisissons le bleu de bromothymol comme indicateur coloré.
En France, l’acidité totale AT d’un vin est définie comme équivalente à la concentration en masse d’acide sulfurique H2SO4(aq). La réglementation impose une teneur comprise entre 3,0 et 6,0 g.L– 1.
La détermination de l’acidité totale s’effectue par titrage avec une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)) de concentration CB = 0,100 mol·L-1, selon l’équation de la réaction support du titrage :
H2SO4(aq) + 2 HO–(aq) → SO42-(aq) + 2 H2O(l)
Pour pérenniser la qualité de son produit, un viticulteur teste chaque année son vin et souhaite une production dont l’acidité totale reste stable à 3,45 g·L-1.
Le protocole de titrage est réalisé avec VA = 5,0 mL de vin.
Le changement de couleur est observé pour un volume ajouté d’hydroxyde de sodium : VB = 3,5 mL.
Q.6. Déterminer la valeur de l’acidité totale AT du vin analysé.
$$H_2SO_4\left(aq\right)+2HO^-\left(aq\right)\rightarrow SO_4^{2-}\left(aq\right)+2H_2O\left(l\right)$$
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques :
$$\frac{n_{H_2SO_4}^i}{1}=\frac{n_{HO^-}^{eq}}{2}$$
$$C_A\times V_A=\frac{C_B\times V_{eq}}{2}$$
$$C_A=\frac{C_B\times V_{eq}}{2\times V_A}$$
Nous cherchons la teneur (concentration massique) :
$$C_m=C_A\times M$$
Ainsi
$$C_m=\frac{C_B\times V_{eq}}{2\times V_A}\times M$$
$$C_m=\frac{0,100\times 3,5}{2\times 5,0}\times 98,1$$
$$C_m=3,4\ g.L^{-1}$$
La valeur de l’acidité totale AT du vin analyse est de 3,4 g.L-1.
Le titrage est ensuite reproduit 10 fois et les résultats sont consignés dans le tableau suivant :
| Expérience | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Acidité totale calculée (en g.L-1) | 3,41 | 3,38 | 3,52 | 3,45 | 3,43 | 3,45 | 3,44 | 3,41 | 3,42 | 3,40 |
Q.7. Calculer la valeur moyenne de l’acidité totale $\overline{AT}$ et l’incertitude-type $u(\overline{AT})$ sur l’acidité totale à partir des résultats précédents.
Valeur moyenne de l’acidité totale $\overline{AT}$ :
$$\overline{AT}=\frac{3,41+3,38+3,52+3,45+3,43+3,45+3,44+3,41+3,42+3,40}{10}$$
$$\overline{AT}=3,431\ g.L^{-1}$$
La valeur moyenne de l’acidité totale est $\overline{AT}=3,431\ g.L^{-1}$.
Valeur moyenne de l’incertitude-type u(AT) :
$$u\left(\overline{AT}\right)=\frac{s\left(AT\right)}{\sqrt{n}}$$
La valeur de s(AT) l’écart type expérimental est obtenue via la fonction statistique de la calculatrice.
$$s\left(AT\right)=0,0384$$
Ainsi :
$$u\left(\overline{AT}\right)=\frac{0,0384}{\sqrt{10}}$$
$$u\left(\overline{AT}\right)=0,02$$
Remarque : on ne garde qu’un chiffre significatif pour l’incertitude qu’on majore
Ainsi :
$$AT=3,43\pm 0,02\ g.L^{-1}$$
Écrire le résultat de la mesure de l’acidité totale moyenne avec un nombre adapté de chiffres significatifs, $u(\overline{AT})$ étant écrit avec un seul chiffre significatif.
Q.8. Comparer le résultat de cette acidité totale moyenne à la valeur souhaitée par le viticulteur. Conclure.
Pour comparer le résultat d’une mesure a une valeur de référence, on utilise le quotient :
$$\frac{\left|{\rm AT}{mes}-{\rm AT}{ref}\right|}{u\left(\overline{AT}\right)}=\frac{\left|3,43-3,45\right|}{0,02}$$
$$\frac{\left|{\rm AT}{mes}-{\rm AT}{ref}\right|}{u\left(\overline{AT}\right)}=1$$
Le quotient est égal à 1 : les deux valeurs sont compatibles.
Cette acidité totale moyenne et la valeur souhaitée par le viticulteur sont compatibles.
En Alsace, l’acidité totale est donnée en équivalent d’acide tartrique, et non en équivalent d’acide sulfurique. L’acide tartrique H2A est aussi un diacide ; l’équation de la réaction support du titrage est alors :
H2A(aq) + 2 HO–(aq) → A2-(aq) + 2 H2O(l)
Q.9. Choisir la proposition exacte ci-dessous et justifier votre choix.
a. En Alsace, l’acidité totale d’un vin doit être comprise entre 3,0 et 6,0 g·L-1.
b. En Alsace, l’acidité totale d’un vin doit être comprise entre 4,6 g·L-1et 9,2 g·L-1.
c. En Alsace, l’acidité totale d’un vin doit être comprise entre 1,8 g·L-1et 3,2 g·L-1.
L’acide tartrique H2A est aussi un diacide comme l’acide sulfurique. L’équation de réaction est semblable (ils réagissent tous deux avec 2 ions HO–).
En termes de concentration molaire elle est identique (Cependant, n’ayant pas la même masse molaire, la concentration massique est différence) :
$$C_{acide\ sulfurique}=C_{acide\ tartrique}$$
Or
$$C_m=C\times M$$
$$C_{m\ acide\ sulfurique}\times M_{acide\ sulfurique}=C_{m\ acide\ tartrique}\times M_{acide\ tartrique}$$
$$C_{m\ acide\ sulfurique}=\frac{C_{m\ acide\ tartrique}\times M_{acide\ tartrique}}{M_{acide\ sulfurique}}$$
Prenons les deux valeurs 3,0 et 6,0 g·L-1 :
$$C_{m\ acide\ sulfurique}=\frac{3,0\times 150,0}{98,1}$$
$$C_{m\ acide\ sulfurique}=4,6\ g.L^{-1}$$
$$C_{m\ acide\ sulfurique}=\frac{6,0\times 150,0}{98,1}$$
$$C_{m\ acide\ sulfurique}=9,2\ g.L^{-1}$$
C’est pourquoi la règlementation impose la même teneur à savoir :
b. En Alsace, l’acidité totale d’un vin doit être comprise entre 4,6 et 9,2 g·L-1.
