Asie 2025 Sujet 1
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°25-PYCJ1JA1
Sujet et corrigé
Exercice 3 – Arôme de poire (4 points)
Les esters sont des composés organiques à l’origine de l’arôme des fruits et de l’odeur de certains parfums. Ils sont facilement synthétisés au laboratoire.
L’objectif de cet exercice est d’étudier la synthèse de l’éthanoate de pentyle, molécule responsable de l’arôme de poire.
Données :
| Pentan-1-ol | Acide éthanoïque | Ethanoate de pentyle | |
| Masse molaire (g·mol−1) | 88,0 | 60,0 | 130,0 |
| Densité (-) | 0,814 | 1,05 | 0,880 |
| Solubilité dans l’eau | Faible | Totale | Nulle |
Bandes d’absorption infrarouge (IR) de quelques types de liaisons chimiques :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H | 3 100 – 3 500 | Forte et large |
| O-H des acides carboxyliques | 2 500 – 3 200 | Forte à moyenne, large |
| C-H | 2 900 – 3 100 | Moyenne à forte |
| C=O des acides carboxyliques | 1 740 – 1 800 | Forte |
| C=O des esters | 1 730 – 1 750 | Forte |
Partie 1 – L’éthanoate de pentyle
L’éthanoate de pentyle, de formule brute C7H14O2, est un ester qui possède plusieurs isomères de constitution.
Q1- Définir un isomère de constitution.
Des isomères de constitution sont des molécules qui ont la même formule brute mais des formules développées différentes.
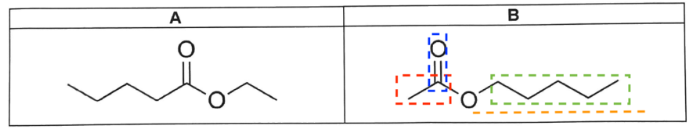
Parmi les deux isomères A et B ci-dessous se trouve la molécule d’éthanoate de pentyle.

Q2- Identifier, en justifiant, l’isomère dont la formule correspond à celle de l’éthanoate de pentyle.
éthanoate de pentyle :
- éthanoate : 2 atomes de carbone sur la partie qui porte la liaison double C=O
- pentyle: 5 atomes de carbone sur la deuxième partie de la molécule
Q3- Justifier que le spectre infrarouge présenté sur la figure 1 ci-après peut correspondre aux deux isomères A et B.
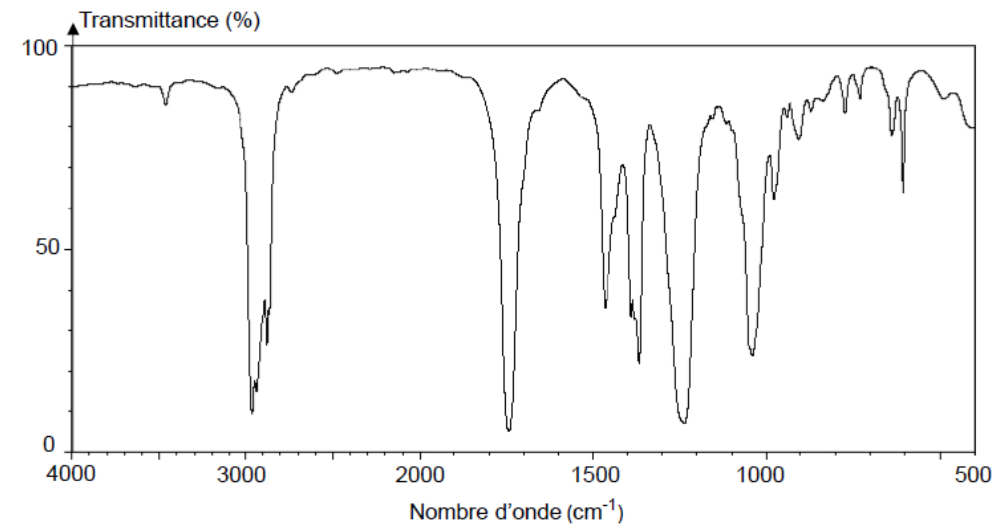
Figure 1 : Spectre infrarouge de l’un des deux isomères

Les molécules A et B sont des esters, ils ont chacun une liaison :
- une liaison C=O d’un ester (nombre d’onde compris entre 1730 et 1750 cm-1)
- des liaisons C-H (nombre d’onde compris entre 2900 et 3100 cm-1)
Ainsi, le spectre infrarouge présenté sur la figure 1 ci-après peut correspondre aux deux isomères A et B.
Partie 2 – Synthèse organique
Document – Protocole expérimental
– Chauffer à reflux pendant 30 min un mélange contenant un volume V1 = 54,0 mL de pentan-1-ol, une quantité de matière n2 = 0,50 mol d’acide éthanoïque, quelques gouttes d’acide sulfurique concentré, catalyseur de la réaction, et quelques grains de pierre ponce.
– Prélever à intervalles réguliers un volume V du mélange réactionnel. Le verser dans un bécher placé dans un bain d’eau glacée.
– Doser le volume V par une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)) en présence d’un indicateur coloré.
– Déterminer la quantité de matière d’acide éthanoïque nacide n’ayant pas réagi. En déduire la quantité de matière nester produite.
– Tracer l’évolution de la quantité de matière nester produite en fonction du temps. Le graphique obtenu est présent sur la figure 2 ci-après.
Q4- Citer deux avantages que présente un montage de chauffage à reflux.
Un montage de chauffage à reflux permet d’accélérer la réaction sans perte de matière.

Figure 2 : Évolution de la quantité de matière d’ester formé au cours du temps L’équation de la réaction modélisant la transformation chimique ayant lieu s’écrit :
C5H12O (𝓁) + C2H4O2 (𝓁) ⇆ C7H14O2 (𝓁) + H2O (𝓁)
La constante K de cet équilibre, qui dépend peu de la température, a pour valeur K = 4.
Q5- Exprimer puis calculer le quotient réactionnel initial Qr,0.
$$C_5H_{12}O(l)+C_2H_4O_2(l)\rightleftarrows C_7H_{14}O_2(l)+H_2O(l)$$
Toutes les espèces sont liquides, on peut exprimer le quotient réactionnel via les quantités de matière :
$$Q_{r,0}=\frac{n_{C_7H_{14}O_2}^0\times n_{H_2O}^0}{n_{C_5H_{12}O}^0\times n_{C_2H_4O_2}^0}$$
Or
$n_{C_7H_{14}O_2}^0=n_{H_2O}^0=0\ mol$
Ainsi
$$Q_{r,0}=\frac{0\times 0}{n_{C_5H_{12}O}^0\times n_{C_2H_4O_2}^0}$$
$$Q_{r,0}=0$$
Q6- En déduire le sens d’évolution spontanée de la transformation.
$K=4$
$Q_{r,0}<K$ : le sens d’évolution spontanée de la transformation est le sens direct.
Q7- Déterminer la valeur de l’avancement maximal xmax de la réaction.
$$C_5H_{12}O(l)+C_2H_4O_2(l)\rightleftarrows C_7H_{14}O_2(l)+H_2O(l)$$
$x_{max\ 1}=\frac{n_{C_5H_{12}O}^0}{1}$
$n_{C_5H_{12}O}^0=n_1=\frac{m_1}{M_1}$
D’où
$x_{max\ 1}=\frac{m_1}{M_1}$
Or
$\rho_1=\frac{m_1}{V_1}$
$\frac{m_1}{V_1}=\rho_1$
$m_1=\rho_1\times V_1$
D’où
$x_{max\ 1}=\frac{\rho_1\times V_1}{M_1}$
Or
$\rho_1=d_1\times \rho_{eau}$
D’où
$x_{max\ 1}=\frac{d_1\times \rho_{eau}\times V_1}{M_1}$
$x_{max\ 1}=\frac{0,814\times 1000\times 54,0\times {10}^{-3}}{88,0}$
$x_{max\ 1}=0,500\ mol$
$x_{max\ 2}=\frac{n_{C_2H_4O_2}^0}{1}$
$n_{C_2H_4O_2}^0=n_2$
D’où
$x_{max\ 2}=n_2$
$x_{max\ 2}=0,50\ mol$
$x_{max}=x_{max\ 1}=x_{max\ 2}=0,50\ mol$
Q8- Calculer la valeur du rendement r de la réaction en utilisant le graphique de la figure 2.
$r=\frac{n_{ester}^{exp}}{n_{ester}^{th}}$
$n_{ester}^{th}=x_{max}=0,50\ mol$
Graphiquement : $n_{ester}^{exp}=0,33\ mol$

$r=\frac{0,33}{0,50}$
$r=0,66$
$r=66\ %$
Q9- Choisir, en justifiant, une (des) proposition(s) pour améliorer le rendement de la réaction parmi les propositions suivantes :
- Augmenter la température du mélange réactionnel.
- Éliminer l’eau au fur et à mesure de sa formation.
- Augmenter la quantité de matière d’acide éthanoïque.
- Augmenter la quantité d’acide sulfurique.
Pour améliorer le rendement de la réaction il faut :
b) Éliminer l’eau au fur et à mesure de sa formation.
Car $Qr$ sera toujours nul (avec $n_{H_2O}=0\ mol$) et donc toujours inférieur à K.
c) Augmenter la quantité de matière d’acide éthanoïque.
Car $Qr$ baissera et la réaction ira dans le sens direct.
