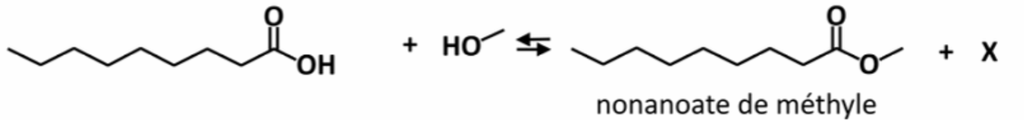Centres étrangers 2025 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ1G11
Sujet et corrigé
EXERCICE 1 : AUTOUR DU GÉRANIUM ROSAT (9 POINTS)
L’acide pélargonique, espèce chimique extraite des feuilles du géranium rosat, entre dans la composition des produits phytosanitaires de désherbage en agriculture biologique. En nomenclature officielle, l’acide pélargonique se nomme acide nonanoïque.
Cet exercice s’intéresse successivement à l’identification et au dosage de l’acide pélargonique contenu dans un désherbant, puis à la synthèse d’un des composants d’un produit cosmétique à partir de l’acide nonanoïque.
Données :
– Table des bandes d’absorption IR :
| Liaison | σ (cm-1) | Intensité |
| O − H alcool | 3200 – 3400 | Forte et large |
| O − H acide carboxylique | 2500 – 3200 | Forte à moyenne, large |
| C = O ester | 1700 – 1740 | Forte et fine |
| C = O aldéhyde | 1720 – 1740 | Forte et fine |
| C = O cétone | 1705 – 1725 | Forte et fine |
| C = O acide carboxylique | 1680 – 1710 | Forte et fine |
1. Identification de la substance active du désherbant
La formule topologique de la molécule d’acide pélargonique (ou acide nonanoïque) est donnée ci-après :

Q.1. Écrire la formule semi-développée de l’acide nonanoïque. Entourer le groupe caractéristique de la molécule puis nommer la famille fonctionnelle associée.
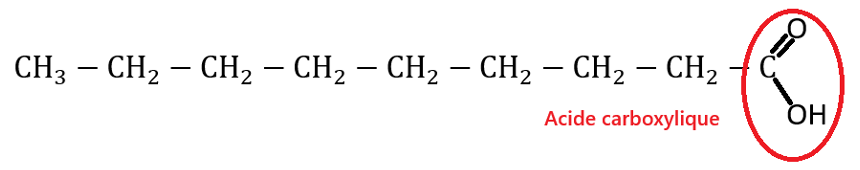
Pour vérifier la nature de l’espèce chimique contenue dans le flacon de désherbant, différents contrôles sont effectués parmi lesquels une analyse par spectroscopie infrarouge (IR).
Le spectre d’absorption IR de l’échantillon obtenu est représenté ci-après :
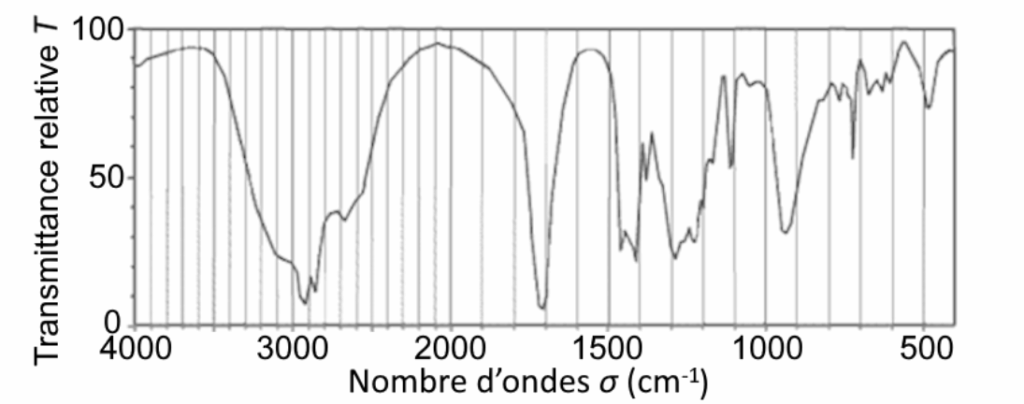
Source : d’après Unisciel, uel.unisciel.fr
Q.2. Justifier que le spectre de l’échantillon peut correspondre à celui de l’acide nonanoïque.
Le spectre d’absorption IR de l’échantillon présente :
- Une bande correspondant à une liaison C = O acide carboxylique (nombre d’onde compris entre 1680 et 1710 cm-1)
- Une bande correspondant à une liaison O-H acide carboxylique (nombre d’onde compris entre 2500 et 3200 cm-1)
Ces deux liaisons sont caractéristiques de la famille des acides carboxylique.
Ainsi, le spectre de l’échantillon peut correspondre à celui de l’acide nonanoïque.
2. Dosage de l’espèce chimique active du désherbant
Sur l’étiquette du flacon de désherbant, on peut lire les informations suivantes :
« Le désherbant concentré est une solution polyvalente idéale pour éliminer facilement les mauvaises herbes du jardin. Sa formulation à partir d’acide pélargonique à 250 g·L-1, une substance active d’origine végétale, est sans danger pour vos animaux domestiques qui peuvent revenir sur les surfaces traitées dès que le produit est sec ».
Pour vérifier la concentration en masse en acide pélargonique (ou acide nonanoïque) du désherbant, on réalise un dosage par titrage à l’aide d’un suivi pH-métrique. La solution commerciale est diluée 10 fois. On obtient une solution notée S dont on prélève VA = 10,0 mL que l’on titre par une solution aqueuse d’hydroxyde de sodium (Na+(aq), HO–(aq)) de concentration en quantité de matière CB = 0,100 mol·L-1 avec une incertitude-type u(CB) = 0,002 mol·L-1.
On dispose de fioles jaugées (50,0 mL ; 100,0 mL ; 200,0 mL), et de pipettes jaugées (2,0 mL ; 10,0 mL ; 25,0 mL).
Données :
- Masse molaire de l’acide nonanoïque : M (acide nonanoïque) = 158,24 g·mol-1 ;
- Incertitudes-types notées sur la verrerie :
| Pipette jaugée de | |||
| V | 2,0 mL | 10,0 mL | 25,0 mL |
| u(V) | 0,01 mL | 0,02 mL | 0,03 mL |
- Incertitude-type sur la lecture graphique du volume équivalent : u(VE) = 0,5 mL ;
- Incertitude-type u(A) d’une grandeur A : si $A=\dfrac{X\times Y}{Z}$ $$u(A)=A\times\sqrt{\left(\frac{u(X)}{X}\right)^2+\left(\frac{u(Y)}{Y}\right)^2+\left(\frac{u(Z)}{Z}\right)^2}$$
- Pour discuter de la compatibilité du résultat d’une mesure Ames avec une valeur de référence Aref, on peut utiliser le quotient $$\frac{|A_{\text{mes}}-A_{\text{ref}}|}{u(A)}$$ avec Ames la valeur mesurée, Aref la valeur de référence et u(A) l’incertitude-type de la valeur mesurée Ames.
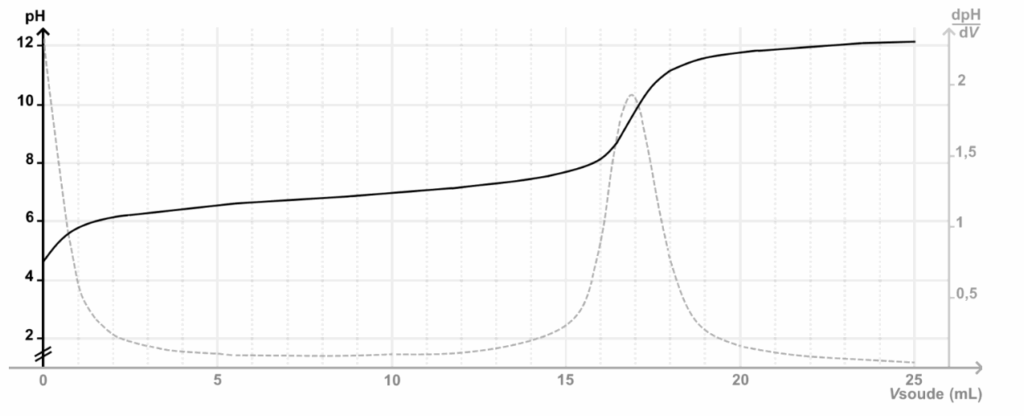
Courbe de suivi pH-métrique du titrage de la solution S :
Q.3. Sélectionner, parmi la verrerie disponible, celle qui est à utiliser pour effectuer la dilution de la solution commerciale nonanoïque. Justifier la réponse.D’après l’énoncé : « La solution commerciale est diluée 10 fois. »
D’après l’énoncé : « La solution commerciale est diluée 10 fois. »
$$F=\frac{V_1}{V_0}$$
$V_1=F\times V_0$
$V_1=10\times V_0$
Le volume V1 de la solution fille (volume de la fiole jaugée), doit être 10 plus grand que le volume V0 de la solution mère (volume de la pipette jaugée).
Pour une pipette jaugée V0=2,0 mL, il faudrait une fiole jaugée V1=20 mL. Or il n’y a pas de fiole jaugée V1=20 mL.
Pour une pipette jaugée V0=10,0 mL, il faudrait une fiole jaugée V1=100,0 mL. Le matériel est disponible.
Pour une pipette jaugée V0=25,0 mL, il faudrait une fiole jaugée V1=250 mL. Or il n’y a pas de fiole jaugée V1=250 mL.
On choisit :
- une pipette jaugée V0=10,0 mL
- une fiole jaugée V1=100,0 mL
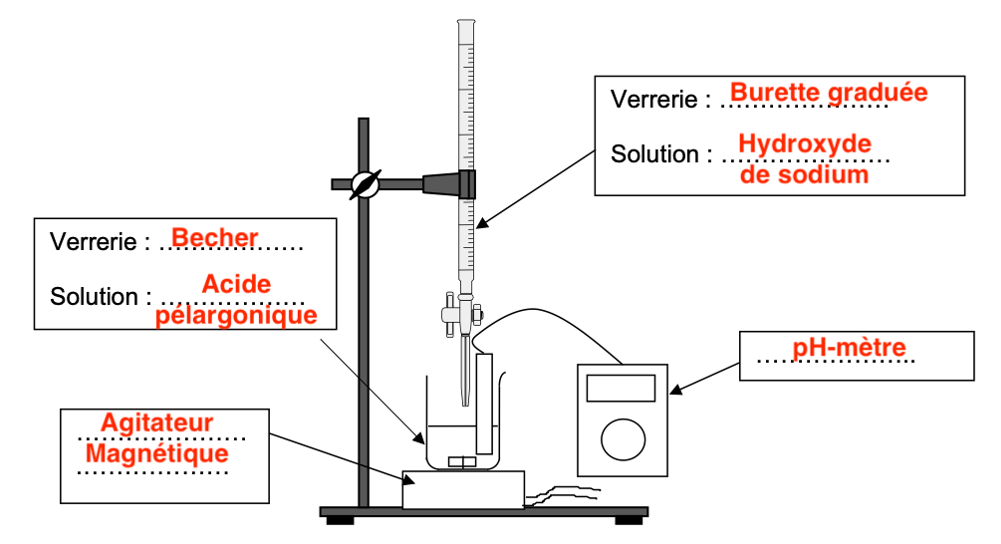
Q.4. Réaliser un schéma du dispositif permettant d’effectuer ce titrage pH-métrique et nommer la verrerie et les solutions.
Q.5. Écrire l’équation de la réaction support du titrage entre l’ion hydroxyde et l’acide nonanoïque. On utilisera la notation R − COOH pour désigner l’acide nonanoïque.
L’équation de la réaction support du titrage est :
$$\text{R-COOH (aq)} + \text{HO}^- (aq) \rightarrow \text{R-COO}^- (aq) + H_2O (l)$$
Q.6. Sélectionner parmi les termes suivants, la ou les qualité(s) que doit posséder la réaction support du titrage : lente, rapide, unique, multiple, totale, non-totale.
Les qualités que doit posséder la réaction support du titrage sont :
- Rapide
- Unique
- Totale
Q.7. Définir l’équivalence d’un titrage.
L’équivalence est atteinte lorsque les réactifs sont introduits dans des proportions stœchiométriques.
Q.8. Vérifier que la concentration en masse d’acide nonanoïque indiquée sur le flacon est compatible avec le résultat du dosage pH-métrique.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
$$\text{R-COOH (aq)} + \text{HO}^- (aq) \rightarrow \text{R-COO}^- (aq) + H_2O (l)$$
À l’équivalence :
$$\frac{n_{\text{R-COOH}}^i}{1}=\frac{n_{\text{HO}^-}^{eq}}{1}$$
$$C_A V_A = C_B V_E$$
$$C_A=\frac{C_B V_E}{V_A}$$
On détermine graphiquement le volume à l’équivalence au maximum de la courbe de la dérivée de pH : $V_E=16{,}8$ mL
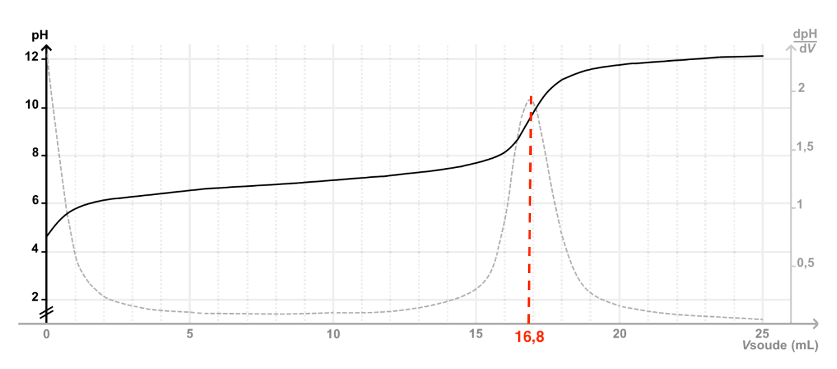
$$C_A=\frac{0{,}100\times16{,}8\times10^{-3}}{10{,}0\times10^{-3}}$$
$$C_A=0{,}168\ \text{mol·L}^{-1}$$
Dilution par 10 :
$$C=10\times C_A$$
$$C=1{,}68\ \text{mol·L}^{-1}$$
Concentration massique :
$$C_m = C \times M$$
$$C_m = 1{,}68 \times 158{,}24$$
$$C_m = 266\ \text{g·L}^{-1}$$
Calcul de l’incertitude :

$$u(C_m)=C_m\sqrt{\left(\frac{u(C_B)}{C_B}\right)^2+\left(\frac{u(V_E)}{V_E}\right)^2+\left(\frac{u(V_A)}{V_A}\right)^2}$$
$$u(C_m)=266\sqrt{\left(\frac{0{,}002}{0{,}100}\right)^2+\left(\frac{0{,}5}{16{,}8}\right)^2+\left(\frac{0{,}02}{10{,}0}\right)^2}$$
$$u(C_m)=10\ \text{g·L}^{-1}$$
Compatibilité :
$$\frac{|C_{m,mes}-C_{m,ref}|}{u(C_m)}=\frac{|266-250|}{10}=1{,}6<2$$
Ainsi, la concentration en masse d’acide nonanoïque indiquée sur le flacon est compatible avec le résultat du dosage pH-métrique.
3. Synthèse du nonanoate de méthyle
Le nonanoate de méthyle est une espèce chimique que l’on retrouve notamment dans les cosmétiques. La synthèse du nonanoate de méthyle peut être réalisée au laboratoire à partir de méthanol et d’acide nonanoïque, en présence d’acide sulfurique (2 H+ (aq) + SO42- (aq)), selon la réaction d’équation :
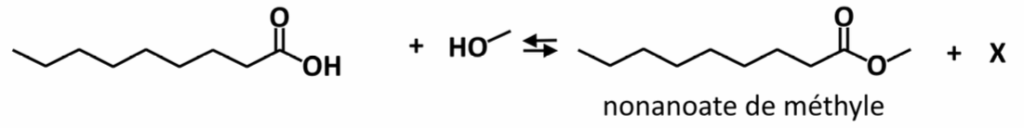
Q.9. Indiquer la famille chimique à laquelle appartient le nonanoate de méthyle.
Le nonanoate de méthyle appartient à la famille des esters.
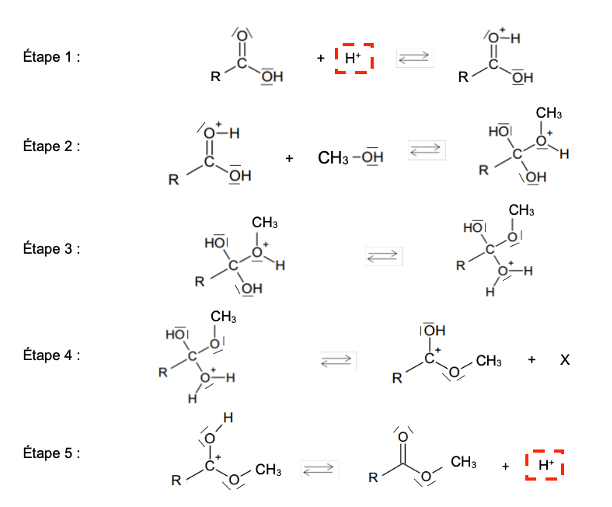
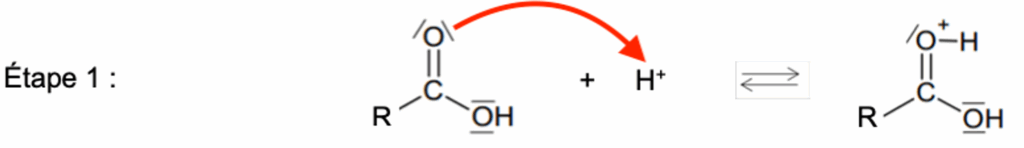
La réaction de synthèse peut être décomposée en plusieurs étapes élémentaires selon le mécanisme réactionnel suivant :
Étape 1 :

Étape 2 :
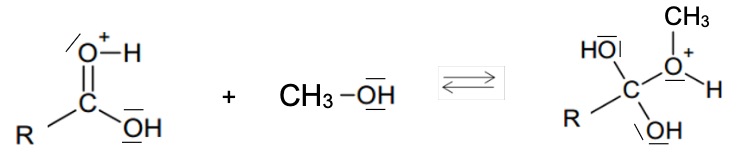
Étape 3 :

Étape 4 :
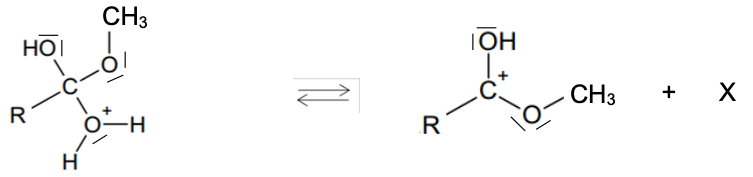
Étape 5 :
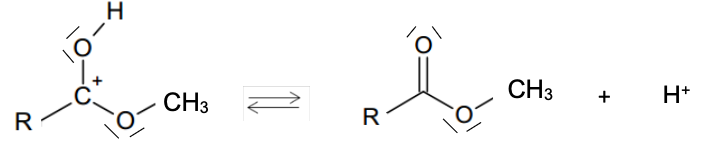
Q.10. Recopier l’étape 1 sur la copie. Représenter la flèche courbe dans cette étape. Justifier son sens.
Lors d’une formation de liaison, le doublet d’électrons se déplace du site donneur (ici l’atome d’oxygène qui possède des doublets non liants) vers un site accepteur (ici l’ion H+).
Q.11. Écrire la formule de la molécule X produite à l’étape 4 du mécanisme. Justifier.
Méthode 1 :
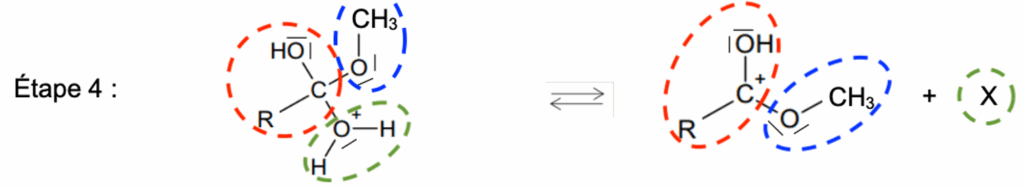
On compare les réactifs et les produits pour déterminer la formule de l’élément X :
Ainsi l’élément X est de l’eau de formule H2O.
Méthode 2 :
On compte les atomes des réactifs et des produits pour déterminer la formule de l’élément X :
| Atomes | Réactifs | Produits | Différence |
| R (groupement d’atomes) | 1 | 1 | 0 |
| C | 2 | 2 | 0 |
| O | 3 | 2 | 1 |
| H | 6 | 4 | 2 |
Ainsi, l’élément X est formé de 1 atome d’oxygène et 2 atomes d’hydrogène : l’élément X est de l’eau de formule H2O.
Q.12. Recopier la formule d’un intermédiaire réactionnel au sein du mécanisme réactionnel de formation du nonanoate de méthyle et justifier le choix effectué.
Un intermédiaire réactionnel est une espèce formée à une étape et consommée à l’étape suivante.
Les intermédiaires réactionnels sont ceux encadré avec différentes couleurs ci-contre.
N’en choisir qu’un seul.

Q.13. Indiquer le rôle de l’acide sulfurique introduit dans le mélange initial. Justifier.
L’acide sulfurique introduit dans le mélange initial joue rôle de catalyseur : les ions H+ sont consommés lors de l’étape 1 et régénérés dans l’étape 5. Ils n’apparaissent pas dans le bilan global de la réaction.