Bac Métropole 2024 Sujet 2
Exercice 3 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°24-PYCJ2ME1
Sujet et corrigé
Exercice 3 – Batterie Lithium – Soufre (5 points)
Les appareils électroniques nomades (tablette, téléphone…) sont omniprésents et en évolution permanente. L’autonomie de ces appareils repose sur l’utilisation de batteries qui stockent toujours plus efficacement l’énergie. Les téléphones portables sont actuellement équipés de batteries lithium – ion mais des recherches sont menées pour développer des batteries lithium – soufre.
La batterie lithium – soufre semble être en effet une alternative intéressante en raison de l’abondance et du faible coût du soufre. Cependant, les travaux de recherche visent à améliorer sa durée de vie encore trop faible.
L’objectif de cet exercice est d’étudier quelques caractéristiques d’une batterie lithium – soufre et de les comparer à celles d’une batterie lithium – ion.
Données :
- numéro atomique du lithium : Z = 3 ;
- couples oxydant/réducteur :
- du lithium : Li+ / Li ;du soufre : S / S2– ;
- volume molaire de gaz à 20°C et à pression atmosphérique : Vm = 24,4 L·mol–1 ;
- masses molaires atomiques :
- du soufre : M(S) = 32,1 g·mol–1 ;
- du lithium : M(Li) = 6,9 g·mol–1 ;
- charge par mole d’électrons : F = 96 500 C·mol–1 ;
- les ions lithium (Li+) et les ions sulfure (S2–) réagissent pour donner un précipité de sulfure de lithium très peu soluble en milieu organique ;
- la relation entre la capacité Q, l’intensité du courant I supposée constante et la durée d’utilisation Δt, de la pile, est : Q = I x Δt ;
- la capacité d’une pile peut être exprimée en milliampère-heure : 1 mAh = 3,6 C.
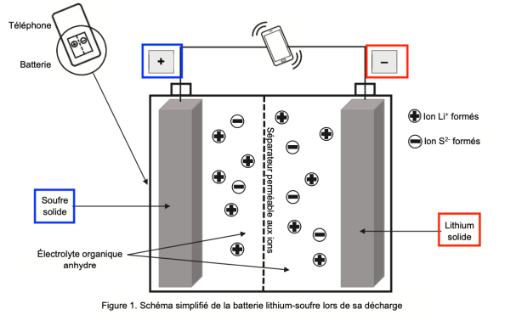
La batterie lithium – soufre peut être modélisée de façon simplifiée : elle se compose d’une électrode constituée d’un matériau contenant du soufre, un électrolyte organique anhydre et une électrode de lithium métallique.
1. Le lithium
Le lithium réagit spontanément avec l’eau. Cette transformation est exothermique. L’équation de la réaction modélisant cette transformation supposée totale s’écrit :
2 Li (s) + 2 H2O (l) ⭢ 2 Li+ (aq) + 2 HO– (aq) + H2 (g)
La batterie d’un téléphone portable contient en moyenne une masse m = 0,5 g de lithium.
Q1. Justifier que le lithium se comporte comme un réducteur dans cette transformation.
$$2\ {\rm Li}(s)+H_2O(l)\ \longrightarrow 2{\rm Li}^+(aq)+2{\rm HO}^-(aq)+H_2(g)$$
Le lithium Li se transforme en Li+ selon la demi équation :
$$Li(s)={\rm Li}^+(aq)+e^-$$
Le lithium Li perd des électrons : c’est un réducteur.
Q2. Déterminer le volume de dihydrogène formé, à 20°C et à pression atmosphérique, si une masse m = 0,5 g de lithium réagit totalement avec l’eau. Justifier l’utilisation d’un électrolyte organique anhydre dans une telle batterie.
Calculons la quantité initiale de lithium :
$$n_{lithium}^i=\frac{m_{lithium}}{M_{lithium}}$$
$$n_{lithium}^i=\frac{0,5}{6,9}$$
$$n_{lithium}^i=7,2\times {10}^{-2}\ mol$$
| Équation | 2 Li (s) + 2 H2O (l) ⭢ 2 Li+ (aq) + 2 HO– (aq) + H2 (g) | ||||
| État initial | $7,2\times {10}^{-2}$ | Excès | 0 | 0 | 0 |
| État intermédiaire | $7,2\times {10}^{-2}-2x$ | Excès | $2x$ | $2x$ | x |
| État final | $7,2\times {10}^{-2}-2x_f$ | Excès | $2x_f$ | $2x_f$ | $x_f$ |
$$7,2\times {10}^{-2}-2x_{max}=0$$
$$-2x_{max}=-7,2\times {10}^{-2}$$
$$x_{max}=\frac{7,2\times {10}^{-2}}{2}$$
$$x_{max}=3,6\times {10}^{-2}\ mol$$
D’après l’énoncé le lithium réagit totalement avec l’eau : $x_f=x_{max}=3,6\times {10}^{-2}\ mol$
$$n_{H_2}=\frac{V_{H_2}}{V_m}$$
$$\frac{V_{H_2}}{V_m}=n_{H_2}$$
$$V_{H_2}=n_{H_2}\times V_m$$
Or
$$n_{H_2}=x_f$$
D’où
$$V_{H_2}=x_f\times V_m$$
$$V_{H_2}=3,6\times {10}^{-2}\times 24,4$$
$$V_{H_2}=0,88\ L$$
0,88L de dihydrogène est formé lors de cette réaction.
Le lithium réagit spontanément avec l’eau et produit du dihydrogène. Or, le dihydrogène est un gaz qui peut exploser avec une flame ou une étincelle.
C’est pourquoi, on utilise un électrolyte organique anhydre (sans eau) dans une telle batterie.
2. La batterie lithium – soufre
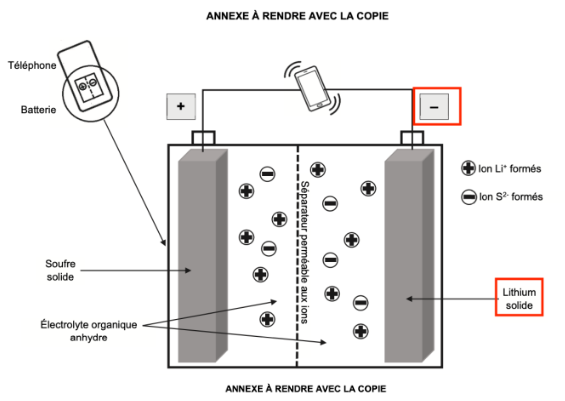
On donne, sur la figure 1 de L’ANNEXE À RENDRE AVEC LA COPIE, le schéma simplifié de la batterie lithium – soufre quand elle se décharge, c’est-à-dire quand elle fonctionne en tant que pile. Les pôles de cette pile sont indiqués sur la figure 1 de L’ANNEXE À RENDRE AVEC LA COPIE.
Q3. Écrire les demi-équations modélisant les réactions électrochimiques qui se déroulent alors à chaque électrode en tenant compte de la polarité de la pile.
Le lithium est à la borne négative de la pile. La borne négative libère des électrons. Le lithium Li subit une oxydation :
$$Li(s)={\rm Li}^+(aq)+e^-$$
Le souffre est à la borne positive de la pile. Les électrons arrivent sur la borne positive. Le souffre S subit une réduction :
$$S(s)+2e^-=S^{2-}(aq)$$
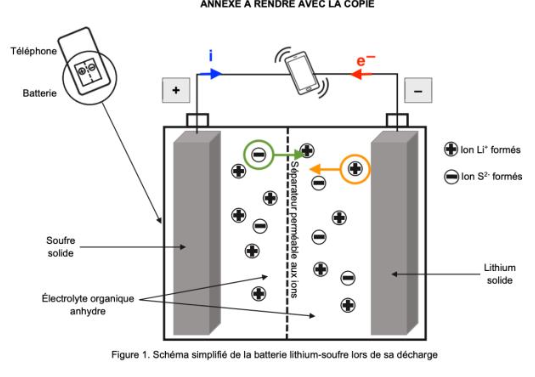
Q4. Sur le schéma de la figure 1 de L’ANNEXE À RENDRE AVEC LA COPIE, où la polarité de la pile est donnée, indiquer :
- le sens du courant électrique ;
- le sens de déplacement des électrons dans les fils électriques reliant la pile au téléphone ;
- le sens de déplacement des ions formés dans l’électrolyte.
Sens du courant électrique : le courant électrique circule de la borne positive vers la borne négative de la pile.
Sens de déplacement des électrons dans les fils électriques reliant la pile au téléphone : les électrons circulent de la borne négative vers la borne positive de la pile.
Sens de déplacement des ions formés dans l’électrolyte : les ions Li+ sont formés à l’électrode de lithium, ils quittent cette borne. Les ions S2− sont formés à l’électrode de souffre, ils quittent cette borne.
Q5. Écrire l’équation de fonctionnement de la pile en tenant compte de la formation d’un précipité dans la pile. Une batterie lithium – ion de smartphone, de capacité de Q = 3 500 mAh, débite un courant d’intensité I = 0,55 A supposée constante, lors de l’utilisation de la fonction lampe torche. La batterie se comporte dans ce contexte comme une pile. La capacité massique moyenne par gramme de matière active d’une batterie lithium – ion a pour valeur Qmassique = 300 mAh·g–1.
Équation de fonctionnement de la pile :
$$Li(s)={\rm Li}^+(aq)+e^-\ \ \ \ \ \ \ \ \times 2$$
$$S(s)+2e^-=S^{2-}(aq)$$
$$2Li(s)+S(s)=2{\rm Li}^+(aq)+S^{2-}(aq)$$
La question nous indique la formation d’un précipité dans la pile. Le précipité est un solide ionique formé à partir des ions Li+ et S2− : Li2S.
Équation de fonctionnement de la pile en tenant compte de la formation d’un précipité dans la pile :
$$2Li(s)+S(s)={\rm Li}_2S(s)$$
Q6. Déterminer la durée d’utilisation de la batterie lithium – ion dans ces conditions.
$$Q=I\times \Delta t$$
$$I\times \Delta t=Q$$
$$\Delta t=QI$$
$$\Delta t=3500\times 10^{-3}0,55$$
$$\Delta t=6,4\ h$$
$$\Delta t=6h\ 24\ min$$
Dans ces conditions, la durée d’utilisation de la batterie lithium – ion est de 6h 24 min.
Q7. Vérifier, à l’aide des données, qu’une batterie lithium – ion neuve contient environ 12 g de matière active. En déduire la durée d’utilisation ramenée à un gramme de matière active dans ces conditions d’utilisation.
D’apres le sujet : « La capacité massique moyenne par gramme de matière active d’une batterie lithium – ion a pour valeur Qmassique = 300 mAh·g–1. »
Méthode 1 :
$$Q_{massique}=\frac{Q}{m_{active}}$$
$$Q_{massique}\times m_{active}=Q$$
$$m_{active}=\frac{Q}{Q_{massique}}$$
$$m_{active}=\frac{3500}{300}$$
$$m_{active}=11,\ 6\ g$$
Ainsi, une batterie lithium – ion neuve contient environ 12 g de matière active.
Méthode 2 :
| 300 mAh | 1 g |
| 3 500 mAh | mactive |
$$m_{active}=\frac{3500\times 1}{300}$$
$$m_{active}=11,\ 6\ g$$
Ainsi, une batterie lithium – ion neuve contient environ 12 g de matière active.
Q8. Déterminer la capacité massique par gramme de soufre actif de la batterie lithium – soufre, exprimée en mAh·g–1. En déduire sa durée d’utilisation par gramme de soufre actif si elle débite un courant d’intensité I = 0,55 A supposée constante. Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et doit être correctement présentée.
Déterminons la capacité massique par gramme de soufre actif de la batterie lithium – soufre, exprimée en mAh·g–1 :
$$Q_{massique}=\frac{Q}{m_{active}}$$
Or
$$Q=n(e^-)\times F$$
D’où
$$Q_{massique}=\frac{n(e^-)\times F}{m_{active}}$$
D’après la demi équation : $$S(s)+2e^-=S^{2-}(aq)$$
$$\frac{n(e^-)}{2}=\frac{n(S)}{1}$$
$$n(e^-)=2\times n(S)$$
D’où
$$Q_{massique}=\frac{2\times n(S)\times F}{m_{active}}$$
Or
$$n(S)=\frac{m(S)}{M(S)}$$
D’où
$$Q_{massique}=\frac{2\times \frac{m(S)}{M(S)}\times F}{m_{active}}$$
$$Q_{massique}=\frac{2\times m(S)\times F}{m_{active}\times M(S)}$$
$$Q_{massique}=\frac{2\times F}{M(S)}$$
$$Q_{massique}=\frac{2\times 96\ 500}{32,1}$$
$$Q_{massique}=6,0\times {10}^3C.g^{-1}$$
D’après les données : « la capacité d’une pile peut être exprimée en milliampère-heure : 1 mAh = 3,6 C. »
$$Q_{massique}=\frac{6,0\times {10}^3}{3,6}$$
$$Q_{massique}=1,7\times {10}^3\ mAh.g^{-1}$$
Calculons sa durée d’utilisation par gramme de soufre actif si elle débite un courant d’intensité I = 0,55 A supposée constante :
$$Q=I\times \Delta t$$
$$I\times \Delta t=Q$$
$$\Delta t=QI$$
$$\Delta t=1,7\times 10^3\times 10^{-3}0,55$$
$$\Delta t=3,1\ h$$
$$\Delta t=3h\ 5\ min$$
A la question Q6 nous avons déterminer une durée de $$\Delta t=6,4\ h$$ pour une pile de 12 g de matière active.
Pour 1 g de matière active : $$\Delta t_{ion}=\frac{\Delta t}{12}=0,53\ h$$
Comparons les autonomies pour les batteries lithium-ion et lithium soufre :
$$\frac{\Delta t_{souffre}}{\Delta t_{ion}}=\frac{3,1}{0,53}=5,8$$
Ainsi, la capacité de la pile lithium-soufre est 5,8 fois plus grande que celle de la batterie lithium ion. Pour une même masse de souffre, l’autonomie est plus grande.
ANNEXE À RENDRE AVEC LA COPIE
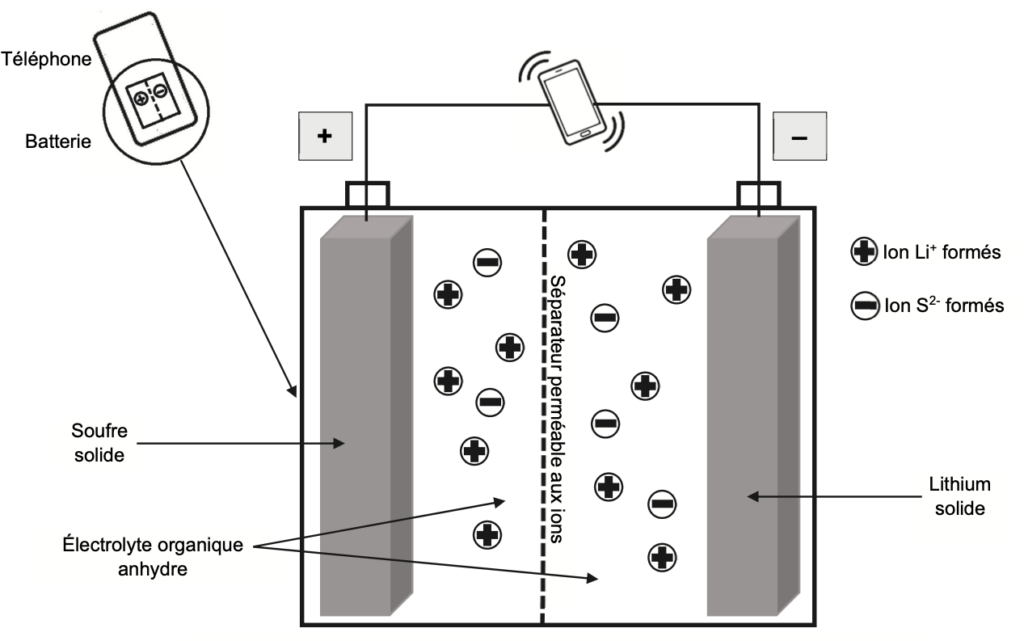
Figure 1. Schéma simplifié de la batterie lithium-soufre lors de sa décharge
