E3C2 – 10 points – Durée 1h – calculatrice autorisée
Avec 13,41 gigatonnes de dioxyde de carbone émis dans le monde en 2016, le transport est le deuxième contributeur de gaz à effet de serre derrière la production d’énergie électrique […].Les émissions de dioxyde de carbone des transports dépendent de plusieurs facteurs : la distance totale parcourue, le nombre de passagers par véhicule, le carburant utilisé ou encore le type de trajet. Or, les statistiques montrent un nombre toujours plus important de voitures en circulation dans le monde, ainsi qu’une importante augmentation du trafic aérien et du commerce mondial de marchandises. La part des émissions de CO2 par secteur d’activité dans le monde est fournie dans le tableau ci-après.
| Énergie électrique 41,5 % | Industrie 18,9 % | Résidentiel 8,4 % | Transport 24,4 % | Autres 6,8 % |
D’après Céline Deluzarche, chiffres AIE pour l’année 2016.
1. Voiture diesel ou voiture essence ?
D’après le texte introductif, les émissions de dioxyde de carbone dues aux transports dépendent, entre autres, du carburant utilisé. On se propose, en répondant aux questions de cette première partie, de construire un argumentaire scientifique permettant de valider ou d’invalider cette affirmation. Les deux carburants étudiés sont le gasoil et l’essence sans plomb. On admet qu’ils sont respectivement modélisés par du dodécane (C12H26) pour l’un et de l’octane (C8H18) pour l’autre.
| Type de véhicule | Diesel | Essence sans plomb |
| Carburant utilisé | Gasoil : essentiellement du dodécane | Essence : essentiellement de l’octane |
| Volume de carburant consommé pour 100 km parcourus | V = 5,0 L | |
| Masse de dioxyde de carbone émis par kilomètre parcouru | m = 120 g |
Données
Energie molaire de combustion de l’octane : Em = – 5,1 × 103 kJ.mol-1.
Masse volumique de l’octane : ρ = 0,70 kg.L-1.
Masses molaires atomiques (g.mol-1) : M(C) = 12,0 ; M(H) = 1,00 ; M(O) = 16,0.
Représentation de quelques éléments : 1H ; 6C ; 8O.
Extrait d’une table d’énergies molaires de liaison :
| Liaison | El (kJ.mol-1) |
| C – H | 415 |
| C – C | 348 |
| C – O | 350 |
| O = O | 498 |
| O – H | 463 |
| C = O | 724 |
| C = O dans CO2 | 804 |
1.1. L’équation de la réaction modélisant la combustion du dodécane s’écrit :
2 C12H26 (l) + 37 O2 (g) ➝ 24 CO2 (g) + 26 H2O (g)
Le schéma de Lewis du dodécane est donné ci-dessous :
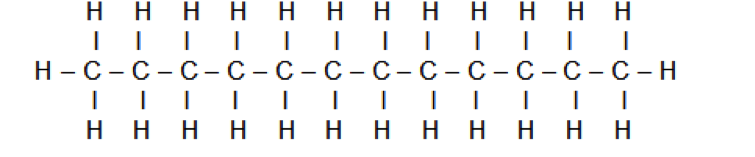
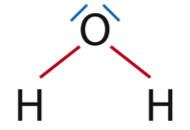
1.1.1. Représenter le schéma de Lewis du dioxygène, du dioxyde de carbone et de l’eau.
| Atome | Numéro atomique | Configuration électronique | Nombre de doublets liants | Nombre de doublets non liants |
| H | 1 | 1s1 | 1 | 0 |
| C | 6 | 1s2 2s2 2p2 | 4 | 0 |
| O | 8 | 1s2 2s2 2p4 | 2 | 2 |
O2

CO2
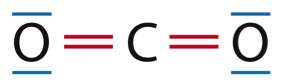
H2O
1.1.2. Déterminer la quantité de matière de dioxyde de carbone rejeté par la voiture diesel par kilomètre parcouru.
![]()
![]()
1.1.3. En déduire la quantité de matière de dodécane consommé par kilomètre parcouru.
L’équation de la réaction modélisant la combustion du dodécane s’écrit :
2 C12H26 (l) + 37 O2 (g) ➝ 24 CO2 (g) + 26 H2O (g)
D’après cette équation :
![Rendered by QuickLaTeX.com \[\frac{n_{C_{12}H_{26}}^{consommé}}{2}=\frac{n_{CO_2}^{produit}}{2} \]](https://physik.fr/wp-content/ql-cache/quicklatex.com-bf031a487870668734f478754bcbd487_l3.png)
![Rendered by QuickLaTeX.com \[n_{C_{12}H_{26}}^{consommé}= 2 \times \frac{n_{CO_2}^{produit}}{2} \]](https://physik.fr/wp-content/ql-cache/quicklatex.com-7e5210b2648ce28b423f6a7490c54c6d_l3.png)
![]()
1.1.4. Montrer, à l’aide des données, qu’une estimation de l’énergie molaire de combustion du dodécane est E’m = – 7,50×103 kJ.mol-1. Indiquer pourquoi il s’agit d’une estimation.
L’équation de la réaction modélisant la combustion du dodécane s’écrit :
2 C12H26 (l) + 37 O2 (g) ➝ 24 CO2 (g) + 26 H2O (g)
Pour une molécule de dodécane :
C12H26 (l) + 37/2 O2 (g) ➝ 12 CO2 (g) + 13 H2O (g)
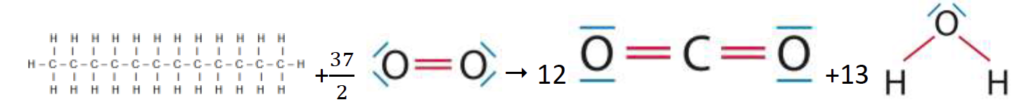
Liaisons rompues :
| 26 C – H | 11 C – C |
Liaisons formées :
| 12×2 C = O dans CO2 | 13×2 O – H |
E’m =26 El(C – H)+11 El(C– C)+ El(O = O) -24 El(C = O)-26 El(O – H)
E’m =26×415+11× 348+×498 -24× 804-26× 463
E’m =-7,50.103 KJ.mol-1
Il s’agit d’une estimation car les combustions ne sont pas toujours complètes.
1.1.5. En déduire l’énergie libérée Elib par la combustion du gasoil pour un kilomètre parcouru.
Elib=n× E’m
Elib =2,28.10-1×-7,50.103 =-1,71.103 KJ
1.2. Une voiture essence de motorisation équivalente libère une énergie liée à la combustion de l’essence E’lib = – 1,7×103 kJ par kilomètre parcouru.
1.2.1. Montrer que la masse de dioxyde de carbone émise par la voiture à essence par kilomètre parcouru vaut m’ = 1,2×102 g.
Formule brute des alcanes CnH2n+2
Octane : 8 atomes de carbone
Donc la formule de l’octane : C8H18
Lors d’une combustion, le combustible réagit avec du dioxygène et produit du dioxyde de carbone.
L’équation de la réaction modélisant la combustion de l’octane s’écrit :
C8H18 (l) + 25/2 O2 (g) ➝ 8 CO2 (g) + 9 H2O (g)
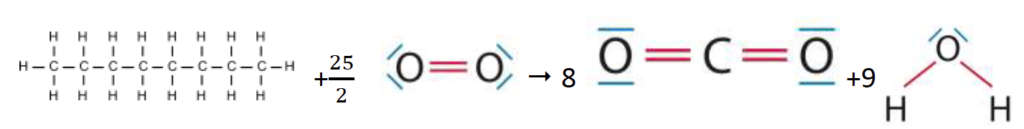
Liaisons rompues :
| 18 C – H | 7 C – C |
Liaisons formées :
| 8×2 C = O dans CO2 | 9×2 O – H |
E’m =18 El(C – H)+7 El(C– C)+ El(O = O) -16 El(C = O)-18 El(O – H)
E’m =18×415 +7× 348+×498 -16× 804-18× 463
E’m =-5,07.103 KJ.mol-1
Calculons la quantité d’octane par kilomètre parcouru.
E’lib = – 1,7 ×103 kJ par kilomètre parcouru.
![]()
![]()
![Rendered by QuickLaTeX.com \[n_{octane}=\frac{-1,7\ .10^3}{-5,07.10^3}=3,3.10^{-1}\ mol\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-01f32ff0ad668091583511f5dde1b29a_l3.png)
D’après l’équation de réaction :
![Rendered by QuickLaTeX.com \[n_{octane}^{consommé}=\frac{n_{CO_2}^{produit}}{8}\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-7329c7831411921ad369168564d42422_l3.png)
![]()
![]()
![]()
![]()
1.2.2. Commenter le résultat obtenu et rédiger un conseil argumenté sur le choix du véhicule à utiliser pour minimiser l’impact sur le réchauffement climatique. On s’attachera notamment à montrer si le critère de la consommation par kilomètre parcouru est un indicateur suffisant.
La masse de dioxyde de carbone libérée par kilomètre parcouru est la même pour un véhicule essence ou diesel.
Le critère de la consommation par kilomètre parcouru n’est donc pas un indicateur suffisant.
Pour minimiser l’impact sur le réchauffement climatique, il est préférable d’utiliser un véhicule électrique ou hybride
2. Quel moyen de transport choisir ?
Un salarié d’une entreprise de conseil en développement durable doit effectuer un aller-retour Bordeaux-Paris pour aller défendre un projet d’aménagement. Les deux villes sont distantes de d = 546 km. Soucieux de l’environnement, il étudie les différentes solutions alternatives à la voiture, comme le train (ligne TGV) et l’avion afin de réduire son empreinte carbone. L’empreinte « carbone » est la mesure de la quantité de dioxyde de carbone émis, suite à la combustion d’énergies fossiles, par une activité, un produit (depuis quelques années cette information est disponible sur l’électroménager, les offres immobilières, les véhicules), une prestation.
Le site « oui.sncf » propose un calculateur des émissions de dioxyde de carbonelors d’un voyageen train. On y trouve notamment l’information suivante :
Emissions de CO2 d’un voyageur parcourant un kilomètre, par type de train SNCF (basées sur les consommations d’énergie (source : Réseau de transport d’électricités (Rte), 2017) et fréquentations de 2017) :
- Train TGV : 2,4 g de CO2 par kilomètre
- Train Intercités : 8,1 g de CO2 par kilomètre
- Train TER : 29,4 g de CO2 par kilomètre
- Train Transilien / RER : 5,4 g de CO2 par kilomètre
D’après https://fr.wikipedia.org et https://www.oui.sncf
Le combustible utilisé dans les moteurs d’avion est le kérosène. C’est un mélange complexe d’alcanes, principalement des molécules comportant 11 atomes de carbone de formule brute C11H24.
Des calculateurs en ligne permettent d’évaluer la masse de CO2 émis par voyageur lors d’un voyage en avion.
Le résultat de la simulation est donné ci-dessous.

En s’appuyant sur les informations données ci-dessus et les résultats trouvés à la partie 1, réaliser une étude comparée qui permettra au salarié de l’entreprise d’identifier, parmi les trois proposés, le mode de transport le plus écologique au niveau des émissions de dioxyde de carbone pour effectuer un aller-retour Bordeaux-Paris.
L’analyse des données, la démarche suivie et l’analyse critique des résultats sont évaluées et nécessitent d’être correctement présentées. Toute trace de recherche sera valorisée.
| Moyen de transport | Consommation de CO2 par kilomètre | Consommation de CO2 pour le trajet (aller-retour) D=2d = 546×2=1092 km |
| Train TGV : | 2,4 g | 2,6 Kg |
| Train Intercités : | 8,1 g | 8,8 Kg |
| Train TER : | 29,4 g | 32,1 Kg |
| Train Transilien / RER : | 5,4 g | 5,90 Kg |
| Avion | 0,360t=360 Kg | |
| Voiture | 120 g | 131 Kg |
Le mode de transport le plus écologique au niveau des émissions de dioxyde de carbone pour effectuer un aller-retour Bordeaux-Paris est le TGV.
