Bac Asie 2024 Sujet 2
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°24-PYCJ2JA1
Sujet et corrigé
Exercice 2 – Contrôle d’un médicament (5 points)
Les médicaments sont des produits très surveillés aussi bien par les fabricants que par les autorités sanitaires. Des contrôles peuvent être réalisés tout au long de la chaine de fabrication. Ceux-ci visent en premier lieu à vérifier la qualité des produits actifs (qualité de la production elle-même), mais ils peuvent également servir à détecter et corriger des erreurs logistiques telles que des erreurs d’étiquetage.
Dans cet exercice, on s’intéresse à un tel contrôle réalisé sur une boite d’ibuprofène 200 mg. Dans un premier temps, on vérifie la nature du principe actif contenu dans le cachet puis, dans un second temps, on étudie le dosage du principe actif du cachet.
Identification du principe actif
La molécule d’ibuprofène est la substance active d’un médicament utilisé comme analgésique. Sa structure moléculaire est représentée dans le document 1.
Document 1 – Représentation de la molécule d’ibuprofène
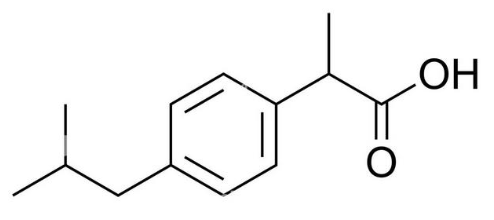
Q1- Écrire la formule semi-développée de l’ibuprofène.
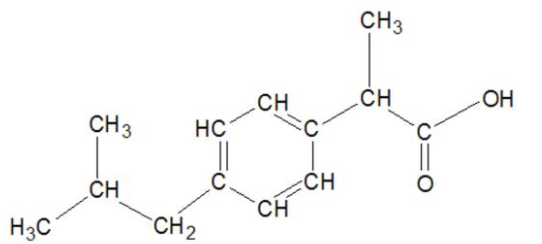
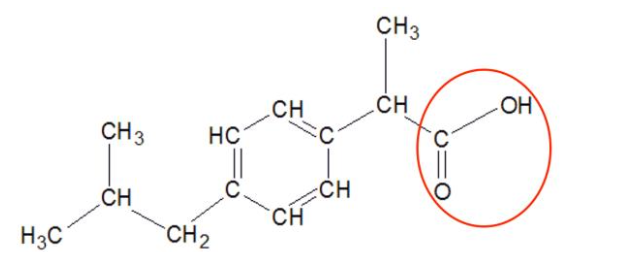
Q2- Sur la formule semi-développée écrite à la question précédente, entourer le groupe caractéristique et nommer la famille fonctionnelle associée.
Famille fonctionnelle associée : Acide carboxylique
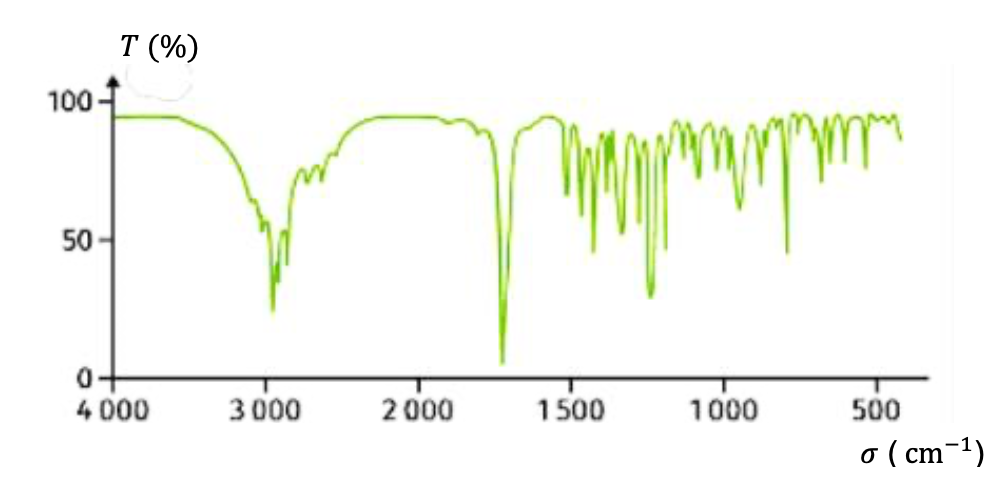
Pour vérifier la nature du principe actif contenu dans le comprimé, différents contrôles sont effectués parmi lesquels une analyse par spectroscopie infrarouge (IR). Le spectre obtenu est représenté dans le document 2.
Document 2 – Spectre d’absorption IR de l’échantillon
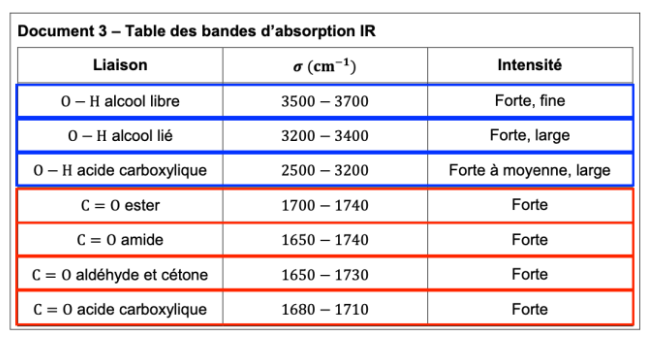
Le document 3 rappelle les caractéristiques d’absorption dans le domaine de l’infrarouge d’un ensemble de liaisons chimiques.
Q3- Justifier que le spectre de l’échantillon peut correspondre à celui de l’ibuprofène.
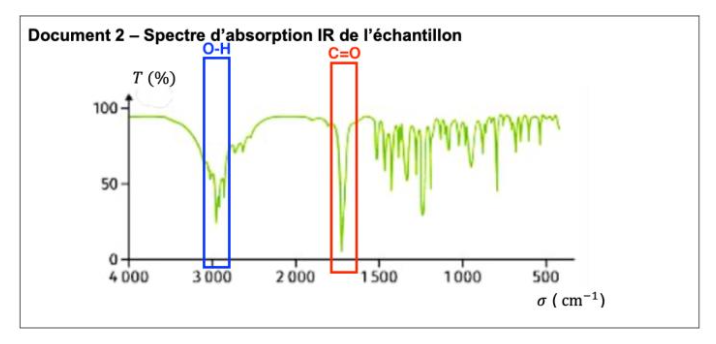
Le spectre présente une bande d’absorption autour de 1700 cm-1 caractéristique d’une liaison C=O et une bande d’absorption autour de 3000 cm-1 caractéristique d’une liaison O-H.
L’échantillon possède, comme la molécule d’ibuprofène, une liaison C=O et une liaison O-H. Ainsi l’échantillon peut correspondre à celui de l’ibuprofène.
Document 3 – Table des bandes d’absorption IR
| Liaison | 𝝈 (𝐜𝐦−𝟏) | Intensité |
| O − H alcool libre | 3500 − 3700 | Forte, fine |
| O − H alcool lié | 3200 − 3400 | Forte, large |
| O − H acide carboxylique | 2500 − 3200 | Forte à moyenne, large |
| C = O ester | 1700 − 1740 | Forte |
| C = O amide | 1650 − 1740 | Forte |
| C = O aldéhyde et cétone | 1650 − 1730 | Forte |
| C = O acide carboxylique | 1680 − 1710 | Forte |
Contrôle du dosage du comprimé
Après s’être assuré de la nature du principe actif, et plus généralement des constituants du comprimé, on contrôle son dosage, c’est-à-dire la quantité de principe actif présente dans un comprimé. On propose ci-après un exemple de protocole possible.
Dans un premier temps, par un procédé non décrit ici, on extrait et isole tout l’ibuprofène d’un comprimé. Ensuite :
- On introduit l’ibuprofène dans une fiole jaugée de 100 mL que l’on complète jusqu’au trait de jauge avec de l’eau distillée.
- Après agitation, on prélève 20 mL de cette solution que l’on introduit dans un erlenmeyer de 250 mL.
- On ajoute 50 mL d’eau distillée.
- On ajoute cinq gouttes de rouge de crésol.
- On procède au titrage de l’ibuprofène contenu dans l’erlenmeyer par une solution d’hydroxyde de sodium (Na+(aq) + HO−(aq) ) de concentration 𝐶b = 2,5 × 10−2 mol ⋅ L−1.
Données :
- Masse molaire de l’ibuprofène : 𝑀(ibuprofène) = 206,28 g ⋅ mol−1
- p𝐾𝐴 du couple formé par l’ibuprofène et sa base conjuguée : 4,91
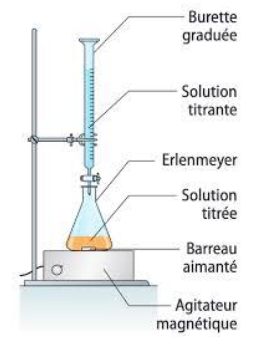
Q4- Représenter le montage légendé permettant d’effectuer ce titrage.
Q5- Écrire la réaction support du titrage. On utilisera la notation R − COOH pour désigner l’ibuprofène.
$$R-COOH\left(aq\right)+HO^-\left(aq\right)\rightarrow R-COO^-\left(aq\right)+H_2O\left(l\right)$$
Le pH attendu à l’équivalence est voisin de 8,1. La zone de virage du rouge de crésol est comprise entre 7,2 et 8,8.
Q6- Le rouge de crésol est un indicateur coloré. Expliquer son rôle lors du titrage.
L’indicateur coloré permet d’identifier l’équivalence en changeant de couleur.
Q7- Discuter le choix de cet indicateur coloré.
Pour choisir un indicateur coloré, il faut que pHeq soit dans sa zone de virage.
La zone de virage du rouge de crésol est comprise entre 7,2 et 8,8. Le pH attendu à l’équivalence est voisin de 8,1.
Ainsi, le choix du rouge de crésol est judicieux.
Le virage de l’indicateur coloré a lieu pour un volume d’hydroxyde de sodium versé :
𝑉b,eq = 15,5 mL
Q8- Déterminer la valeur de la masse d’ibuprofène contenue dans le comprimé. L’ibuprofène est généralement commercialisé sous trois formes : 100 mg, 200 mg et 400 mg.
$$R-COOH\left(aq\right)+HO^-\left(aq\right)\rightarrow R-COO^-\left(aq\right)+H_2O\left(l\right)$$
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques :
$$\frac{n_{R-COOH}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$$
$$\frac{m_{R-COOH}}{M_{R-COOH}}=C_B\times V_{b,eq}$$
$$m_{R-COOH}=C_B\times V_{b,eq}\times M_{R-COOH}$$
$$m_{R-COOH}=2,5\times{10}^{-2}\times15,5\times{10}^{-3}\times206,28$$
$$m_{R-COOH}=8,0\times{10}^{-2}g$$
Cette masse est la masse d’ibuprofène contenu dans les 20 mL dosés.
Calculons la masse d’ibuprofène contenu dans un comprimé.
| 20 mL | $8,0\times{10}^{-2}g$ |
| 100 mL | $m_{comprimé}$ |
$$m_{comprimé}=\frac{100\times8,0\times10^{-2}}{20}$$
$$m_{comprimé}=0,40\ g$$
$$m_{comprimé}=400\ mg$$
Q9- Justifier que la valeur obtenue est compatible avec une erreur d’étiquetage.
Le contrôle réalisé sur une boite d’ibuprofène 200 mg. La masse trouvée est le double de celle indiquée.
Ainsi, la valeur obtenue est compatible avec une erreur d’étiquetage.
