Bac Amérique du nord 2024 Sujet 1
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°24-PYCJ1AN1
Sujet et corrigé
EXERCICE 2 : des batteries à flux redox organiques (5 points)
Pour le développement des énergies renouvelables, le stockage massif de l’énergie est un élément crucial afin de palier le caractère intermittent de ces modes de production. Lors des pics de production, l’énergie doit pouvoir être stockée pour être libérée lorsque la production est faible et la demande forte.
Actuellement, les batteries à flux redox organiques sont au cœur de plus en plus de projets en tant que solutions de stockage de grandes capacités, sûres, non polluantes et économiques.

D’après diplomatie.gouv.fr/fr/politique-etrangere-de-la-france/diplomatie-scientifique-et-universitaire
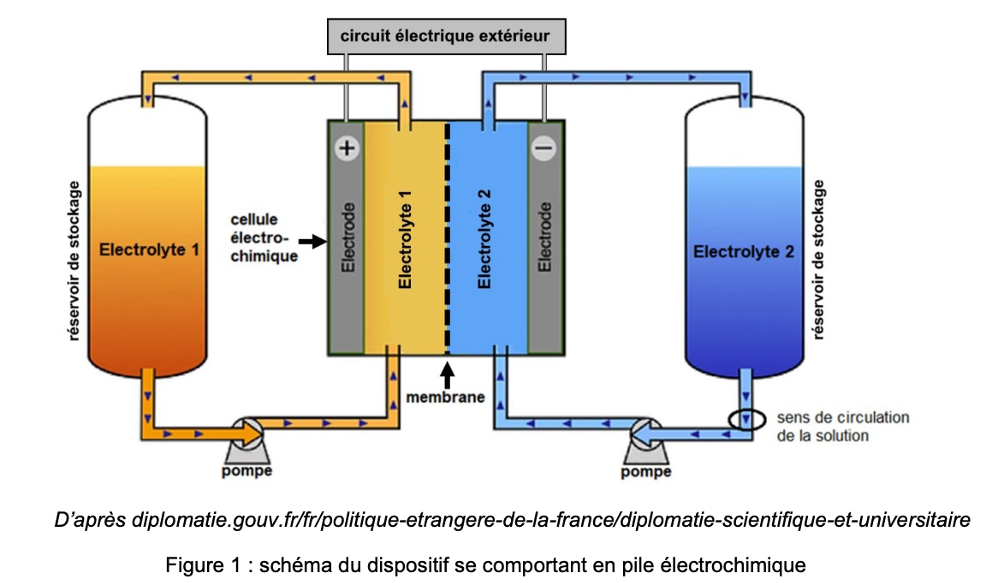
Figure 1 : schéma du dispositif se comportant en pile électrochimique
Comme l’illustre la figure 1 ci-dessus, les batteries à flux redox sont constituées de :
- deux réservoirs de stockage équipés de pompes pour faire circuler les solutions aqueuses de substances organiques ou électrolytes à travers la cellule électrochimique ;
- une cellule électrochimique qui se comporte comme une pile électrochimique (lors de la décharge) ou comme un électrolyseur (lors de la charge). Elle permet des conversions d’énergie via des réactions d’oxydoréduction ;
- une membrane spécialement conçue pour empêcher le mélange des deux solutions, tout en permettant l’échange d’ions H+ (c’est-à-dire le déplacement de la charge électrique) à travers celle-ci.
On étudie une batterie à flux redox organique utilisant comme électrolytes l’acide 1,2- benzoquinone-3,5-disulfonique (BQDS) et l’acide antraquinone-2-sulfonique (AQS) représentés ci-dessous.

BQDS

AQS
Les réactions au sein de la cellule électrochimique mettent en jeu les couples oxydant-réducteur BQDS / H2BQDS et AQS / H2AQS, espèces présentes en solution aqueuse dans les réservoirs de stockage.
Q.1. Écrire les deux réactions électrochimiques qui modélisent les transformations se produisant aux électrodes.
$$
BQDS+2H^++2e^-=H_2BQDS
$$
$$
AQS+2H^++2e^-=H_2AQS
$$
L’équation de la réaction modélisant la transformation qui a lieu lors de la décharge de la batterie (fonctionnement en mode pile) est :
BQDS + H2AQS → H2BQDS + AQS
Q.2. Définir un oxydant.
Identifier l’oxydant et le réducteur lors de cette transformation chimique.
Un oxydant est une espèce capable de capter un ou plusieurs électrons.
$$
BQDS+H_2AQS\rightarrow H_2BQDS+AQS
$$
BQDS se transforme en H2BQDS. Or BQDS capte des électrons pour se transformer en H2BQDS selon l’équation :
$$
BQDS+2H^++2e^-=H_2BQDS
$$
Ainsi, BQDS est l’oxydant de cette transformation chimique.
H2AQS se transforme en AQS. Or H2AQS cède des électrons pour se transformer en AQS selon l’équation :
$$
H_2AQS=AQS+2H^++2e^-
$$
Ainsi, H2AQS est le réducteur de cette transformation chimique.
Q.3. Déterminer si la solution de BQDS est l’électrolyte 1 ou l’électrolyte 2 à l’aide des polarités indiquées sur la cellule électrochimique et des équations des réactions électrochimiques. Justifier.
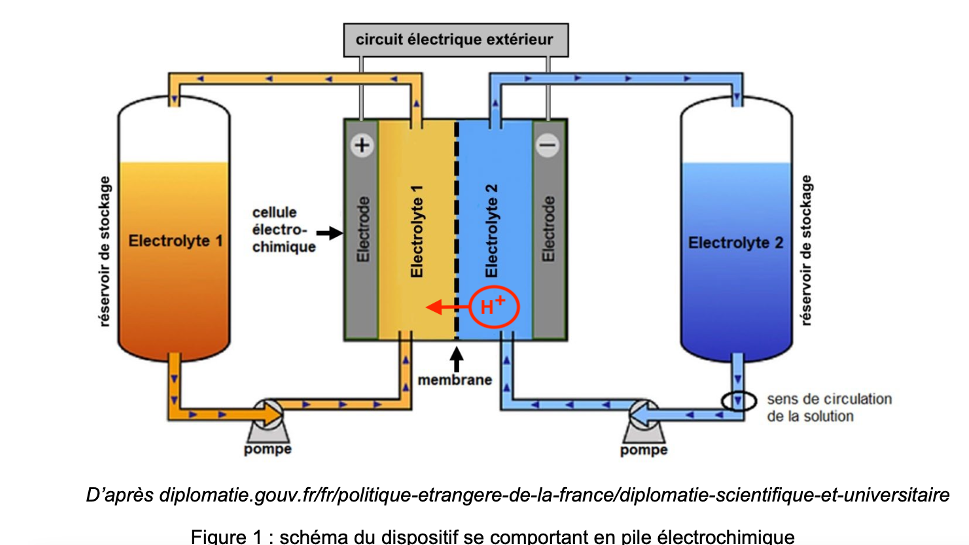
D’après la question précédente, BQDS capte des électrons pour se transformer en H2BQDS ainsi, la borne positive est celle qui contient BQDS : électrolyte 1.
D’après la question précédente, H2AQS cède des électrons pour se transformer en AQS ainsi, la borne négative est celle qui contient H2AQS : électrolyte 2.
Q.4. Déterminer le sens de circulation des ions H+ à travers la membrane. Justifier.
D’après la question 2, BQDS capte des ions H+ pour se transformer en H2BQDS ainsi, les ions H+ vont vers l’électrode 1 (électrode qui contient BQDS)
D’après la question 2, H2AQS cède des ions H+ pour se transformer en AQS ainsi, les ions H+ partent de l’électrode 2 (électrode qui contient H2AQS)
Ainsi, les ions H+ partent de l’électrode 2 vers l’électrode 1.
On considère une cellule électrochimique produisant un courant électrique de 250 A pendant 6,0 h. La cellule est alimentée par des solutions électrolytiques de concentration en quantité de matière apportée en BQDS et H2AQS égale à 1,0 mol·L– 1.
Données :
- nombre d’Avogadro : NA = 6,02×1023 mol-1 ;
- charge élémentaire e = 1,6×10-19 C ;
- constante de Faraday : F = 96 500 C·mol-1.
Le Faraday est la valeur absolue de la charge électrique d’1 mol d’électrons.
Q.5. Montrer que la capacité électrique de la cellule a une valeur proche de Q = 5,4 × 106 C.
$$
Q=I\times\delta t
$$
$$
Q=250\times6\times60\times60
$$
$$
Q=5,4\times{10}^6\ C
$$
Q.6. Déterminer le volume de chaque électrolyte nécessaire pour assurer le fonctionnement de cette cellule.
En déduire le volume réel sachant que seulement 70 % des électrons susceptibles d’être produits par les réactions d’oxydoréduction contribuent réellement au courant électrique.
$$
Q=n_{e^-}\times Na\times e
$$
$$
n_{e^-}\times Na\times e=Q
$$
$$
n_{e^-}=\frac{Q}{Na\times e}
$$
D’après la demi-équation :
$$
BQDS+2H^++2e^-=H_2BQDS
$$
$$
n_{BQDS}=\frac{n_{e^-}}{2}
$$
Ainsi
$$
n_{BQDS}=\frac{Q}{2\times Na\times e}
$$
Or
$$
n_{BQDS}=C\times V
$$
Ainsi
$$
C\times V=\frac{Q}{2\times Na\times e}
$$
$$
V=\frac{Q}{2\times Na\times e\times c}
$$
$$
V=\frac{5,4\times{10}^6}{2\times6,02\times{10}^{23}\times1,6\times{10}^{-19}\times1,0}
$$
$$
V=28\ L
$$
Idem pour le volume de l’autre électrolyte sachant que 2 électrons sont également échangés et que la concentration est identique.
Sachant que seulement 70 % des électrons susceptibles d’être produits par les réactions d’oxydoréduction contribuent réellement au courant électrique, calculons le volume réel :
$$
V_{reel}=\frac{V}{0,70}
$$
$$
V_{reel}=\frac{28}{0,70}
$$
$$
V_{reel}=40\ L
$$
Afin d’atteindre des puissances adaptées à une utilisation sur le réseau électrique, les batteries sont en réalité constituées de plusieurs cellules électrochimiques associées en série. On considère un système constitué d’un assemblage de 60 cellules identiques à celle étudiée précédemment.

Q.7. Déterminer le volume total de chaque électrolyte nécessaire au fonctionnement de ce système pendant 6,0 h.
Chaque cellule est identique à celle étudié précédemment. Il y a 60 cellules.
Le volume de chaque électrolyte est donc de
$$
V_{electrolyte}=60\times V_{reel}
$$
$$
V_{electrolyte}=60\times40
$$
$$
V_{electrolyte}=2400\ L
$$
Q.8. Parmi les nombreux avantages de ce type de batterie, figure sa capacité de stockage qui peut être facilement augmentée. Proposer une solution simple pour doubler la durée de fonctionnement du système étudié à puissance délivrée constante.
D’après la question Q.6. :
$$
V=\frac{Q}{2\times Na\times e\times c}
$$
or
$$
Q=I\times\Delta t
$$
Donc
$$
V=\frac{I\times\Delta t}{2\times Na\times e\times c}
$$
$$
\frac{I\times\Delta t}{2\times Na\times e\times c}=V
$$
$$
\Delta t=\frac{V\times2\times Na\times e\times c}{I}
$$
Le temps est proportionnel à la concentration.
Ainsi, pour doubler la durée de fonctionnement du système étudié à puissance délivrée constante, on peut doubler la valeur de la concentration.
Pour se positionner sur le marché du stockage de l’énergie, les batteries à flux redox doivent atteindre une valeur minimale d’énergie volumique de l’ordre de 10 W·h·L-1. Cette valeur correspond au quotient de l’énergie délivrée par le système (en W·h) par le volume total d’électrolytes (en L).
Q.9. Déterminer la puissance électrique du système.
En déduire l’énergie en W·h produite par le système lorsqu’il délivre du courant pendant 6,0 h.
La puissance est définie par :
$$
P=U\times I
$$
$$
P=60\times250
$$
$$
P=1,5\times{10}^4\ W
$$
L’énergie est définie par :
$$
E=P\times\Delta t
$$
$$
E=1,5\times{10}^4\times6,0
$$
$$
E=9,0\times{10}^4\ Wh
$$
Q.10. Déterminer si la batterie à flux redox étudiée peut se positionner sur le marché. Justifier.
Le flux redox correspond au quotient de l’énergie délivrée par le système (en W·h) par le volume total d’électrolytes (en L).
$$
Flux=\frac{E}{V_{total\ electrolyte}}
$$
$$
Flux=\frac{9,0\times{10}^4}{2\times2400}
$$
$$
Flux=19\ Wh.L^{-1}
$$
Le flux redox doit atteindre une valeur minimale d’énergie volumique de l’ordre de 10 WhL⁻¹.
Ainsi, cette batterie à flux redox étudiée peut se positionner sur le marché
