E3C2 – Durée 1h – calculatrice autorisée
Dans plusieurs régions de France, on fabrique du vin d’épines, un apéritif alcoolisé qui titre environ à environ 15 % en degré d’alcool. Cette boisson est préparée en faisant macérer de jeunes pousses de prunellier, un petit arbre rustique, dans un mélange de sucre, de vin et d’eau de vie* pendant un mois. Après filtration, ce mélange est mis en bouteille pour vieillir pendant au moins trois mois, avant de pouvoir être dégusté. En fin de période de vieillissement, il est possible de vérifier le degré d’alcool du vin d’épines fabriqué en réalisant un titrage suivi par colorimétrie.
On considère que l’alcool présent dans les boissons alcoolisées est une seule et même espèce chimique : l’éthanol.
Le degré d’alcool d’une boisson alcoolisée, noté (°), correspond au volume d’éthanol pur contenu dans 100 mL de boisson. Par exemple,100 mL d’une boisson à 35° contient 35 mL d’éthanol pur.
*boisson alcoolisée obtenue par distillation de jus fermentés de fruits, de céréales ou de tubercules.

L’objectif de cet exercice est d’étudier quelques propriétés de l’éthanol et de déterminer le degré d’alcool d’un vin d’épines.
1. À propos de l’éthanol
Données :
- Représentations moléculaires de l’éthanol et de l’acide éthanoïque
Éthanol
Formule brute C2H6O
Modèle moléculaire
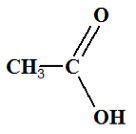
Acide éthanoïque Formule semi-développée
- Électronégativité selon l’échelle de Pauling de quelques éléments
| Élément | C | H | O |
| Électronégativité χ | 2,55 | 2,20 | 3,44 |
- Bandes d’absorption en spectroscopie IR
| Liaison | O-H (alcool) | O-H (acide) carboxylique) | C=O |
| Nombre d’onde (cm-1) | 3200 – 3400 bande forte et large | 2500 – 3200 bande forte et très large | 1700 – 1800 bande forte et fine |
Représenter le schéma de Lewis de l’éthanol.
1.1. Justifier le fait que la molécule d’éthanol est une molécule polaire.
1.2. Expliquer pourquoi l’éthanol est miscible avec l’eau.
1.3. En présence d’un excès d’oxydant, l’éthanol peut être oxydé en acide éthanoïque.
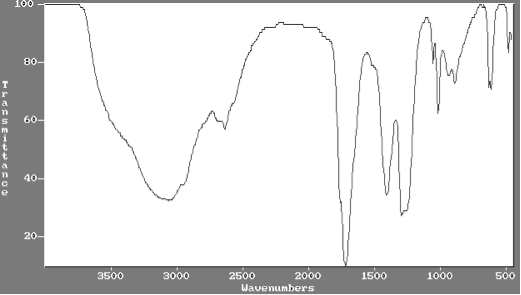
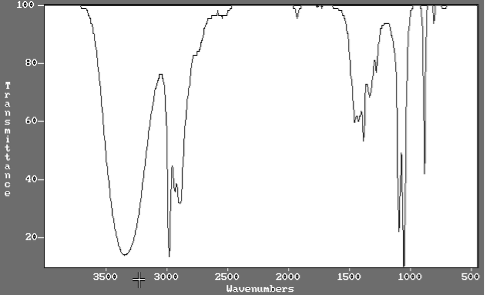
Les spectres infrarouges de l’acide éthanoïque et de l’éthanol sont donnés ci-dessous. Expliquer comment on peut les utiliser pour justifier que la transformation de l’éthanol en acide éthanoïque a eu lieu.
Spectre infrarouge de l’acide éthanoïque
Spectre infrarouge de l’éthanol
D’après tice.ac-montpellier.fr
2. Détermination du degré d’alcool du vin d’épines
Le vin d’épines étant constitué de diverses espèces chimiques, on effectue une distillation fractionnée d’un mélange de 50 mL de vin d’épines et d’eau pour en extraire l’éthanol. On verse le distillat dans une fiole jaugée de 500 mL et on complète avec de l’eau distillée. On obtient 500 mL de solution notée S contenant tout l’éthanol initialement présent dans 50 mL de vin d’épines.
L’éthanol réagit avec les ions permanganate en milieu acide, mais cette transformation, quoique totale, est lente : elle ne peut donc pas être le support d’un titrage. On procède donc en deux étapes.
Étape 1 : on introduit les ions permanganate en excès dans un volume donné de la solution S pour transformer tout l’éthanol présent en acide éthanoïque et on laisse le temps nécessaire à la transformation de s’effectuer.
Étape 2 : on réalise ensuite le titrage des ions permanganate restants par les ions Fe2+.
Données :
– Couples oxydant-réducteur :
acide éthanoïque / éthanol : C2H4O2(aq) / C2H6O (aq)
ion permanganate / ion manganèse : MnO4–(aq) / Mn2+(aq)
– Demi-équation électronique : MnO4–(aq) + 8 H+(aq) + 5 e– = Mn2+(aq) + 4 H2O(l)
– Masse volumique de l’éthanol : 0,79 g.mL-1
– Masse molaire de l’éthanol : M = 46 g.mol-1
– Toutes les espèces chimiques en solution sont incolores mis à part les ions permanganate qui sont violets.
2.1. Étude de l’étape 1
On s’intéresse ici à la réaction entre les ions permanganate et l’éthanol.
Dans un erlenmeyer, on mélange V0 = 2,0 mL de solution S et V1 = 25,0 mL d’une solution acidifiée de permanganate de potassium (K+(aq) +MnO4– (aq)) de concentration en quantité de matière C1 = 5,00.10–2 mol.L–1 .
On bouche l’erlenmeyer et on laisse réagir pendant environ 30 minutes, à 60°C.
2.1.1. Établir que l’équation de réaction entre l’éthanol et les ions permanganate en milieu acide s’écrit : 5 C2H6O(aq) + 4 MnO4–(aq) + 12 H+(aq) → 5 C2H4O2(aq) + 4 Mn2+(aq) + 11 H2O (l)
2.1.2. Compléter le tableau d’avancement en ANNEXE A RENDRE AVEC LA COPIE, en utilisant comme notation :
– n0, quantité de matière initiale d’éthanol présente dans le volume V0
– n1, quantité de matière initiale d’ions permanganate présente dans le volume V1.
2.1.3. En s’appuyant sur le tableau d’avancement de l’ANNEXE A RENDRE AVEC LA COPIE, montrer que dans l’état final, la quantité d’ions permanganate restant dans l’erlenmeyer peut s’écrire :
![]()
On titre les ions permanganate restants à la fin de l’étape 1, directement dans l’erlenmeyer, par une solution aqueuse contenant des ions Fe2+ à la concentration en quantité de matière
C2 = 3,00.10-1 mol.L-1.
L’équation de la réaction de support du titrage entre les ions permanganate MnO4– et les ions Fe2+ est : MnO4– (aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq) + 4 H2O(l)
Le volume de solution titrante versé pour atteindre l’équivalence est V2éq = 14,1 mL.
2.2.1. Définir le terme « équivalence » utilisé lors d’un titrage.
2.2.2. Préciser, en justifiant, le changement de couleur qui permet de repérer l’équivalence.
2.2.3. Indiquer la relation qui existe, à l’équivalence, entre les quantités de matière d’ions permanganate présents initialement et les ions Fe2+ versés à l’équivalence.
2.2.4. La quantité d’éthanol initialement présente dans le volume 50 mL de vin d’épines est alors donnée par la relation :
![]()
Déterminer si le degré d’alcool annoncé de ce vin d’épines est conforme à celui annoncé pour ces apéritifs.
Le candidat est invité à présenter son raisonnement de manière claire et ordonnée. Toute tentative de réponse, même incomplète, sera valorisée.
ANNEXE À RENDRE AVEC LA COPIE
Question 2.1.2 :
| Équation de la réaction | 5 C2H6O(aq) | + 4 MnO4–(aq) | + 12 H+ | → 5 C2H4O2(aq) | + 4 Mn2+(aq) | + 11 H2O(l) | |
| État | Avancement (mol) | n(C2H6O) | n(MnO4–) | n(H+) | n(C2H4O2) | n(Mn2+) | n(H2O) |
| Initial | 0 | n0 | n1 | / | / | ||
| En cours | x | / | / | ||||
| Final | xf | / | / |
Remarques :
- On rappelle que l’ion permanganate est introduit en excès.
- L’eau étant le solvant et l’ion hydrogène n’étant pas limitant, leurs quantités ne seront pas précisées.
