Asie 2022 Sujet 2
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2JA1
Sujet et corrigé
Mots-clés : réaction Acide-Base, titrage avec suivi pH-métrique, spectrocopie infrarouge
Pour permettre aux enfants de découvrir les sciences, certains sites internet proposent des expériences simples et réalisables chez soi, comme la dissolution d’une coquille d’œuf dans du vinaigre blanc.
Dans cet exercice, on se propose de vérifier le titre d’un vinaigre blanc et d’étudier l’action de ce vinaigre sur une coquille d’œuf.
A – Vérification du degré d’un vinaigre blanc
Le vinaigre blanc est une solution aqueuse d’un acide faible appelé acide éthanoïque dont la formule chimique est CH3COOH (aq). Le vinaigre blanc a une acidité de 8 ° en acide éthanoïque. La valeur de son pH est d’environ 3.
Données :
- Couples acide / base : CH3COOH (aq)/ CH3COO– (aq) ; H2O (ℓ) / HO– (aq)
- pKA du couple (acide éthanoïque / ion éthanoate): 4,8 ;
- Masses molaires atomiques : M(H) = 1,0 g·mol–1 ; M(C) = 12,0 g·mol–1 ; M(O) = 16,0 g·mol–1 ; M(Ca) = 40,0 g·mol–1.
- Le titre ou l’acidité d’un vinaigre est donné en degré (°) : 1,00° correspond à 1,00 g d’acide éthanoïque pur pour 100 g de vinaigre ;
- La valeur de la masse volumique du vinaigre ρ est : ρ = 1010 g·L–1.
1. Tracer le diagramme de prédominance du couple acide éthanoïque / ion éthanoate. Indiquer quelle espèce prédomine dans la solution de vinaigre.
Diagramme de prédominance :
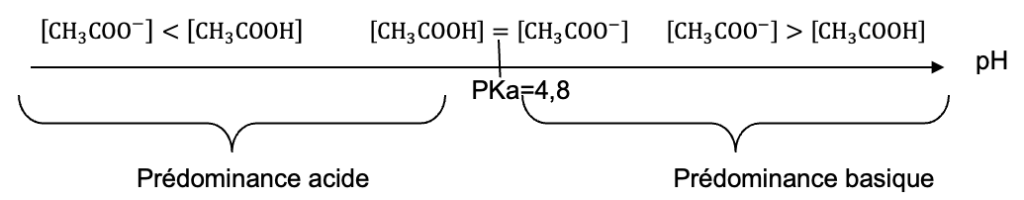
Pour le vinaigre blanc qui a un pH=3 : CH3COOH prédomine.
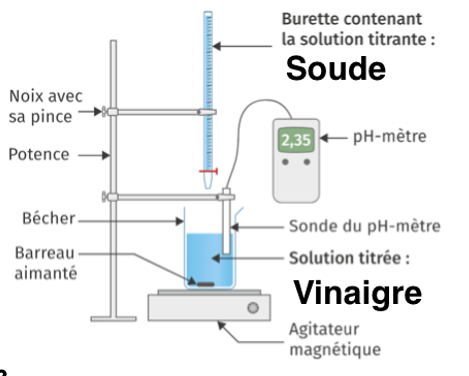
Pour vérifier le titre en degré du vinaigre, on réalise un titrage avec suivi pH-métrique d’un volume de vinaigre Vvinaigre égal à 5,0 mL par une solution de soude (Na+ (aq) + HO– (aq)) de concentration cb = 5,0·10–1 mol·L–1. La valeur du volume relevé à l’équivalence est :Véq = 13,4 mL.
2. Faire un schéma annoté du montage expérimental nécessaire à la mise en œuvre du titrage.
3. Écrire la réaction support du titrage qui a lieu entre la solution de soude et le vinaigre.
$$CH_3COOH_{(aq)}+{\rm HO}*{(aq)}^- \rightarrow {CH_3COO}*{(aq)}^-+H_2O_{(l)}$$
4. Déterminer la concentration en mol· L–1 de l’acide éthanoïque, notée ca , présent dans ce vinaigre.
À l’équivalence, les réactifs sont introduits dans des proportions stœchiométriques :
$$\frac{n_{CH_3COOH}^i}{1}=\frac{n_{H0^-}^{eq}}{1}$$
$$c_a \times V_{vinaigre}=c_B \times V_{eq}$$
$$c_a=\frac{c_B \times V_{eq}}{V_{vinaigre}}$$
$$c_a=\frac{5,0.{10}^{-1} \times 13,4}{5,0}$$
$$c_a=1,3\ mol.L^{-1}$$
5. En détaillant le raisonnement, vérifier que le titre de ce vinaigre est bien de 8°.
Pour répondre à cette question, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
« 1,00° correspond à 1,00 g d’acide éthanoïque pur dans 100 g de vinaigre »
Calculons la masse d’acide éthanoïque pur dans $V_{vinaigre}=5,0\ mL$ :
$$n_A=\frac{m_A}{M_A}$$
$$m_A=n_A \times M_A$$
Or $n_A=c_a \times V_{vinaigre}$
D’où : $$m_A=c_a \times V_{vinaigre} \times M_A$$
Avec :
$$M_A=M_{CH_3COOH}=2M_C+2M_O+4M_H$$
$$M_A=2 \times 12,0+2 \times 16,0+4 \times 1,0$$
$$M_A=60,0\ g.{\rm mol}^{-1}$$
$$m_A=c_a \times V_{vinaigre} \times M_A$$
$$m_A=1,3 \times 5,0.{10}^{-3} \times 60,0$$
$$m_A=0,39\ g$$
Calculons la masse de vinaigre dans $V_{vinaigre}=5,0\ mL$ :
$$\rho_{vinaigre}=\frac{m_{vinaigre}}{V_{vinaigre}}$$
$$m_{vinaigre}=\rho_{vinaigre} \times V_{vinaigre}$$
$$m_{vinaigre}=1010 \times 5,0.{10}^{-3}$$
$$m_{vinaigre}=5,1\ g$$
Calculons la masse d’acide éthanoïque pur dans 100 g de vinaigre :
| Masse d’acide éthanoïque (en g) | Masse de vinaigre (en g) |
| 0,39 | 5,1 |
| m | 100 |
$$m=\frac{100 \times 0,39}{5,1}$$
$$m=7,6\ g$$
$$m\approx 8\ g$$
Or « 1,00° correspond à 1,00 g d’acide éthanoïque pur dans 100 g de vinaigre »
Soit 8° pour ce vinaigre.
B – Action du vinaigre sur une coquille d’œuf
La coquille d’œuf des oiseaux est constituée en majorité (95 %) d’une substance minérale appelée carbonate de calcium dont la formule chimique est CaCO3 (s).
Le processus est lent, mais en immergeant un œuf dans du vinaigre, on voit apparaître de petites bulles de gaz qui se forment à la surface de la coquille qui se dissout.
Données :
- Principales bandes d’absorption IR :
O–H alcool : 3200 à 3400 cm–1 (bande forte et large)
O–H acide carboxylique : 2600 à 3100 cm–1 (bande forte et très large)
C=O : 1700 à 1760 cm–1 (bande forte et fine)
- Couples acide / base : CO2 (g),H2O (ℓ) / HCO3 – (aq) ; HCO3 – (aq) / CO32– (aq)
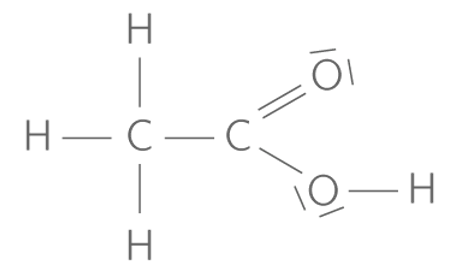
6. Représenter le schéma de Lewis de l’acide éthanoïque CH3COOH.
7. À l’aide des principales bandes d’absorption données, identifier le spectre infrarouge correspondant à l’acide éthanoïque parmi ceux proposés dans la figure 1 ci-dessous.
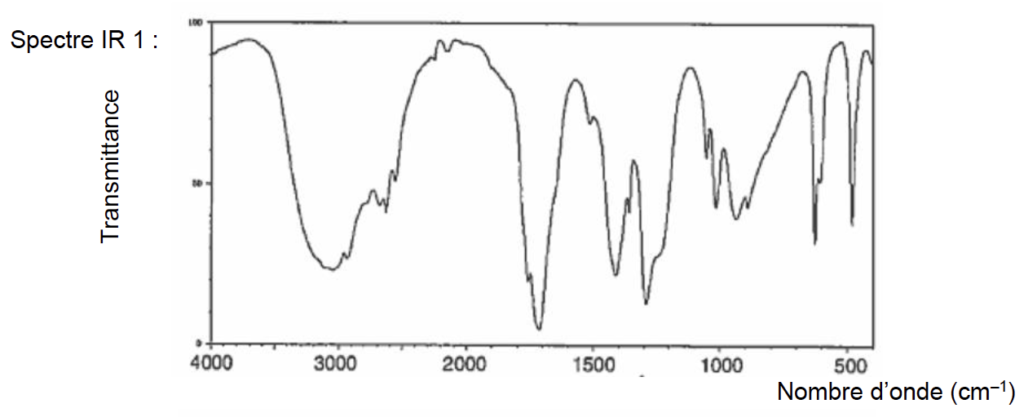
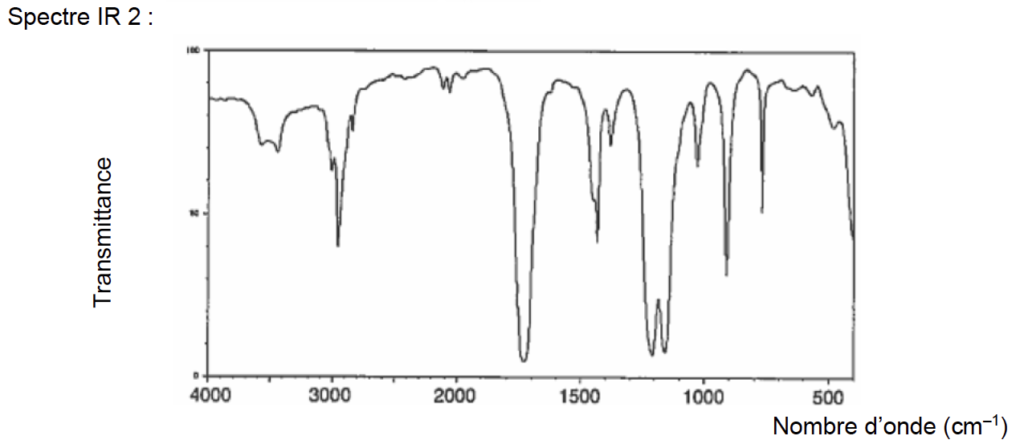
Figure 1. Spectres infrarouges de deux substances
Source : https://webbook.nist.gov/
L’acide éthanoïque CH3COOH comporte des liaisons :
C=O : 1700 à 1760 cm-1 (bande forte et fine)
O-H d’un acide carboxylique : 2600 à 3100 cm-1 (bande forte et très large)
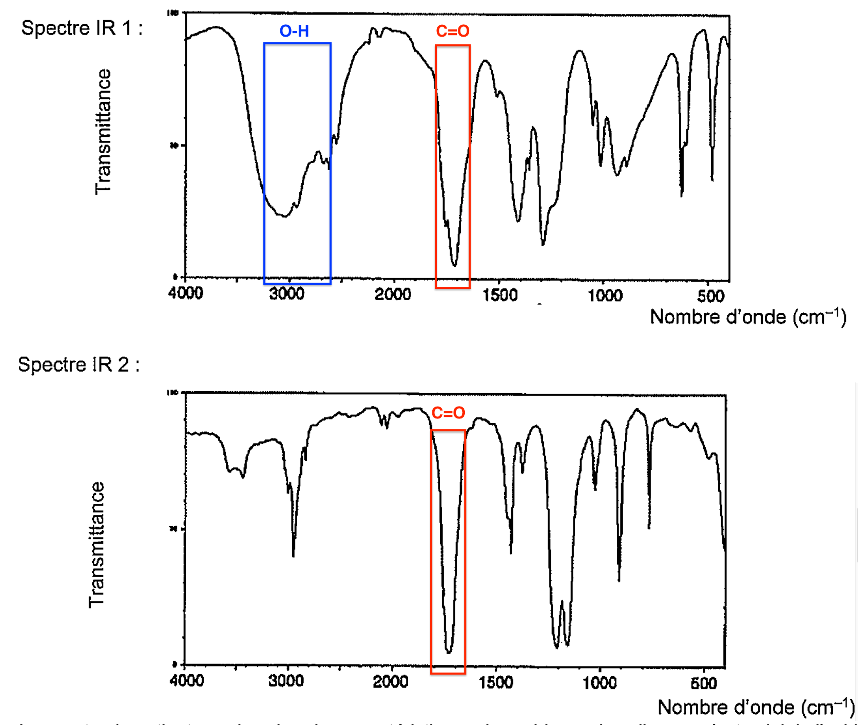
Le spectre 1 contient ces deux bandes caractéristiques des acides carboxyliques : c’est celui de l’acide éthanoïque.
En solution aqueuse, le carbonate de calcium CaCO3 (s) se dissout, selon l’équation :
CaCO3 (s) → Ca2+ (aq) + CO3 2- (aq)
8. L’ion carbonate CO3 2- (aq) réagit avec l’acide éthanoïque introduit en large excès. Écrire l’équation de la réaction acido-basique qui se produit entre ces deux espèces chimiques.
Couples :
$CH_3COOH_{(aq)}/{CH_3COO}{(aq)}^-$
${\rm HCO}_{3(aq)}^-/{\rm CO}_{3(aq)}^{2-}$
$$CH_3COOH_{(aq)}+{\rm CO}_{3(aq)}^{2-} \rightleftarrows {CH_3COO}{(aq)}^-+{\rm HCO}_{3(aq)}^-$$
9. L’ion hydrogénocarbonate HCO3 – (aq) ainsi formé réagit avec l’acide éthanoïque. Écrire l’équation de la réaction acido-basique qui se produit entre ces deux espèces chimiques.
Couples :
$CH_3COOH_{(aq)}/{CH_3COO}{(aq)}^-$
${\rm CO}{2(g)},H_2O_{(l)}/{\rm HCO}_{3(aq)}^-$
$$CH_3COOH_{(aq)}+{\rm HCO}_{3(aq)}^- \rightleftarrows {CH_3COO}{(aq)}^-+{\rm CO}_{2(g)},H_2O{(l)}$$
10. Montrer que l’équation de la réaction qui modélise l’action du vinaigre sur le carbonate de calcium s’écrit :
CaCO3 (s) + 2 CH3COOH (aq) → Ca2+ (aq) + CO2 (g) + H2O (ℓ) + 2 CH3COO – (aq)
$$CaCO_{3(s)} \rightarrow {\rm Ca}{(aq)}^{2+}+{\rm CO}_{3(aq)}^{2-}$$
$$CH_3COOH_{(aq)}+{\rm CO}_{3(aq)}^{2-} \rightleftarrows {CH_3COO}{(aq)}^-+{\rm HCO}{3(aq)}^-$$
$$CH_3COOH{(aq)}+{\rm HCO}_{3(aq)}^- \rightleftarrows {CH_3COO}{(aq)}^-+{\rm CO}{2(g)},H_2O{(l)}$$
$$CaCO_{3(s)}+CH_3COOH_{(aq)}+{\rm CO}_{3(aq)}^{2-}+CH_3COOH{(aq)}+{\rm HCO}_{3(aq)}^- \rightarrow {CH_3COO}{(aq)}^-+{\rm HCO}_{3(aq)}^-+{CH_3COO}{(aq)}^-+{\rm CO}{2(g)},H_2O{(l)}+{\rm Ca}*{(aq)}^{2+}+{\rm CO}_{3(aq)}^{2-}$$
$$CaCO_{3(s)}+2CH_3COOH_{(aq)} \rightarrow 2{CH_3COO}{(aq)}^-+{\rm CO}_{2(g)},H_2O_{(l)}+{\rm Ca}_{(aq)}^{2+}$$
Soit :
$$CaCO_{3(s)}+2CH_3COOH_{(aq)} \rightarrow {\rm Ca}{(aq)}^{2+}+{\rm CO}_{2(g)}+H_2O_{(l)}+2{CH_3COO}_{(aq)}^-$$
11. Indiquer, en le justifiant, le caractère acide-base de l’ion hydrogénocarbonate HCO3– (aq).
${\rm HCO}_{3(aq)}^-$ est l’acide du couple ${\rm HCO}_{3(aq)}^-/{\rm CO}_{3(aq)}^{2-}$.
${\rm HCO}_{3(aq)}^-$ est la base du couple ${\rm CO}_{2(g)},H_2O{(l)}/{\rm HCO}_{3(aq)}^-$.
${\rm HCO}_{3(aq)}^-$ est donc une espèce amphotère.
