Métropole 2022 Sujet 2
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2ME1
Sujet et corrigé
Mots-clés : spectrophotométrie, oxydoréduction
Les effaceurs d’encre sont apparus en Allemagne dans les années 1970. Ils permettent de faire disparaître les traits de couleur bleue des stylos plume.
Le colorant principal de l’encre bleue est le bleu d’aniline, solide ionique de formule C32H25N3O9S3Na2. L’encre ne contient que 3 à 5 % en masse de ce colorant, le reste étant de l’eau, de l’alcool et d’autres additifs.
D’après le site : https://tice.ac-montpellier.fr/ABCDORGA/Famille/ENCRES.htm
Le but de cet exercice est d’étudier la composition d’une encre de stylos plume avant de déterminer le nombre de cartouches qui peuvent être effacées avec un effaceur.
Données :
- volume d’encre contenu dans une cartouche : Vcartouche = 0,60 mL ;
- masse volumique de l’encre ρencre= 1,1 g·mL–1 ;
- masse molaire du bleu d’aniline : Mbleu = 737,7 g·mol–1 ;
- expression de l’absorbance A d’une solution de concentration C (loi de Beer-Lambert) :
A = ε· l·C
avec ε le coefficient d’absorption molaire de l’espèce absorbante et l l’épaisseur de la solution traversée ;
- coefficient d’absorption molaire du bleu d’aniline à λ = 580 nm : ε = 5,00×104 L·mol–1·cm–1 ;
- largeur de la cuve (épaisseur de la solution traversée) du spectrophotomètre utilisé : l = 1,0 cm ;
- cercle chromatique :

- pKA à 25 °C des couples acide / base :
– (SO2,H2O)(aq) / HSO3–(aq) : pKA1 = 1,8 ;
– HSO3–(aq) / SO32–(aq) : pKA2 = 7,0 ;
- couples oxydant / réducteur :
- ion sulfate / ion sulfite : SO42–(aq) / SO32–(aq) ;
- diiode / ion iodure : I2(aq) / I–(aq) ;
- demi-équation électronique en milieu basique du couple SO42–(aq) / SO32–(aq) :
SO42–(aq) + H2O(l) + 2 e– = SO32–(aq) + 2 OH–(aq).
1. Encre des stylos plume
Afin de déterminer la quantité de bleu d’aniline présente dans une cartouche, on souhaite réaliser un dosage spectrophotométrique.
Pour rester dans le domaine de validité de la loi de Beer-Lambert, l’encre d’une cartouche est diluée.
Protocole suivi :
- aspirer la totalité de l’encre de la cartouche à l’aide d’une seringue équipée d’une aiguille ;
- introduire l’encre récupérée dans une fiole jaugée de volume V1 = 100 mL et compléter avec de l’eau distillée : on note S1 la solution ainsi préparée ;
- préparer un volume V2 = 100 mL d’une solution S2 en diluant 20 fois la solution S1 ;
- mesurer l’absorbance de la solution S2 pour différentes valeurs de longueur d’onde. Les résultats des mesures sont reportés sur la figure 1.
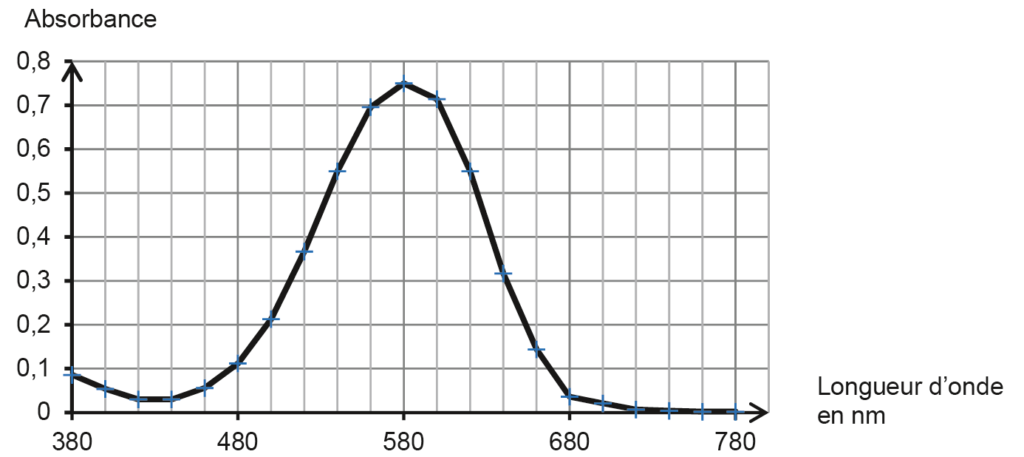
Figure 1. Spectre d’absorption de la solution S2 de bleu d’aniline obtenue par dilution de l’encre contenue dans une cartouche
Q1. Montrer que le spectre d’absorption obtenu est en accord avec la couleur de l’encre.
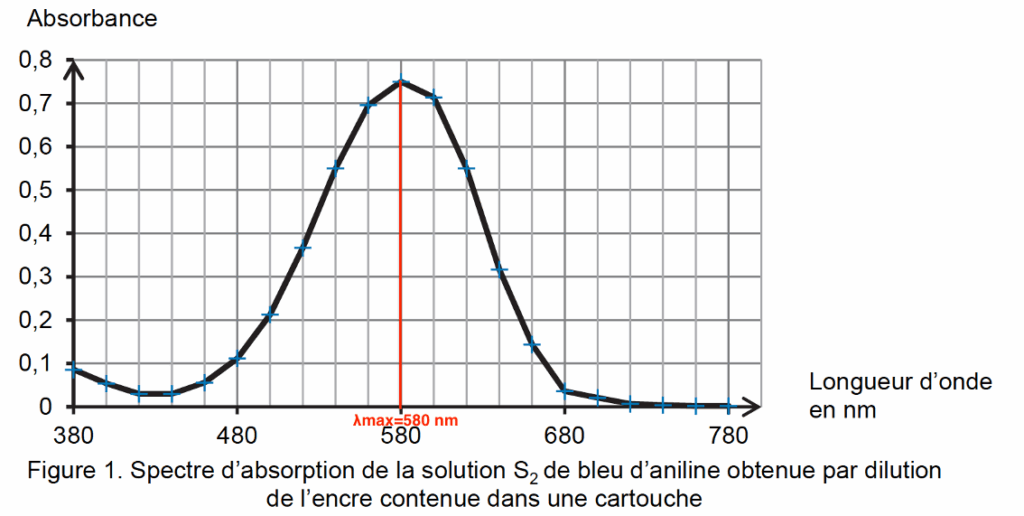
La couleur absorbée correspond à $\lambda_{max}=580\ nm$ couleur orangé.
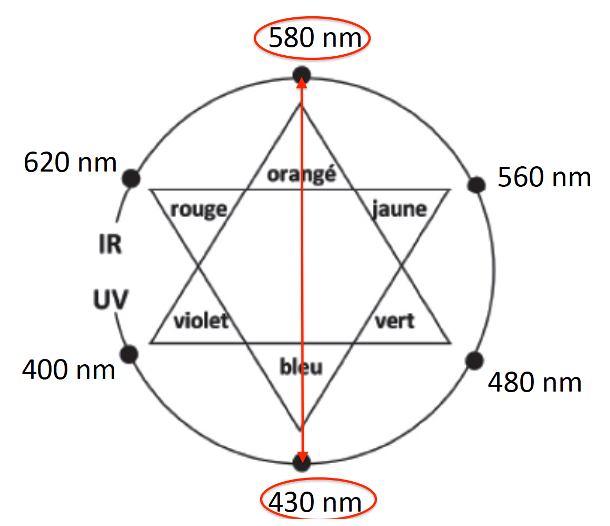
Sa couleur est la couleur complémentaire de l’orangé (couleur opposée sur le cercle chromatique) : le bleu.
La solution est donc de couleur bleue.
C’est en accord avec la couleur de l’encre : « Le colorant principal de l’encre bleue ».
Q2. Nommer la verrerie nécessaire à la préparation par dilution de la solution S2, en précisant les volumes.
Lors d’une dilution, la quantité de matière se conserve :
$$F=\frac{V_2}{V_1}$$
$$V_1=\frac{V_2}{F}$$
$$V_1=\frac{100}{20}$$
$$V_1=5,0\ mL$$
Protocole :
- Verser la solution mère dans un bécher
- Prélever à l’aide d’une pipette jaugée de la solution mère
- Introduire V1 dans une fiole jaugée V2=100,0mL
- Ajouter de l’eau distillée jusqu’au trait de jauge
- Homogénéiser la solution
Q3. Déterminer, en utilisant la loi de Beer-Lambert et la figure 1, la concentration en quantité de matière en bleu d’aniline de la solution S2.
Loi de Beer-Lambert : $A=\varepsilon\times l\times C$\
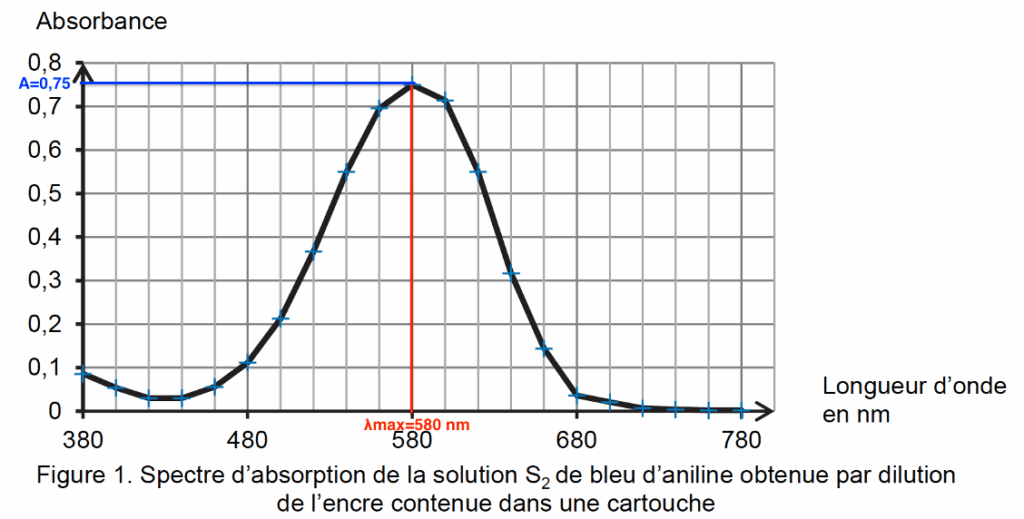
Pour $\lambda_{max}=580\ nm$, $A=0,75$\
$$A=\varepsilon\times l\times C_2$$
$$\varepsilon\times l\times C_2=A$$
$$C_2=\frac{A}{\varepsilon\times l}$$
$$C_2=\frac{0,75}{5,00\times 10^4\times 1,0}$$
$$C_2=1,5\times 10^{-5}\ mol.L^{-1}$$
Q4. Montrer que la quantité de matière de bleu d’aniline présente dans une cartouche d’encre est environ égale à 3,0×10–5 mol.
$$F=\frac{C_1}{C_2}$$
$$\frac{C_1}{C_2}=F$$
$$C_1=F\times C_2$$
$$C_1=20\times 1,5\times 10^{-5}$$
$$C_1=3,0\times 10^{-4}\ mol.L^{-1}$$
$$C_1=\frac{n_1}{V}$$
$$n_1=C_1\times V$$
$$n_1=3,0\times 10^{-4}\times 100\times 10^{-3}$$
$$n_1=3,0\times 10^{-5}\ mol$$
Q5. Calculer le titre massique en bleu d’aniline de l’encre contenue dans la cartouche. Conclure.
$$titre=\frac{m_1}{m_{encre}}$$
Or $m_{encre}=\rho_{encre}\times V_{cartouche}$
et $m_1=n_1\times M_1$
$$titre=\frac{n_1\times M_1}{\rho_{encre}\times V_{cartouche}}$$
$$titre=\frac{3,0\times 10^{-5}\times 737,7}{1,1\times 0,60}$$
$$titre=3,4\times 10^{-2}$$
$$titre=3,4\ %$$
Le résultat correspond aux attentes : « L’encre ne contient que 3 à 5 % en masse de ce colorant ».
2. Effaceur d’encre
Le côté blanc d’un effaceur est constitué d’une mine reliée à un réservoir contenant une solution d’ions sulfite SO32– qui sont responsables de l’effacement de l’encre.
On cherche dans cette partie à déterminer la quantité de matière d’ions sulfite présente dans l’effaceur à l’aide d’un titrage par une solution de diiode de concentration CI2 = 1,0×10–2 mol∙L–1.
Protocole du titrage de la solution contenue dans l’effaceur :
- casser l’effaceur en son milieu pour récupérer le réservoir et la mine blanche contenant la solution d’ions sulfite ;
- les placer dans un bécher avec un peu d’eau ;
- mélanger, attendre quelques minutes puis retirer le réservoir et la mine en veillant à bien les essorer : la solution obtenue est notée S ;
- mesurer le pH de la solution S ;
- placer le bécher sous une burette graduée contenant la solution de diiode puis réaliser le titrage de la solution.
La valeur mesurée du pH de la solution S est 11,0. Le volume de solution de diiode versé à l’équivalence du titrage est égal à VE = 8,2 mL.
Q6. À l’aide d’un diagramme de prédominance, justifier que l’ion sulfite SO32– est majoritaire par rapport à HSO3– et (SO2,H2O) dans la solution S.
Couples :
$\left({\rm SO}_2,H_2O\right)_{(aq)}/{\rm HSO}_{3(aq)}^-$ : $pKA_1=1,8$
${\rm HSO}_{3(aq)}^-/{\rm SO}_{3(aq)}^{2-}$ : $pKA_2=7,0$
Diagramme de prédominance :
$$pKA_1=4,8 \qquad pKA_2=7,0 \qquad pH$$
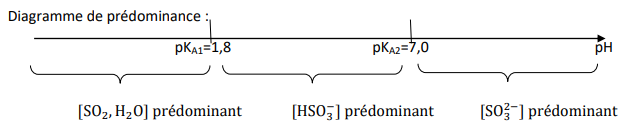
La valeur mesurée du pH de la solution S est $11,0$ : ${\rm SO}_3^{2-}$ est prédominant.
Q7. Écrire l’équation de la réaction d’oxydoréduction support du titrage en milieu basique entre les ions sulfite SO32– et le diiode I2.
Réaction d’oxydoréduction support du titrage en milieu basique entre les ions sulfite ${\rm SO}_{3(aq)}^{2-}$ et le diiode $I_{2(aq)}$ :
${\rm SO}_{4(aq)}^{2-}/{\rm SO}_{3(aq)}^{2-}$ : ${\rm SO}_{3(aq)}^{2-}+2{\rm OH}_{(aq)}^-={\rm SO}_{4(aq)}^{2-}+H_2O*{(l)}+2e^-$
$I_{2(aq)}/I_{(aq)}^-$ : $I_{2(aq)}+2e^-={2I}_{(aq)}^-$
Soit l’équation :
$${\rm SO}_{3(aq)}^{2-}+2{\rm OH}_{(aq)}^-+I_{2(aq)}\rightarrow{\rm SO}_{4(aq)}^{2-}+H_2O_{(l)}+{2I}_{(aq)}^-$$
Q8. Montrer que la quantité de matière d’ion sulfite nSO32– contenue dans un effaceur est voisine de 8×10–5 mol.
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
$$\frac{n_{{\rm SO}_3^{2-}}^i}{1}=\frac{n_{I_2}^{eq}}{1}$$
$$n_{{\rm SO}_3^{2-}}^i=C_{I_2}\times V_E$$
$$n_{{\rm SO}_3^{2-}}^i=1,0\times 10^{-2}\times 8,2\times 10^{-3}$$
$$n_{{\rm SO}_3^{2-}}^i=8,2\times 10^{-5}\ mol$$
La quantité de matière d’ion sulfite $n_{{\mathbf{SO}}_\mathbf{3}^{\mathbf{2}-}}$ contenue dans un effaceur est voisine de $8\times 10^{-5}\ mol$.
Q9. En déduire le nombre de cartouches d’encre que l’on peut effacer avec un seul effaceur en supposant que la réaction d’oxydoréduction entre le bleu d’aniline et les ions sulfite met en jeu une mole de bleu d’aniline pour une mole d’ions sulfite.
On suppose que : « la réaction d’oxydoréduction entre le bleu d’aniline et les ions sulfite met en jeu une mole de bleu d’aniline pour une mole d’ions sulfite. »
Pour $n_{{\mathbf{SO}}_\mathbf{3}^{\mathbf{2}-}}=8,2\times 10^{-5}\ mol$, on peut effacer $n_{bleu\ d’aniline}=8,2\times 10^{-5}\ mol$.
| 1 cartouche | N cartouches |
| $3,0\times 10^{-5}\ mol$ | $8,2\times 10^{-5}\ mol$ |
$$N=\frac{8,2\times 10^{-5}}{3,0\times 10^{-5}}$$
$$N=2,7\ cartouches$$
On peut effacer avec un seul effaceur 2,7 cartouches d’encre.
