E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02725 , n°G1SPHCH02737, n°G1SPHCH02751 et n°G1SPHCH02776
Télécharger l’exercice en PDF :
Des espèces chimiques à base de chlore sont largement utilisées dans le traitement des eaux de piscine car ce sont des produits bon marché, aisément disponibles et faciles à manipuler. L’espèce chimique chlorée active, appelée « chlore libre », se présente sous la forme d’acide hypochloreux de formule HClO(aq). Grâce à ses pouvoirs oxydant et germicide, utilisé en quantité adaptée, le « chlore libre » détruit les microorganismes et assure ainsi une stérilisation efficace de l’eau des piscines.
Une brochure éditée par l’Agence Régionale de Santé pour l’entretien des piscines (http://www.paca.ars.sante.fr/)indique que pour un traitement et une désinfection efficacepar chloration d’une eau de piscine, la concentration en masse du « chlore libre » doit être comprise entre 2 et 4 mg.L-1.
L’objectif de cet exercice est d’étudier une méthode de détermination de la concentration en « chlore libre » d’une eau de piscine et de vérifier son domaine de validité en référence aux indications fournies par un fabricant de produits pour eau de piscine.
D’après une fiche produit de la marque hth® :
PASTILLES DPD POUR PHOTOMETRE
BENEFICES PRODUIT
Réactif pour mesure du Chlore libre (s’utilise avec un photomètre)

CARACTERISTIQUES
Boite de 100 pastilles d’analyse
Réactifs en pastilles pré-dosés de 5,0 mg
MODE D’EMPLOI
Procédure d’Analyse (avec photomètre)
- Initialiser le photomètre et s’assurer que le paramètre est réglé sur Chlore.
- Rincer 2 fois le tube TEST avec l’eau à analyser, le vider et y laisser 2 ou 3 gouttes d’eau.
- Ajouter un comprimé DPD, l’écraser avec le pilon/agitateur et remplir le tube jusqu’au trait 10 mL. Mélanger jusqu’à dissolution complète du réactif.
- Insérer immédiatement le tube dans la chambre de mesure car le résultat peut varier en cas d’attente.
- Appuyer sur LIRE TEST pour lire le résultat.
Recommandation importante : Pour une concentration en acide hypochloreux HClO supérieure à 7,0 mg/L l’échantillon contenant le réactif DPD est susceptible de se décolorer et de conduire à un résultat faux. Dans ce cas, l’absorbance de la solution n’est alors plus proportionnelle à la concentration en masse en « chlore libre ».
Données :
Masses molaires atomiques en g.mol-1:
| H | C | N | O | Cl |
| 1,0 | 12,0 | 14,0 | 16,0 | 35,5 |
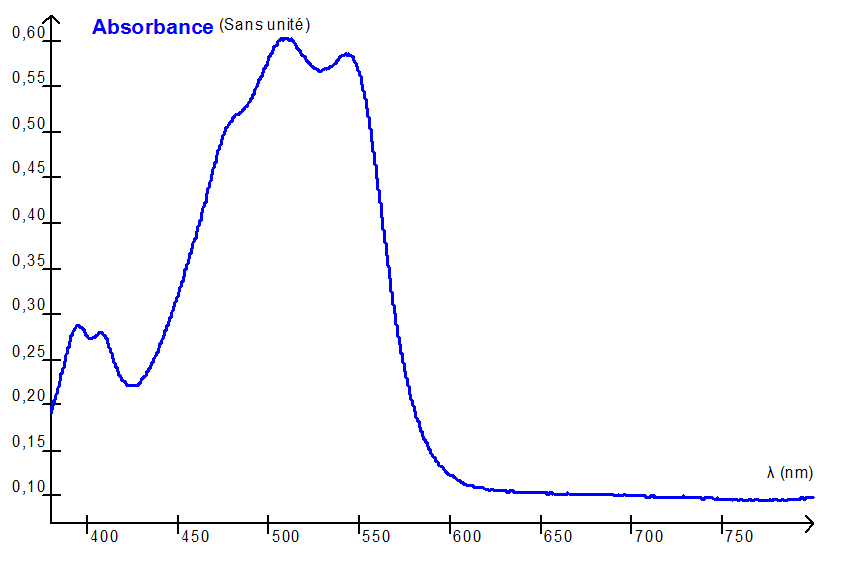
Spectre d’absorption de l’espèce chimique colorée E obtenue par réaction entre le chlore libre et la DPD
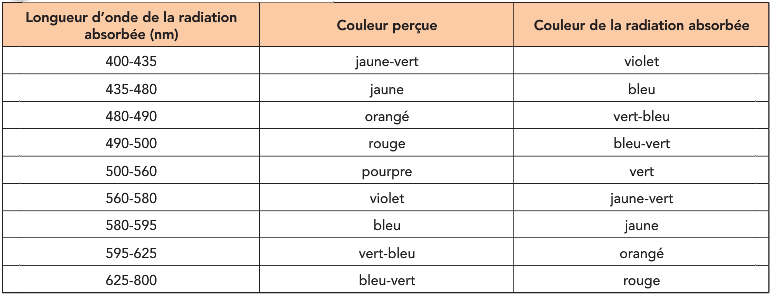
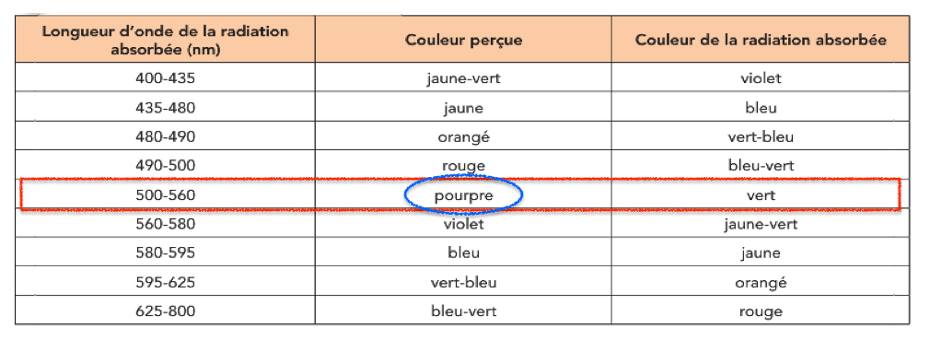
Intervalle de longueur d’onde de la radiation absorbée, couleur perçue et couleur absorbée
1.Détermination de la concentration en chlore libre d’une piscine
En solution aqueuse le « chlore libre » est incolore, rendant ainsi impossible la détermination de sa concentration à l’œil nu par les particuliers.
La méthode colorimétrique proposée ici est dite “ méthode au réactif DPD ” (N,N-diéthylphénylène-1,4-diamine). La DPD réagit avec le « chlore libre » pour former une espèce chimique colorée E dont l’intensité de la coloration est proportionnelle à la concentration en chlore libre pour des valeurs inférieures à 7,0 mg/L.
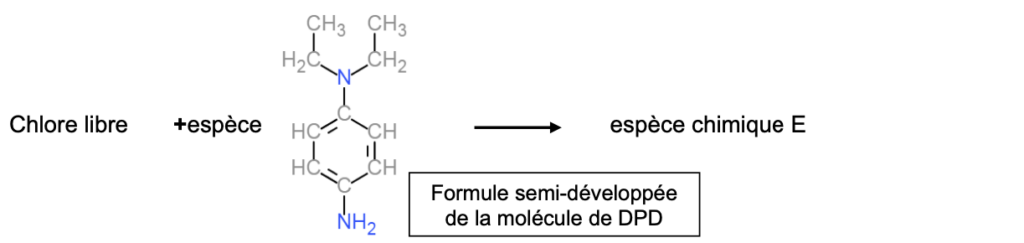
On peut modéliser la formation de l’espèce chimique colorée E par la réaction 1 d’équation ci-dessous :
1.1. Déterminer la couleur perçue de l’espèce chimique E produite lors de la réaction 1. Justifier.
Le spectre présente une bande d’absorbance entre 500 et 560 nm.
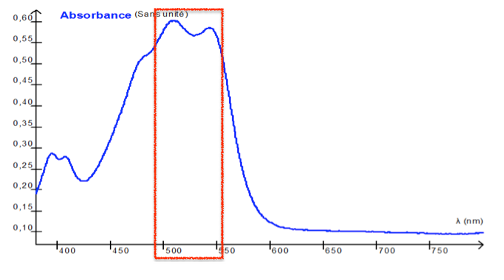
La couleur absorbée est le vert et la couleur de la solution est pourpre.
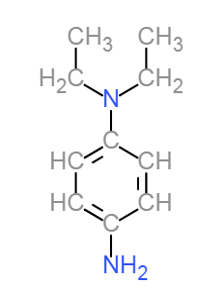
1.2. Déterminer la masse molaire de la DPD.et la quantité de matière de la DPD contenue dans une pastille de 5,0 mg de DPD.
Formule semi-développée de la molécule de DPD
Formule brute $C_{10}H_{16}N_2$
Masse molaire de la DPD :
$$M_{C_{10}H_{16}N_2}=10\times M_C+16\times M_H+2\times M_N$$
$$M_{C_{10}H_{16}N_2}=10\times 12,0+16\times 1,0+2\times 14,0$$
$$M_{C_{10}H_{16}N_2}=164\ g.mol^{-1}$$
Quantité de matière de la DPD contenue dans une pastille de 5,0 mg de DPD
$$n=\frac{m}{M}$$
$$n=\frac{5,0{.10}^{-3}}{164}=3,0{.10}^{-5}mol$$
1.3. Montrer que la recommandation importante du fabricant du photomètre, permet d’affirmer que la quantité de matière de chlore libre présente dans un tube test de 10 mL ne doit pas dépasser 1,3×10-6 mol.
« Pour une concentration en acide hypochloreux HClO supérieure à 7,0 mg/L l’échantillon contenant le réactif DPD est susceptible de se décolorer et de conduire à un résultat faux.»
$$n_{HClO}=\frac{m_{HClO}}{M_{HClO}}$$
et
$$c_m=\frac{m_{HClO}}{V}$$
$$m_{HClO}=c_m\times V$$
D’ou
$$n_{HClO}=\frac{c_m\times V}{M_{HClO}}$$
$$n_{HClO}=\frac{7,0{.10}^{-3}\times 10{.10}^{-3}}{1,0+35,5+16,0}=1,3{.10}^{-6}mol$$
1.4. Compléter le tableau d’avancement, en annexe 1 à rendre avec la copie, par des valeurs numériques, pour un tube test contenant 1,3.10-6 mol de chlore libre et une pastille de DPD.
| Équation de la réaction | Chlore libre + DPD → espèce chimique E | |||
| État : | Avancement en mol | n(Chlore libre) | n(DPD) | n(Espèce E) |
| initial | 0 | $$1,3{.10}^{-6}$$ | $$3,0{.10}^{-5}$$ | 0 |
| intermédiaire | x | $$1,3{.10}^{-6}-x$$ | $$3,0{.10}^{-5}-x$$ | x |
| final | xmax | $$1,3{.10}^{-6}-x_{max}$$ | $$3,0{.10}^{-5}-x_{max}$$ | $$x_{max}$$ |
1.5. Sachant que la DPD doit toujours être introduite en excès par rapport au chlore libre pour effectuer le test, justifier que l’utilisation d’une seule pastille est suffisante.
Calculons de xmax :
$1,3{.10}^{-6}-x_{max1}=0$
$x_{max1}=1,3{.10}^{-6}mol$
$3,0{.10}^{-5}-x_{max2}=0$
$x_{max2}=3,0{.10}^{-5}mol$
$x_{max1}<x_{max2}$
$x_{max}=x_{max1}=1,3{.10}^{-6}mol$
Ainsi, le chlore libre est le réactif limitant.
En introduisant une seule pastille de DPD dans un tube test, le chlore libre est en défaut donc l’utilisation d’une seule pastille est suffisante pour que la DPD soit introduite en excès.
2. Domaine de validité indiqué par le fabricant de produits pour traitement de l’eau de piscine.
Au laboratoire, on se propose de vérifier l’indication du fabricant : « Au-delà de 7 mg.L-1 les résultats du test peuvent s’avérer faux ».
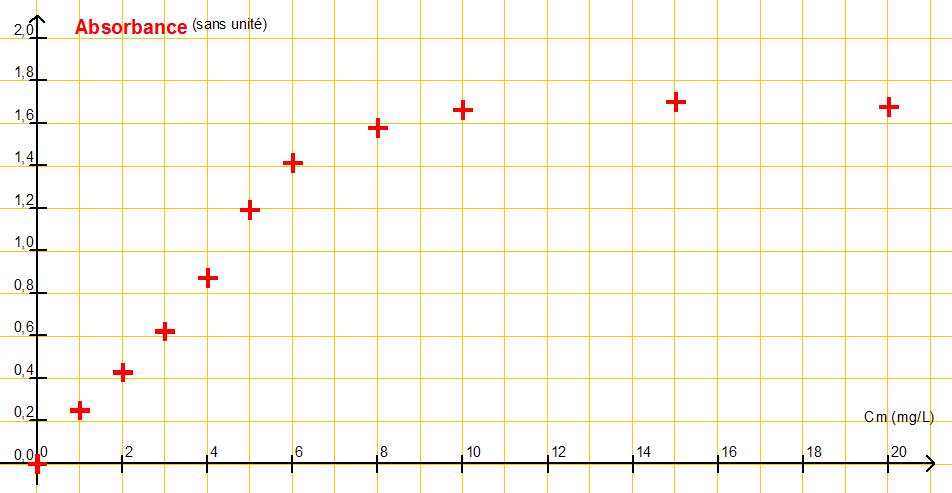
A partir d’une solution de « chlore libre » de concentration en masse C1 = 20 mg.L-1, et de pastilles de DPD on prépare diverses solutions Si dont on mesure l’absorbance A avec un spectrophotomètre.
| Solution | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S8 | S10 |
| Cm (HClO) en mg.L-1 | 20 | 15 | 10 | 8,0 | 6,0 | 5,0 | 4,0 | 3,0 | 2,0 | 1,0 |
| Absorbance | 1,68 | 1,70 | 1,66 | 1,58 | 1,41 | 1,19 | 0,87 | 0,62 | 0,43 | 0,25 |
2.1. À partir de la liste ci-dessous, choisir la verrerie nécessaire à la préparation de la solution S7 à partir de la solution S1. Justifier.
- Burette graduée de 25 mL
- Fioles jaugées : 50,0 mL et 100,0 mL
- Bécher de 50 mL
- Pipette graduée de 10,0 mL
- Pipettes jaugées de 5,0 mL et 10,0 mL
- Éprouvette graduée
Lors d’une dilution la quantité de matière se conserve :
$$n_7=n_1$$
Or
$$n=C\times V$$
Donc
$$C_7V_7=C_1V_1$$
$$V_7=\frac{C_1V_1}{C_7}$$
$$V_7=\frac{20\times V_1}{4,0}$$
$$V_7=5\times V_1$$
V7 le volume fille est celui d’une fiole jaugée et V1 le volume de la solution mère est prélevé avec une pipette jaugée.
Ainsi nous utiliserons une fiole jaugée dont le volume est 5 fois plus grand que le volume de la pipette jaugée.
Il faut prendre une pipette jaugée de 10,0 mL et une fiole jaugée de 50,0 mL.
Protocole :
- Verser la solution mère dans un bécher
- Prélever à l’aide d’une pipette jaugée V1=10,0 mL de la solution mère
- Introduire V1 dans une fiole jaugée 50,0 mL
- Ajouter de l’eau distillée jusqu’au trait de jauge
- Homogénéiser la solution
À l’aide d’un logiciel tableur-grapheur, on obtient la représentation de l’absorbance A en fonction de la concentration en masse en « chlore libre » ci-après.
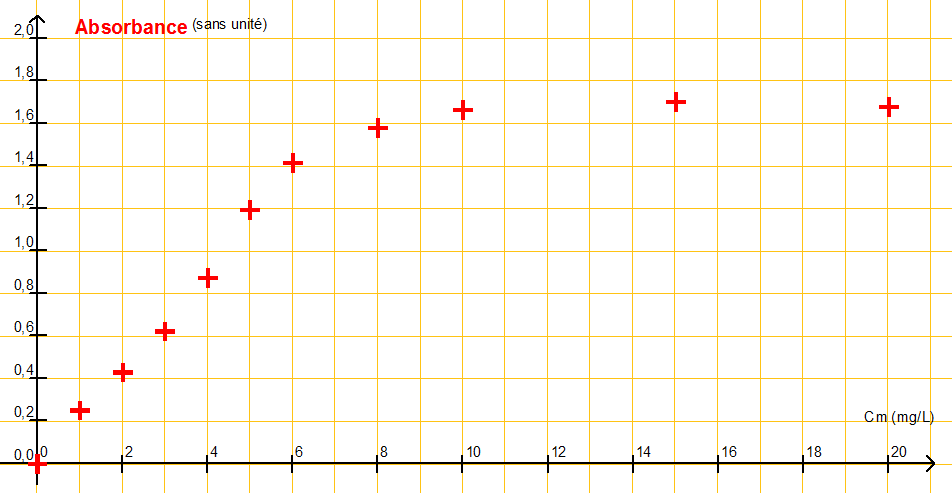
2.2. Cette représentation est-elle en accord avec la recommandation du fabricant ? Justifier votre réponse par un tracé sur l’annexe 2 à rendre avec la copie.
Indication du fabricant : « Au-delà de 7 mg.L-1 les résultats du test peuvent s’avérer faux ».
L’absorbance est proportionnelle à la concentration pour des valeurs de Cm<7,0 mg.L-1.
Au-delà, ce n’est plus proportionnel. Cette représentation est en accord avec la recommandation du fabricant.
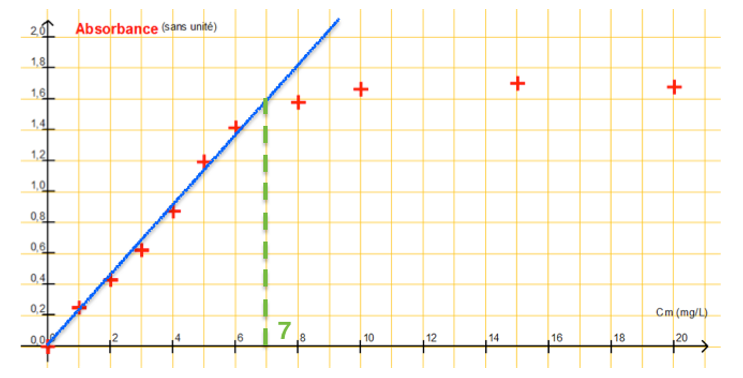
2.3. Donner le nom de la loi mise en évidence en précisant son domaine de validité.
L’absorbance est proportionnelle à la concentration pour des valeurs de Cm<7,0 mg.L-1 :
A=KC
C’est la loi de Beer Lambert.
3. Détermination de la concentration en « chlore libre » d’une eau de piscine
Une eau de piscine est testée par un particulier à l’aide du photomètre hth®. Il obtient une valeur de 1,5 mg.L-1 de « chlore libre ». Au laboratoire, pour la même eau, la mesure de l’absorbance effectuée en suivant la procédure d’analyse décrite ci-dessus donne une valeur A = 0,30.
3.1. Comparer les valeurs des concentrations en masse en « chlore libre » obtenues par les deux méthodes. La concentration en masse en « chlore libre » est-elle suffisante pour assurer une stérilisation efficace de la piscine ? Justifier.
Graphiquement, pour A=0,3 , Cm=1,4 mg.L-1.
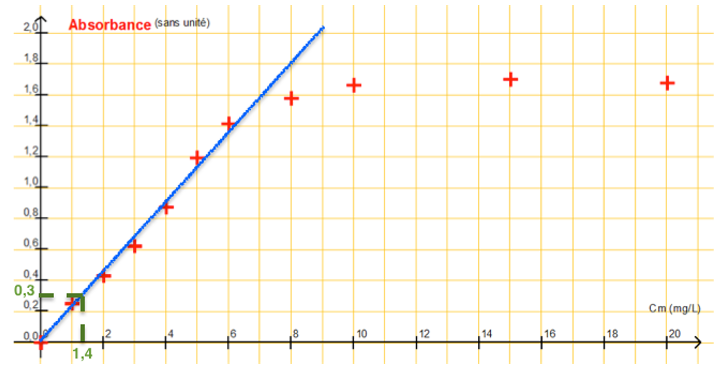
Calculons l’écart relatif :
« L’Agence Régionale de Santé pour l’entretien des piscines indique que pour un traitement et une désinfection efficace par chloration d’une eau de piscine, la concentration en masse du « chlore libre » doit être comprise entre 2 et 4 mg.L–1. »
La concentration en masse en « chlore libre » Cm=1,5 mg.L-1 n’est donc pas suffisante pour assurer une stérilisation efficace de la piscine.
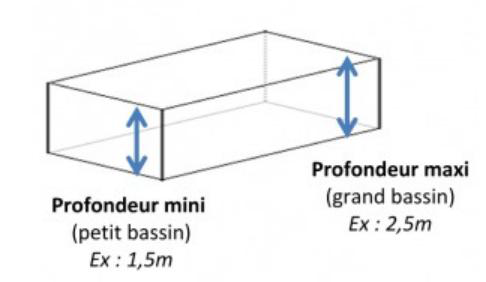
3.2. Sachant que la piscine mesure 8,0 m de longueur sur 4,0 m de largeur et que sa profondeur varie en pente régulière de 1,5 m à 2,5 m, déterminer le nombre de galets de 20 g de chlore libre conviendrait-il de rajouter.
Calculons le volume de la piscine :
L’air d’un trapèze : $$A=\frac{(B+b)\times h}{2}$$
Avec :
- B la grande base, ici B=Profondeur maxi=2,5 m
- b la petite base, ici b=Profondeur mini=1,5 m
- h la longueur de la piscine, ici h=L=8 m
Soit : $$A=\frac{(P_{maxi}+P_{mini})\times L}{2}$$
Volume de la piscine : $$V=A\times l$$
Avec :
- A l’air
- l la largeur de la piscine, ici h’=4 m
$$V=\frac{(P_{maxi}+P_{mini})\times L}{2}\times l$$
$$V=\frac{(2,5+1,5)\times 8}{2}\times 4=64\ m^3$$
Le nombre de galets de 20 g de chlore libre conviendrait-il de rajouter dépend de la masse de chlore libre à ajouter :
$$m_{ajouter}=m_{minimale}-m_{présente}$$
Or
$$m=c_m\times V$$
d’ou :
$$m_{ajouter}=C_{m_{minimale}}\times V-C_{m_{présente}}\times V$$
$$m_{ajouter}=C_{m_{minimale}}-C_{m_{présente}}\times V$$
$$m_{ajouter}=\left(2-1,5\right){.10}^{-3}\times 64{.10}^3$$
$$m_{ajouter}=32\ g$$
La masse à ajouter est la masse minimale.
1 galet a une masse de 20 g. Il faut ajouter 2 galets.
Annexe à rendre avec la copie
- Annexe 1 : question 1.4.
| Équation de la réaction | Chlore libre | + DPD | → espèce chimique E | |
| État : | Avancement en mol | n(Chlore libre) | n(DPD) | n(Espèce E) |
| initial | 0 | |||
| intermédiaire | x | |||
| final | xmax |
- Annexe 2 : question 2.2.
Absorbance A en fonction de la concentration en masse Cm(HClO)en mg.L-1