Nouvelle Calédonie 2022 Sujet 1
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ1NC1
Sujet et corrigé
Mots clés de l’EXERCICE A : réaction acide-base, taux d’avancement final, synthèse.
Les conservateurs sont des substances qui prolongent la durée de conservation des denrées alimentaires en les protégeant des altérations dues aux micro-organismes. La présence d’un conservateur dans les aliments et les boissons est repérée par un code européen (E200 à E297)
L’acide benzoïque C6H5COOH (E210) et le benzoate de sodium C6H5COONa (E211) sont utilisés dans l’industrie comme conservateurs alimentaires pour leurs propriétés fongicides et antibactériennes. Ils sont présents en particulier dans de nombreuses boissons « light ».
Données :
- Couples acide-base à 25 °C : C 6H5COOH / C6H5COO– pKA1 = 4,2
- H2O / HO– pKA2 = 14
- Solubilité de l’acide benzoïque (masse maximale que l’on peut dissoudre dans un litre de solution) : sC6H5COOH = 2,4 g. L–1 à 25 °C
| Nom | Alcool benzylique | Permanganate de potassium | Acide benzoïque |
| Formule | C6H5CH2OH | KMnO4 | C6H5CO2H |
| Masse molaire (g ∙ mol–1) | M1 = 108 | M2 = 158 | M3 = 122 |
| Masse volumique (g ∙ mL–1) | ρ1 = 1,0 | ρ3 = 1,3 |
PARTIE A : Réaction de l’acide benzoïque avec l’eau
On introduit une masse m0 d’acide benzoïque dans de l’eau distillée afin d’obtenir un volume V0 = 100 mL de solution. Après dissolution totale, on obtient une solution aqueuse d’acide benzoïque, notée S0, de concentration C0 = 1,0 × 10–2 mol ∙ L–1. Le pH-mètre indique 3,1 pour le pH de cette solution.
A.1. Calculer la masse m0 qu’il faut peser pour préparer la solution S0 . La solution est-elle saturée ?
Calculons la masse $m_0$ d’acide benzoïque :
$$m_0=n_0\times M_3$$
Avec $M_3$ la masse molaire d’acide benzoïque.
Or $n_0=C_0\times V_0$
$$n_0=C_0\times V_0$$
$$m_0=C_0\times V_0\times M_3$$
$$m_0=1,0\times {10}^{-2}\times 100\times {10}^{-3}\times 122$$
$$m_0=0,12\ g$$
La solubilité de l’acide benzoïque est $S_{C_6H_5COOH}=2,4\ g.{\rm L}^{-1}$
Calculons la concentration massique de l’acide benzoïque :
$$c_{m0}=\frac{m_0}{V_0}$$
$$c_{m0}=\frac{0,12}{100\times {10}^{-3}}$$
$$c_{m0}=1,2\ g.{\rm L}^{-1}$$
$c_{m0}<S_{C_6H_5COOH}$ : la solution n’est pas saturée.
A.2. Écrire l’équation de la réaction de l’acide benzoïque avec l’eau.
$$C_6H_5CO_2H_{(aq)}+H_2O_{(l)} \rightleftharpoons C_6H_5CO_{2(aq)}^-+H_3O_{(aq)}^+$$
A.3. Tracer le diagramme de prédominance du couple acide benzoïque/ion benzoate et préciser quelle est l’espèce prédominante dans la solution S0 .
Diagramme de prédominance :
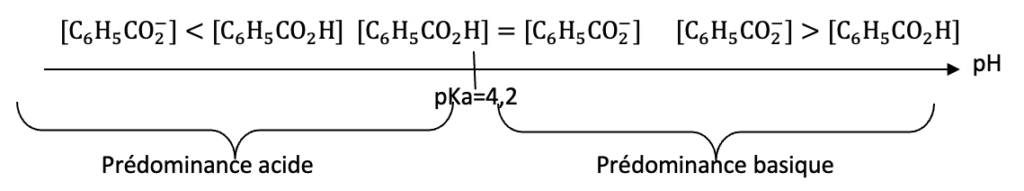
Pour pH=3,1 l’acide benzoïque est prédominant dans la solution S0.
A.4. Compléter le tableau d’avancement de l’ANNEXE À RENDRE AVEC LA COPIE (p18/18) correspondant à cette transformation chimique, en fonction de C0, V0 et xéq, avancement à l’état d’équilibre.
| Équation de la réaction | $C_6H_5CO_2H_{(aq)}$ | $+, H_2O_{(l)}$ | $\rightleftharpoons$ $C_6H_5CO_{2(aq)}^-$ | $H_3O_{(aq)}^+$ | |
| État du système | Avancement (mol) | Quantités de matière (mol) | |||
| État initial | 0 | $n_0=C_0\times V_0$ | Solvant | 0 | 0 |
| État final (à l’équilibre) | $x_{eq}$ | $C_0\times V_0-x_{eq}$ | Solvant | $x_{eq}$ | $x_{eq}$ |
A.5. Calculer l’avancement maximal xmax.
$$C_0\times V_0-x_{max}=0$$
$$x_{max}=c_0\times V_0$$
$$x_{max}=1,0\times {10}^{-2}\times 100\times {10}^{-3}$$
$$x_{max}=1,0\times {10}^{-3}\ mol$$
A.6. Montrer que le taux d’avancement final τ s’écrit $\tau= \frac{[H_3O^+]éq}{c_0} $ , puis le calculer. Ce résultat est-il en accord avec la réponse à la question A.3. ?
$$\tau=\frac{x_{eq}}{x_{max}}$$
Or $x_{max}=C_0\times V_0$
Et $x_{eq}=n_{H_3O^+}^f$
$$x_{eq}=[H_3O^+]_{eq}\times V_0$$
$$\tau=\frac{[H_3O^+]_{eq}\times V_0}{C_0\times V_0}$$
D’où
$$\tau=\frac{[H_3O^+]_{eq}}{C_0}$$
$$\tau=\frac{c^0\times {10}^{-pH}}{C_0}$$
$$\tau=\frac{1\times {10}^{-3,1}}{1,0\times {10}^{-2}}$$
$$\tau=0,079$$
$$\tau=7,9%$$
La réaction est limitée, l’acide benzoïque réagit peu avec l’eau : il est donc dans la solution S0.
Ce résultat est en accord avec la question A.3 car l’acide benzoïque est prédominant dans cette solution
PARTIE B : La synthèse de l’acide benzoïque
L’acide benzoïque peut être préparé par synthèse en laboratoire selon le protocole suivant :
Étape 1 : Formation de l’acide benzoïque
Après avoir versé dans un ballon bicol posé sur un valet et sous la hotte un volume V1 = 2,0 mL d’alcool benzylique C6H5CH2OH puis bouché l’ensemble, on ajoute environ 20 mL de soude à l’aide
d’une éprouvette graduée. On introduit ensuite quelques grains de pierre ponce dans le ballon pour réguler l’ébullition lors du chauffage.
On réalise alors un montage à reflux représenté ci-contre.
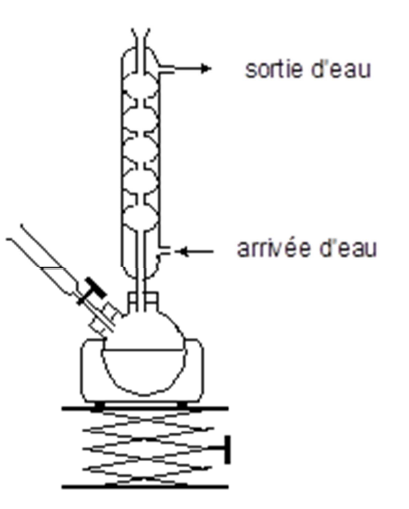
On verse lentement une solution aqueuse de permanganate de potassium (K+(aq)+ MnO4– (aq)) dans le ballon, on porte le mélange à ébullition douce pendant 10 minutes environ. On ajoute quelques millilitres d’éthanol afin d’éliminer le permanganate de potassium, réactif en excès, puis on refroidit le ballon et son mélange.
Étape 2 : Cristallisation de l’acide benzoïque
On filtre le mélange obtenu, puis on recueille un filtrat limpide et incolore. Le filtrat est ensuite versé dans un bécher et refroidi dans la glace.
On ajoute prudemment 8,0 mL d’acide chlorhydrique concentré goutte à goutte et on observe la formation du précipité blanc d’acide benzoïque (C6H5CO2H). On filtre et on rince avec un peu d’eau bien froide.
Sur une coupelle préalablement pesée dont la masse est m = 140,4 g, on récupère les cristaux d’acide benzoïque. Après séchage, on pèse l’ensemble et on trouve une masse m’ = 141,8 g.
B.1. À propos du mode opératoire
B.1.1. Au vu du mode opératoire décrit ci-dessus, sur quels facteurs cinétiques se base-t-on pour réaliser plus rapidement cette synthèse.
Au vu du mode opératoire décrit, on se base sur les facteurs cinétiques suivants :
Température : avec le chauffage à reflux
Concentration : excès de permanganate de potassium.
B.1.2. Préciser quels sont les avantages du chauffage à reflux du mélange réactionnel.
Le chauffage à reflux permet d’accélérer la réaction sans pertes de matières.
B.2. Étude de la réaction de synthèse de l’acide benzoïque
L’oxydation se fait en milieu basique. L’équation de la réaction d’oxydoréduction qui se produit entre l’alcool benzylique et les ions permanganate s’écrit :
3 C6H5CH2OH(l) + 4 MnO4–(aq) → 3 C6H5CO–(aq) + 4 H2O(l) + 4 MnO2(s)+ HO–(aq)
B.2.1. Déterminer la quantité de matière n1 d’alcool benzylique contenu dans la prise d’essai de 2,0 mL.
$$n_1=\frac{m_1}{M_1}$$
$$\rho_1=\frac{m_1}{V_1}$$
$$m_1=\rho_1\times V_1$$
$$n_1=\frac{\rho_1\times V_1}{M_1}$$
$$n_1=\frac{1,0\times 2,0}{108}$$
$$n_1=1,9\times {10}^{-2}\ mol$$
B.2.2. Lors de la cristallisation, le passage de l’ion benzoate à l’acide benzoïque se fait selon l’équation chimique :
C6H5CO2–(aq) + H3O+(aq) ⇄ C6H5CO2H(s) + H2O(l)
Calculer la quantité de matière théorique d’acide benzoïque que l’on pourrait obtenir si la transformation était totale, sachant que l’alcool benzylique est le réactif limitant.
1ère méthode sans tableau d’avancement :
$$C_6H_5CO_{2(aq)}^-+H_3O_{(aq)}^+\rightleftharpoons C_6H_5CO_2H_{(aq)}+H_2O_{(l)}$$
Si la réaction est totale :
$$n_{C_6H_5CO_2H}^{th}=n_{C_6H_5CO_2^-}$$
Or d’après la réaction chimique :
$3\ C_6H_5CH_2OH_{(l)}+4,MnO_{4(aq)}^-\rightleftharpoons 3\ C_6H_5CO_{2(aq)}^-+4\ H_2O_{(l)}+4\ MnO_{2(s)}+{\rm HO}_{(aq)}^-$
Le réactif limitant est l’alcool benzylique.
Si la réaction est totale :
$$\frac{n_{C_6H_5CO_2^-}}{3}=\frac{n_{C_6H_5CH_2OH}^i}{3}$$
$$n_{C_6H_5CO_2^-}=n_{C_6H_5CH_2OH}^i$$
D’où
$$n_{C_6H_5CO_2H}^{th}=n_{C_6H_5CO_2^-}=n_{C_6H_5CH_2OH}^i=n_1=1,9\times {10}^{-2}\ mol$$
2nd méthode avec tableau d’avancement :
| Équation de la réaction | $C_6H_5CO_{2(aq)}^-$ | $+H_3O_{(aq)}^+$ | $\rightleftharpoons C_6H_5CO_2H_{(aq)}$ | $+H_2O_{(l)}$ | |
| État du système | Avancement (mol) | Quantités de matière (mol) | |||
| État initial | 0 | $n_{C_6H_5CO_2^-}$ | Excès | 0 | 0 |
| État final (réaction considérée totale) | $x_{max}$ | $n_{C_6H_5CO_2^-}-x_{max}=0$ | Excès | $x_{max}=n_{C_6H_5CO_2H}^{th}$ | $x_{max}$ |
Si la réaction est totale :
$$n_{C_6H_5CO_2^-}-x_{max}=0$$
$$x_{max}=n_{C_6H_5CO_2^-}$$
$$x_{max}=n_{C_6H_5CO_2H}^{th}$$
D’où
$$n_{C_6H_5CO_2H}^{th}=n_{C_6H_5CO_2^-}$$
Or d’après la réaction chimique :
| Équation de la réaction | $3\ C_6H_5CH_2OH_{(l)}$ | $+4,MnO_{4(aq)}^-$ | $\rightleftharpoons 3 C_6H_5CO_{2(aq)}^-$ | $+4\ H_2O_{(l)}$ | $+4\ MnO_{2(s)}$ | $HO_{(aq)}^-$ | |
| État du système | Avancement (mol) | Quantités de matière (mol) | |||||
| État initial | 0 | $n_{C_6H_5CH_2OH}^i$ | Excès | 0 | 0 | 0 | 0 |
| État final (réaction considérée totale) | $x_{max}$ | $n_{C_6H_5CH_2OH}^i-3x_{max}=0$ | Excès | $3x_{max}=n_{C_6H_5CO_2^-}$ | $4x_{max}$ | $4x_{max}$ | $x_{max}$ |
Le réactif limitant est l’alcool benzylique.
Si la réaction est totale :
$$n_{C_6H_5CH_2OH}^i-3,x_{max}=0$$
$$x_{max}=\frac{n_{C_6H_5CH_2OH}^i}{3}$$
$$3,x_{max}=n_{C_6H_5CO_2^-}$$
$$x_{max}=\frac{n_{C_6H_5CO_2^-}}{3}$$
D’où
$$\frac{n_{C_6H_5CO_2^-}}{3}=\frac{n_{C_6H_5CH_2OH}^i}{3}$$
$$n_{C_6H_5CO_2^-}=n_{C_6H_5CH_2OH}^i$$
D’où
$$n_{C_6H_5CO_2H}^{th}=n_{C_6H_5CO_2^-}=n_{C_6H_5CH_2OH}^i=n_1=1,9\times {10}^{-2}\ mol$$
B.2.3. En déduire le rendement r de la synthèse
$$r=\frac{n_{C_6H_5CO_2H}^{experimental}}{n_{C_6H_5CO_2H}^{th}}$$
Or
$$n_{C_6H_5CO_2H}^{experimental}=\frac{n_{C_6H_5CO_2H}^{experimental}}{M_3}$$
$$n_{C_6H_5CO_2H}^{experimental}=\frac{m’-m}{M_3}$$
$$n_{C_6H_5CO_2H}^{experimental}=\frac{141,8-140,4}{122}$$
$$n_{C_6H_5CO_2H}^{experimental}=1,1\times {10}^{-2}\ mol$$
D’où
$$r=\frac{1,1\times {10}^{-2}}{1,9\times {10}^{-2}}$$
$$r=0,58$$
$$r=58%$$
Le rendement de la synthèse est de 58%.
