Polynésie 2025 Sujet 2
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°25-PYCJ2PO1
Sujet et corrigé
EXERCICE 2 – ÉTUDE D’UN PRODUIT MÉNAGER « FAIT MAISON » (5 POINTS)
Les tâches ménagères nécessitent l’usage de produits d’entretien. Pourtant, ces produits ménagers ne sont pas sans risque sanitaire. Il existe de nombreuses alternatives à l’eau de Javel ou autres produits qui, peuvent engendrer la formation d’espèces chimiques toxiques. Pour fabriquer un spray nettoyant multi-usages écologique et économique, on peut réaliser un mélange de deux produits ménagers simples : le vinaigre blanc et le bicarbonate de soude. La mousse obtenue permet de décoller les impuretés présentes sur une surface.
L’objectif de cet exercice est d’étudier la transformation chimique entre le vinaigre et le bicarbonate de soude.
Le vinaigre blanc.
Le vinaigre blanc peut être utilisé en tant que détartrant, désinfectant et anticalcaire. Ce liquide incolore est composé d’eau et d’acide éthanoïque obtenu la plupart du temps à partir de sucre de betterave.
Pour fabriquer un produit ménager, il est conseillé d’utiliser du vinaigre blanc à 8,0 % en masse.
Données :
- masse volumique du vinaigre : ρ = 1,01 g∙mL–1 ;
- masse molaire de l’acide éthanoïque : M = 60 g∙mol–1 ;
- concentration standard : c° = 1,0 mol·L–1.
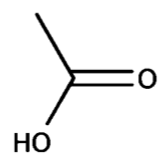
Figure 1. Formule topologique de l’acide éthanoïque.
Q1. À partir de la formule topologique donnée sur la figure 1, représenter la formule semi-développée de l’acide éthanoïque.
Formule topologique de l’acide éthanoïque :
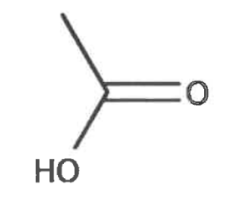
Formule semi-développée de l’acide éthanoïque :
Q2. À l’aide des données présentes dans le texte descriptif du vinaigre blanc ci-dessus, montrer que la quantité de matière en acide éthanoïque n contenue dans un volume V égal à 1,0 L de vinaigre blanc à 8,0 % en masse est voisine de 1,3 mol.
$$n_{acide\ ethanoique}=\frac{m_{acide\ ethanoique}}{M_{acide\ ethanoique}}$$
Or le titre massique (pourcentage) est défini par :
$$t_m=\frac{m_{acide\ ethanoique}}{m_{solution}}$$
D’ou
$$m_{acide\ ethanoique}=t_m\times m_{solution}$$
Ainsi :
$$n_{acide\ ethanoique}=\frac{t_m\times m_{solution}}{M_{acide\ ethanoique}}$$
Or
$$\rho_{solution}=\frac{m_{solution}}{V_{Solution}}$$
$$\frac{m_{solution}}{V_{Solution}}=\rho_{solution}$$
$$m_{solution}=\rho_{solution}\times V_{Solution}$$
Ainsi :
$$n_{acide\ ethanoique}=\frac{t_m\times\rho_{solution}\times V_{Solution}}{M_{acide\ ethanoique}}$$
$$n_{acide\ ethanoique}=\frac{\frac{8,0}{100}\times1,01\times1,0\times{10}^3}{60}$$
$$n_{acide\ ethanoique}=1,3\ mol$$
Ainsi, la quantité de matière en acide éthanoïque est de 1,3 mol.
Dans la suite de l’exercice, on utilisera la notation AH(aq) pour représenter l’acide
éthanoïque et A–(aq) pour l’ion éthanoate. L’acide éthanoïque est un acide faible. On désire modéliser la transformation entre l’acide éthanoïque contenu dans le vinaigre et l’eau.
Q3. Écrire l’équation de la réaction modélisant cette transformation chimique.
$$AH(aq)+H_2O(l)\rightleftarrows A^-(aq)+H_3O^+(aq)$$
Q4. Donner l’expression littérale de la constante d’acidité KA du couple acide éthanoïque /ion éthanoate, noté AH(aq)/A–(aq), en fonction de la concentration standard c° et des concentrations en quantité de matière des espèces H3O+, AH et A– observées à l’équilibre.
$$K_A=\frac{\left[A^-\right]{eq}\times\left[H_3O^+\right]{eq}}{\left[AH\right]_{eq}\times c^0}$$
On donne, figure 2, le diagramme de distribution du couple acide éthanoïque / ion éthanoate.
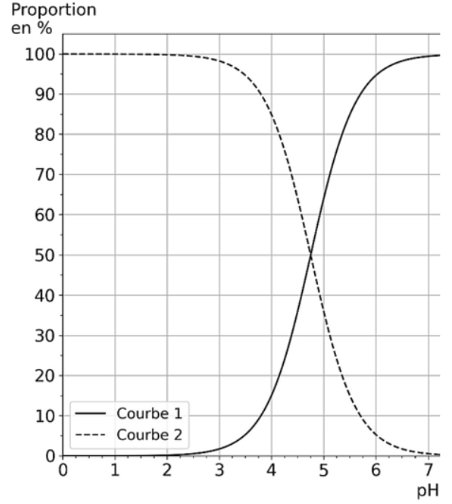
Figure 2. Diagramme de distribution du couple acide éthanoïque/ion éthanoate.
Q5. À l’aide du diagramme de la figure 2, déterminer la valeur du pKA du couple acide éthanoïque / ion éthanoate. Justifier votre réponse.
$$K_A=\frac{\left[A^-\right]{eq}\times\left[H_3O^+\right]{eq}}{\left[AH\right]{eq}\times c^0}$$
$$-log\left(K_A\right)=-log\left(\frac{\left[A^-\right]{eq}\times\left[H_3O^+\right]{eq}}{\left[AH\right]{eq}\times c^0}\right)$$
$$-log\left(K_A\right)=-log\left(\frac{\left[A^-\right]{eq}}{\left[AH\right]{eq}}\times\frac{\left[H_3O^+\right]{eq}}{c^0}\right)$$
$$-log\left(K_A\right)=-log\left(\frac{\left[A^-\right]{eq}}{\left[AH\right]{eq}}\right)-log\left(\frac{\left[H_3O^+\right]{eq}}{c^0}\right)$$
$${\rm pK}A=-log\left(\frac{\left[A^-\right]{eq}}{\left[AH\right]{eq}}\right)+pH$$
$${\rm pK}A+log\left(\frac{\left[A^-\right]{eq}}{\left[AH\right]{eq}}\right)=pH$$
$$pH={\rm pK}A+log\left(\frac{\left[A^-\right]{eq}}{\left[AH\right]_{eq}}\right)$$
Lorsque $\left[A^-\right]{eq}=\left[AH\right]{eq}$
$$pH={\rm pK}_A+log\left(1\right)$$
$$pH={\rm pK}_A$$
Graphiquement $\left[A^-\right]{eq}=\left[AH\right]{eq}$ pour $pH=4,75$
Ainsi, ${\rm pK}_A=4,75$
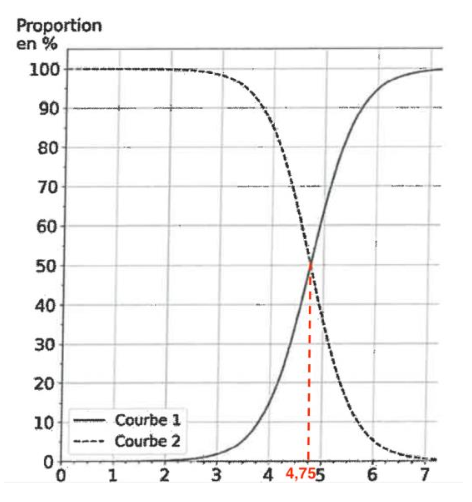
Q6. Attribuer chaque courbe du diagramme de la figure 2 à l’espèce, AH(aq) ou A–(aq), qui lui correspond. Justifier votre réponse.
Lorsque $pH<{\rm pK}_A$, la forme acide prédomine.Pour $pH<{\rm pK}_A$ la courbe 2 est au dessus de la courbe 1.
Ainsi, la courbe 2 corespond à l’espece AH.
Lorsque $pH>{\rm pK}_A$, la forme basique prédomine.Pour $pH>{\rm pK}_A$ la courbe 1 est au dessus de la courbe 2. Ainsi, la courbe 1 corespond à l’espèce A–.
Réaction entre l’acide éthanoïque et le bicarbonate de soude.
Le bicarbonate de soude est un solide ionique de formule brute NaHCO3 et de masse molaire M’ = 84 g∙mol–1. Lorsqu’il est dissous en solution aqueuse les ions présents en solution sont les ions sodium Na+(aq) et les ions hydrogénocarbonate HCO3–(aq). Le couple acide/base associé aux ions hydrogénocarbonate pris en compte par la suite est CO2(aq) / HCO3–(aq).
On souhaite modéliser la transformation chimique entre l’acide éthanoïque AH(aq) et les ions hydrogénocarbonate.
Q7. Écrire l’équation de la réaction modélisant cette transformation chimique. On suppose que cette réaction est totale.
Remarque : le sujet nous donne le couple acide base ${\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$. Or pour passer de la forme acide à la forme basique on enlève un ion H+ ce qui n’est pas le cas ici. De plus en faisant réagir l’acide éthanoïque $AH(aq)$ et les ions hydrogénocarbonate (avec le couple donné) on obtiendrait cette réaction :
$$AH(aq)+{\rm HCO}_3^-(aq)\rightarrow A^-(aq)+{\rm CO}_2(aq)$$
Cette réaction n’est pas équilibrée (avec les atomes d’hydrogène et d’oxygène). Il y a une erreur sur le sujet.
Le bon couple est $H_2O,{\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$.
La réaction entre l’acide éthanoïque $AH(aq)$ et les ions hydrogénocarbonate est :
$$AH(aq)+{\rm HCO}_3^-(aq)\rightarrow A^-(aq)+H_2O,{\rm CO}_2(aq)$$
Q8. Le texte introductif fait état de la formation de mousse lors de la réaction entre l’acide éthanoïque et le bicarbonate de soude. Expliquer ce phénomène.
La réaction entre l’acide éthanoïque et le bicarbonate produit du CO2 (voir réaction de la question précédente). Le CO2 est un gaz. La production de ce gaz est responsable de la formation de mousse.
Dans un erlenmeyer, on introduit un volume Vvinaigre = 100 mL de vinaigre à 8,0 % en masse et on ajoute une quantité de matière n’ = 0,20 mol d’ion hydrogénocarbonate en solution. La transformation chimique qui se produit dans l’erlenmeyer produit un gaz que l’on recueille par déplacement d’eau. Le gaz recueilli est considéré comme un gaz parfait. Dans les conditions de l’expérience, la valeur de la pression dans le tube est
P = 1020 hPa et la valeur de la température est θ = 25 °C.
Données :
- la température exprimée en kelvin T se calcule à partir de la température exprimée en degré Celsius θ par T = θ + 273,15 ;
- la valeur de la constante des gaz parfaits est R = 8,314 Pa∙m3∙mol–1∙K–1.
Pour la question suivante, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Q9. À l’aide de l’équation d’état du gaz parfait, déterminer le volume Vg de gaz libéré par la réaction chimique décrite précédemment.
$$AH(aq)+{\rm HCO}_3^-(aq)\rightarrow A^-(aq)+H_2O,{\rm CO}_2(aq)$$
Calculons les quantités de matières des réactifs :
$$n_{acide\ ethanoique}=\frac{t_m\times\rho_{solution}\times V_{Solution}}{M_{acide\ ethanoique}}$$
(Voir formule question 2)
$$n_{acide\ ethanoique}=\frac{\frac{8,0}{100}\times1,01\times100}{60}$$
$$n_{acide\ ethanoique}=0,13\ mol$$
Si on n’avait pas obtenu la formule on aurait utilisé la relation de proportionnalité :
| 1,0 L | 1,3 mol |
| 100 mL | $n_{acide\ ethanoique}$ |
$$n_{acide\ ethanoique}=\frac{100\times{10}^{-3}\times1,3}{1,0}$$
$$n_{acide\ ethanoique}=0,13\ mol$$
D’après l’énoncé, la quantité de matière initiale d’ion hydrogénocarbonate est :
$$n\prime=0,20\ mol$$
Méthode 1 (sans tableau d’avancement) :
$$x_{max\ 1}=\frac{n_{acide\ ethanoique}}{1}$$
$$x_{max\ 1}=\frac{0,13}{1}$$
$$x_{max\ 1}=0,13\ mol$$
$$x_{max\ 2}=\frac{n\prime}{1}$$
$$x_{max\ 2}=\frac{0,20}{1}$$
$$x_{max\ 2}=0,20\ mol$$
$$x_{max\ 1}<x_{max\ 2}$$
$$x_{max}=x_{max\ 1}=0,13\ mol$$
$$n_{{\rm CO}2}^{produit}=x{max}$$
$$n_{{\rm CO}_2}^{produit}=0,13\ mol$$
Méthode 2 (avec tableau d’avancement) :
| Équation | $AH(aq)$ | $+{\rm HCO}_3^-(aq) | $\rightarrow A^-(aq)$ | $+H_2O,{\rm CO}_2(aq)$ |
| État initial | 0,13 | 0,20 | 0 | 0 |
| État intermédiaire | 0,13-x | 0,20-x | x | x |
| État final | 0,13-xf | 0,20-xf | xf | xf |
$$0,13-x_{max\ 1}=0$$
$$-x_{max\ 1}=-0,13$$
$$x_{max\ 1}=0,13\ mol$$
$$0,20-x_{max\ 2}=0$$
$$-x_{max\ 2}=-0,20$$
$$x_{max\ 2}=0,20\ mol$$
$$x_{max\ 1}<x_{max\ 2}$$
$$x_{max}=x_{max\ 1}=0,13\ mol$$
$$n_{{\rm CO}2}^{produit}=x_f=x{max} ((car réaction totale)$$
$$n_{{\rm CO}_2}^{produit}=0,13\ mol$$
D’après l’équation des gaz parfaits :
$$PV=nRT$$
$$PV_g=n_{{\rm CO}2}^{produit}RT$$
$$V_g=\frac{n{{\rm CO}_2}^{produit}RT}{P}$$
$$V_g=\frac{0,13\times8,314\times\left(25+273,15\right)}{1020\times{10}^2}$$
$$V_g=3,2\times{10}^{-3}\ m^3$$
$$V_g=3,2\times{10}^{-6}\ L$$
Le volume de gaz Vg libéré par la réaction chimique décrite précédemment est $V_g=3,2\times{10}^{-3}\ m^3$.
