Bac Métropole Septembre 2021 Sujet 2
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ2ME3

Photographie de piles AA
de capacité 2800 mAh
Mots-clés : piles ; évolution d’un système
Chaque année en France, 1,3 milliard de piles sont vendues dans le commerce. Petits réservoirs d’énergie, elles constituent des objets indispensables au quotidien. L’objectif de cet exercice est d’étudier le fonctionnement d’une pile réalisée au laboratoire et de comparer sa capacité électrique à celle d’une pile AA vendue dans le commerce, photographiée ci-contre.
Données :
- masses molaires :
| espèce chimique | Aℓ | Aℓ2(SO4)3 |
| masse molaire en g·mol–1 | 27,0 | 342,15 |
Photographie de piles AA de capacité 2800 mAh
- couples oxydants-réducteurs : (Cu2+(aq) / Cu(s)) et (Aℓ3+(aq) / Aℓ(s)) ;
- charge élémentaire : e = 1,602×10–19 C ;
- constante d’Avogadro : NA = 6,022×1023 mol–1 ;
- 1 mAh = 3,60 C.
Pour réaliser la pile étudiée, deux solutions aqueuses sont préparées : une de sulfate d’aluminium notée S, et une de sulfate de cuivre (Cu2+(aq) ; SO42–(aq)), notée S’, toutes les deux sont à la concentration en soluté apporté de C = 0,100 mol·L-1. Le sulfate d’aluminium est un solide de formule Aℓ2(SO4)3(s), disponible sous forme de poudre.
1. Rédiger le protocole expérimental précis à mettre en œuvre pour préparer 50,0 mL de la solution S à partir du sulfate d’aluminium en poudre.
2. Calculer les concentrations en quantité de matière en ions aluminium Aℓ3+(aq) et en ion sulfate SO42–(aq) dans la solution S.
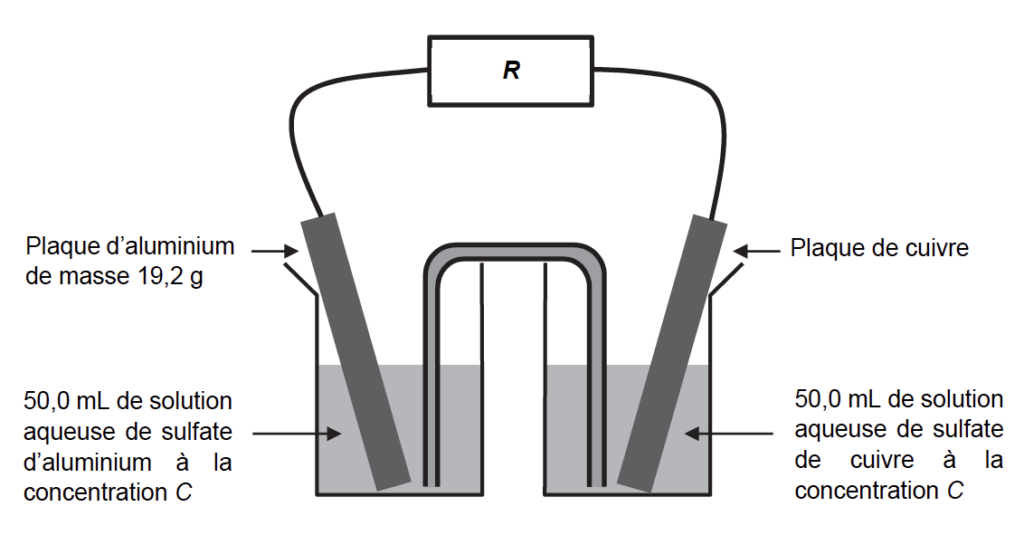
La pile est assemblée selon le schéma de la figure 1 représenté ci-dessous :
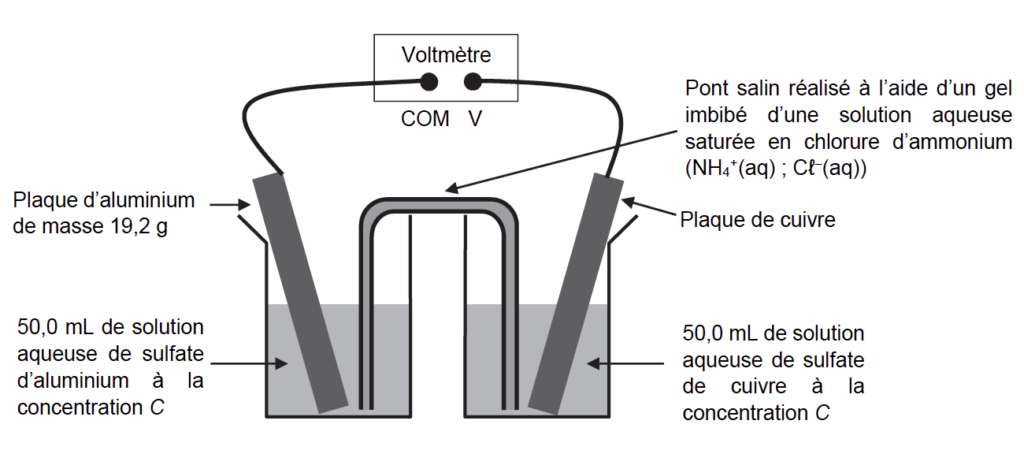
Pour déterminer la polarité de la pile ainsi constituée, un voltmètre est relié aux deux plaques métalliques. La borne COM du voltmètre est reliée à la plaque d’aluminium. Dans ces conditions, la tension mesurée aux bornes de la pile vaut U = 0,92 V.
3. Déterminer le pôle positif de la pile à l’aide du montage expérimental de la figure 1.
Dans la suite de l’étude, le voltmètre est retiré puis est remplacé par un conducteur ohmique de résistance R.
4. Compléter le schéma fourni EN ANNEXE À RENDRE AVEC LA COPIE en y indiquant la polarité de la pile, le sens du courant électrique et le sens de circulation des porteurs de charge dans la pile et à l’extérieur de la pile lors de son fonctionnement.
5. Établir les équations modélisant les réactions aux électrodes lors du fonctionnement de la pile. En déduire que l’équation de la réaction modélisant le fonctionnement de la pile s’écrit :
3Cu2+(aq) + 2Aℓ(s) ⇌ 3Cu(s) + 2Aℓ3+(aq)
La constante d’équilibre K associée à cette réaction a pour valeur K ≈ 10200, à 25 °C.
6. Montrer que la valeur initiale du quotient de réaction du système vaut Qr = 40. Conclure quant à l’évolution du système.
7. Capacité électrique de la pile.
7.1. Déterminer quel est le réactif limitant.
7.2. Déterminer la capacité électrique Q de la pile du laboratoire, puis la comparer aux piles commerciales de type « AA ».
8. Identifier un paramètre de la composition de la pile de laboratoire qu’il faudrait faire évoluer pour augmenter la capacité électrique de la pile, en précisant comment ce paramètre doit évoluer. Justifier.
ANNEXE À RENDRE AVEC LA COPIE