Centres étrangers 2025 Sujet 2
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ2G11
Sujet et corrigé
EXERCICE 1 : FABRICATION ET AROMATISATION D’UN YAOURT MAISON (9 POINTS)
Le lait est un aliment d’un grand intérêt nutritionnel dont la difficulté de conservation a été contournée depuis longtemps grâce à la fermentation lactique. Celle-ci fait intervenir des ferments et conduit à la transformation chimique du glucose en acide lactique. L’acide lactique, naturellement présent dans le lait voit son taux augmenter. Cette augmentation est responsable de la prise en masse du lait pour former un yaourt.
La yaourtière permet un chauffage doux et progressif du lait additionné des ferments afin de stimuler le processus de fermentation lactique ; ainsi, il suffira de huit heures environ pour fabriquer des yaourts.
Lors de la fermentation lactique, la multiplication des bactéries permettant la formation d’acide lactique est efficace entre 37,5°C et 45,0°C. En cas de température trop basse, en huit heures, le yaourt ne prendra pas. À l’inverse, une température trop élevée le rendra trop acide.
On propose dans cet exercice de vérifier les conditions de fabrication d’un yaourt « fait maison » à la yaourtière et de l’aromatiser avec un arôme d’ananas synthétisé au laboratoire.
Partie A : Fabrication d’un yaourt Données :
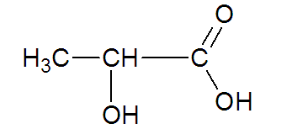
– Informations à propos de l’acide lactique :
Formule semi-développée : Masse molaire : M = 90,1 g.mol-1
– Dans un récipient équipé d’un bec verseur, je verse 1L de lait entier UHT* à température ambiante. Puis j’ajoute le contenu d’un sachet de ferments et je mélange très soigneusement.
– Je verse le mélange dans les pots, puis je les place ouverts dans ma yaourtière.
– Je ferme la yaourtière, puis je la mets en route suivant son mode d’emploi.
– À la fin du cycle, je mets les pots au réfrigérateur environ 2 heures avant de les déguster.
* Lait UHT : « upérisation à haute température », c’est un procédé qui consiste à tuer tous les micro-organismes et à neutraliser les enzymes éventuellement présentes naturellement dans le lait en le chauffant à une température très élevée.
Document 1. Exemple de recette maison à la yaourtière
1. Étude de la cinétique de la fermentation lactique
La transformation chimique du glucose en acide lactique correspondant à la fermentation lactique est modélisée par une réaction d’équation : $C_6H_{12}O_6{(aq)} \rightarrow 2\ C_3H_6O_3{(aq)}$
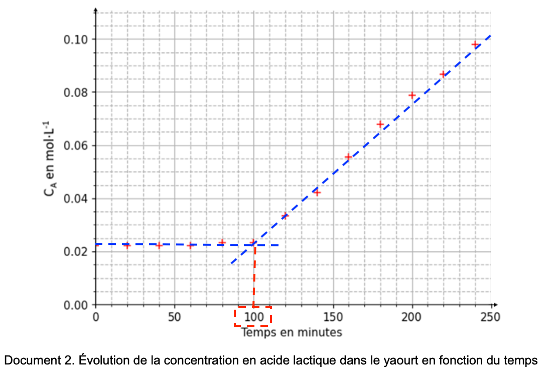
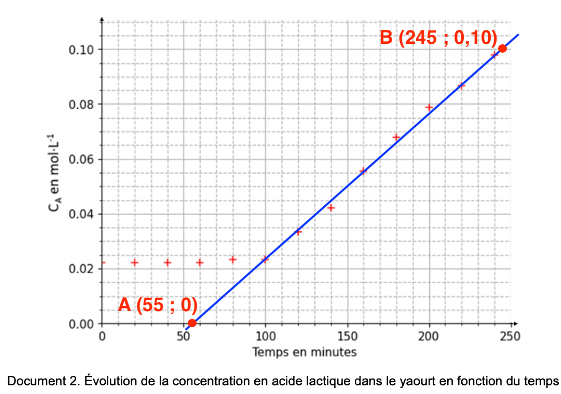
Pendant les quatre premières heures de fabrication, on contrôle la concentration CA en quantité de matière d’acide lactique formé dans le yaourt, on obtient la courbe ci-dessous. Les ferments sont introduits à t = 0 s.
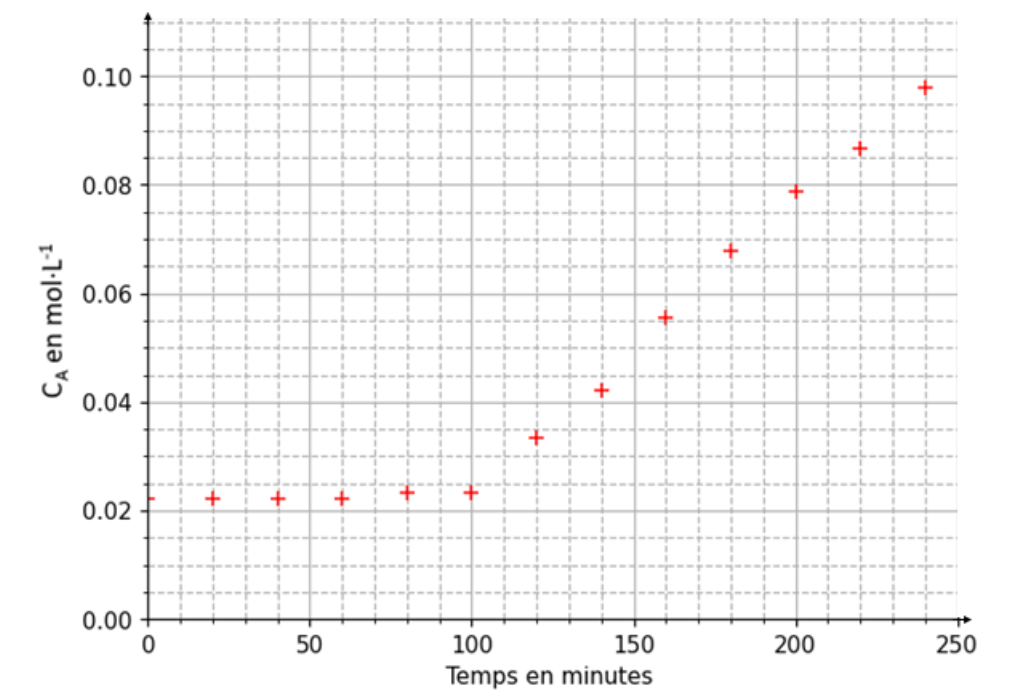
Document 2. Évolution de la concentration en acide lactique dans le yaourt en fonction du temps
Q.1. Justifier, à l’aide du texte en introduction de l’exercice, que l’utilisation de la yaourtière favorise la fermentation lactique en indiquant le facteur cinétique mis en jeu.
D’après le texte en introduction de l’exercice : « La yaourtière permet un chauffage doux et progressif du lait additionné des ferments afin de stimuler le processus de fermentation lactique ».
En augmentant la température, la yaourtière augmente la vitesse de réaction de fermentation.
Ainsi, l’utilisation de la yaourtière favorise la fermentation lactique. Le facteur cinétique mis en jeu est la température.
Q.2. Identifier le temps marquant le début de la fermentation.
D’après le texte en introduction de l’exercice : « la fermentation lactique … fait intervenir des ferments et conduit à la transformation chimique du glucose en acide lactique. L’acide lactique, naturellement présent dans le lait voit son taux augmenter. »
Le temps marquant le début de la fermentation est le moment ou la concentration en acide lactique augmente.
Graphiquement, Le temps marquant le début de la fermentation est t=100 min.
Q.3. Proposer une explication à la présence d’acide lactique à l’instant $t = 0$.
D’après le texte en introduction de l’exercice : « L’acide lactique, naturellement présent dans le lait. »
Explication à la présence d’acide lactique à l’instant t = 0 : Il est naturellement présent dans le lait.
Q.4. Calculer la valeur de $v\_{\mathrm{app}}$, la vitesse volumique d’apparition de l’acide lactique lorsque la fermentation a commencé, en expliquant la démarche suivie.
$$v_{app}=\frac{d\left[A\right]_{(t)}}{dt}$$
La dérivée se calcul en trouvant le coefficient directeur de la tangente en un point de la courbe.
Par exemple pour t=600h :
$$k=\frac{y_B-y_A}{x_B-x_A}$$
$$k=\frac{0,10-0}{245-55}$$
$$k=5,3\times {10}^{-4}mol.L^{-1}.min^{-1}$$
$$v_{app}=\frac{d\left[A\right]_{(t)}}{dt}=k=5,3\times {10}^{-4}mol.L^{-1}.min^{-1}$$
2. Caractérisation du yaourt maison
Le degré Dornic permet de quantifier la concentration en masse d’acide lactique présente dans les produits laitiers.
Un degré Dornic (noté °D) correspond à 0,1 g d’acide lactique par litre de yaourt.
Un yaourt ferme est caractérisé par un degré Dornic compris entre 80 et 100 °D et un yaourt brassé par un degré Dornic compris entre 100 et 120 °D.
Pour déterminer la fermeté d’un yaourt, on procède au titrage conductimétrique de l’acide lactique, noté HA(aq), contenu dans un volume VA = 10,0 mL de yaourt par une solution d’hydroxyde de sodium de concentration en quantité de matière CB = 0,150 mol·L-1.
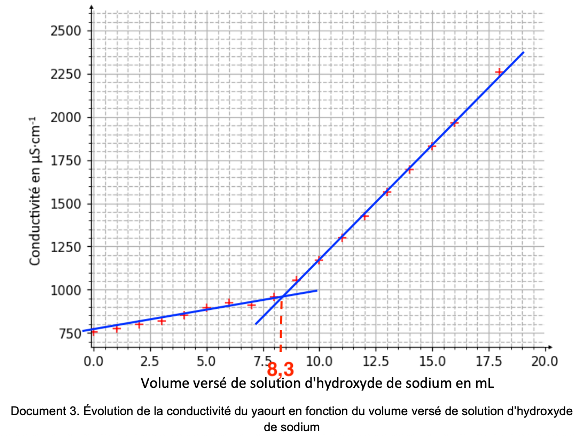
Les résultats expérimentaux du titrage permettent d’obtenir la courbe du document 3. La réaction support du titrage est : HA(aq) + HO–(aq) → A–(aq) + H2O(l).
Volume versé de solution d’hydroxyde de sodium en mL
Document 3. Évolution de la conductivité du yaourt en fonction du volume versé de solution d’hydroxyde de sodium
Q.5. Déterminer si le yaourt testé est ferme ou brassé.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite donc d’être correctement présentée.
D’après le sujet :
« Un yaourt ferme est caractérisé par un degré Dornic compris entre 80 et 100 °D et un yaourt brassé par un degré Dornic compris entre 100 et 120 °D. »
« Un degré Dornic (noté °D) correspond à 0,1 g d’acide lactique par litre de yaourt. »
Pour déterminer si le yaourt testé est ferme ou brassé, il faut déterminer son degré Dornic donc sa masse d’acide lactique par litre de yaourt.
L’équation de la réaction support du titrage est :
$$HA\left(aq\right)+{\rm HO}^-\left(aq\right)\rightarrow A^-\left(aq\right)+\ H_2O(l)$$ A l’équivalence :
$$\frac{n_{HA}^i}{1}=\frac{n_{{\rm HO}^-}^{eq}}{1}$$
$$C_A\times V_A=C_B\times V_E$$
$$C_A=\frac{C_B\times V_E}{V_A}$$
On détermine graphiquement le volume à l’équivalence à l’intersection des droites de l’évolution de la conductivité : $V_E=8,3\ mL$
$$C_A=\frac{C_B\times V_E}{V_A}$$
$$C_A=\frac{0,150\times 8,3\times {10}^{-3}}{10,0\times {10}^{-3}}$$
$$C_A=1,25\times {10}^{-1}\ mol.L^{-1}$$
Calculons la concentration massique en acide lactique dans le lait :
$$C_m=C_A\times M$$
$$C_m=1,25\times {10}^{-1}\times 90,1$$
$$C_m=11,2\ g.L^{-1}$$
Déterminons le nombre de degré Dornic du lait.
Un degré Dornic (1 °D) correspond à 0,1 g d’acide lactique par litre de lait.
| 1 °D | 0,1 g.L-1 |
| N | 11,2 g.L-1 |
$$N=\frac{11,2\times 1}{0,1}$$
$$N=112 °D$$
D’après l’énoncé : « Un yaourt ferme est caractérisé par un degré Dornic compris entre 80 et 100 °D et un yaourt brassé par un degré Dornic compris entre 100 et 120 °D. »
Le yaourt testé à un degré Dornic de 112 donc compris entre 100 et 120 °D
Ainsi, le yaourt testé est brassé.
Partie B : Aromatiser le yaourt avec un arôme d’ananas
L’arôme d’ananas que l’on utilise pour aromatiser le yaourt est constitué principalement de butanoate d’éthyle synthétisé à partir d’acide butanoïque :
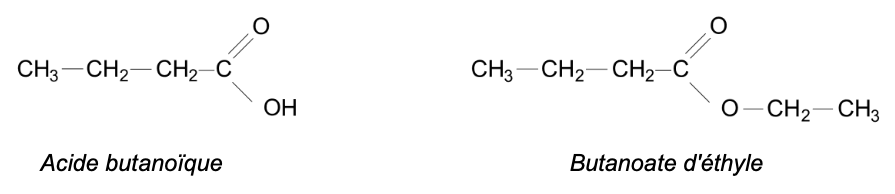
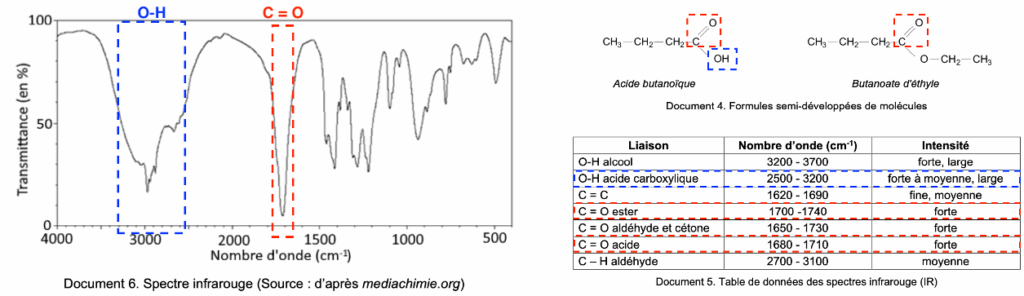
Document 4. Formules semi-développées de molécules
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H alcool | 3200 – 3700 | forte, large |
| O-H acide carboxylique | 2500 – 3200 | forte à moyenne, large |
| C = C | 1620 – 1690 | fine, moyenne |
| C = O ester | 1700 -1740 | forte |
| C = O aldéhyde et cétone | 1650 – 1730 | forte |
| C = O acide | 1680 – 1710 | forte |
| C – H aldéhyde | 2700 – 3100 | moyenne |
Document 5. Table de données des spectres infrarouge (IR)
1. Étude des espèces chimiques de la synthèse
Q.6. Représenter la formule topologique du butanoate d’éthyle.
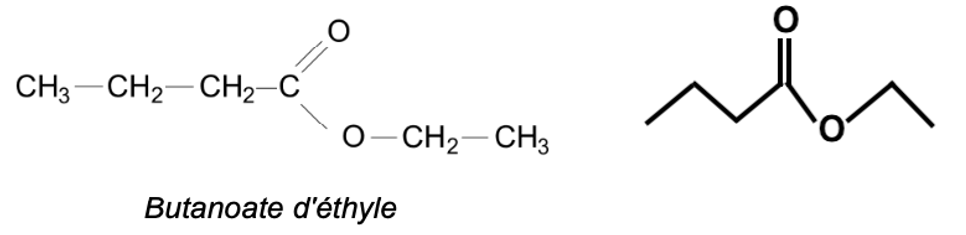
Q.7. Sur la formule topologique, entourer le groupe caractéristique de cette molécule et nommer la famille fonctionnelle correspondante.
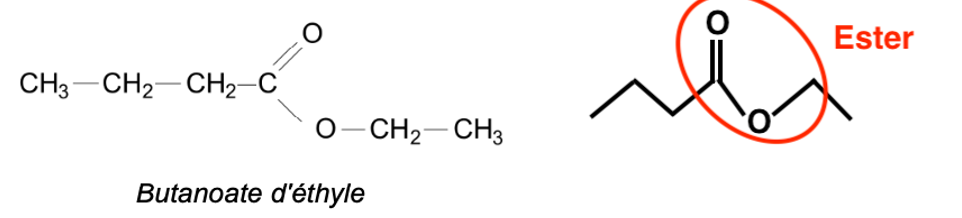
Q.8. Déterminer la molécule qui, parmi celles présentées dans le document 4, correspond au spectre infrarouge ci-dessous. Justifier.
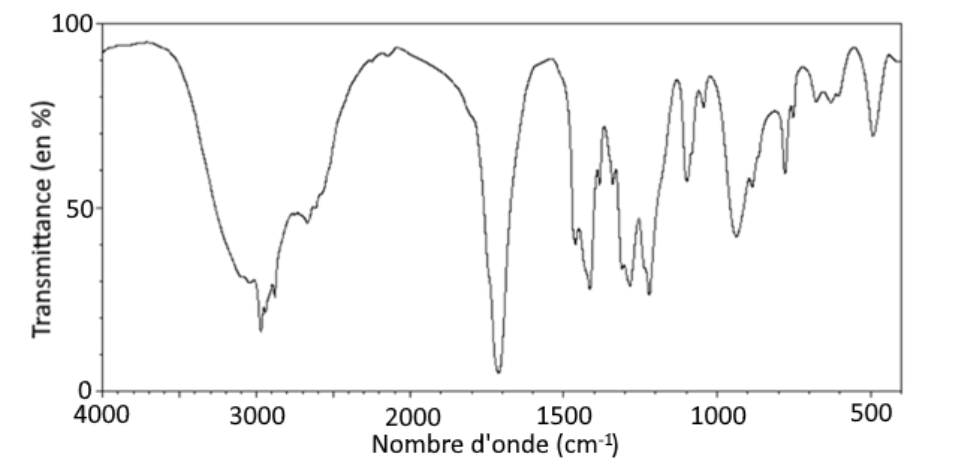
Document 6. Spectre infrarouge (Source : d’après mediachimie.org)
Le spectre d’absorption IR de l’échantillon présente :
- Une bande correspondant à une liaison C = O acide carboxylique (nombre d’onde compris entre 1680 et 1710 cm-1)
- Une bande correspondant à une liaison O-H acide carboxylique (nombre d’onde compris entre 2500 et 3200 cm-1)
Ces deux liaisons sont caractéristiques de la famille des acides carboxylique.
Ainsi, le spectre correspond à celui de l’acide butanoïque.
2. Synthèse de l’arôme d’ananas
La synthèse de l’arôme d’ananas correspond à la transformation modélisée par la réaction dont l’équation est :
$C_4H_8O_2{(l)} + C_2H_6O{(l)} \longrightarrow C_6H_{12}O_2{(l)} + H_2O{(l)}$
acide butanoïque éthanol butanoate d’éthyle
Son protocole est le suivant :
Étape 1 : Introduire dans un ballon 40,0 mL d’éthanol (réactif en excès), 40,0 mL d’acide butanoïque et 1,0 mL d’acide sulfurique concentré.
Étape 2 : Chauffer à reflux pendant 30 min.
Étape 3 : Refroidir jusqu’à température ambiante puis verser le contenu dans une ampoule à décanter.
Étape 4 : Ajouter 100 mL d’eau salée puis 30 mL de cyclohexane.
Étape 5 : Isoler la phase organique.
Étape 6 : Éliminer le solvant par distillation. On obtient ainsi 33,7 g d’ester.
| Solvant | Eau | Eau salée | Éthanol | Cyclohexane |
| Solubilité du butanoate d’éthyle | Faible | Très faible | Bonne | Moyenne |
| Masse volumique (g·mL-1) | 1,00 | > 1,00 | 0,79 | 0,78 |
| Miscibilité avec l’eau | Miscible | Miscible | Non miscible |
Document 7. Propriétés physico-chimiques de quelques solvants extracteurs
| Espèces chimiques | Eau | Éthanol | Butanoate d’éthyle |
| Masse molaire (g·mol-1) | 18,0 | 46,0 | 116,0 |
Document 8. Masse molaire de quelques molécules
Q.9. Identifier dans le protocole les opérations permettant d’optimiser la vitesse de formation de l’arôme d’ananas.
Les opérations permettant d’optimiser la vitesse de formation de l’arôme d’ananas sont :
- Mettre un réactif en excès
- Mettre un catalyseur (acide sulfurique concentré qui est ajouté et n’apparait pas dans l’équation de réaction).
- Augmenter la température (Chauffer à reflux)
Q.10. Justifier l’utilisation du cyclohexane dans l’étape 4 pour isoler le butanoate d’éthyle.
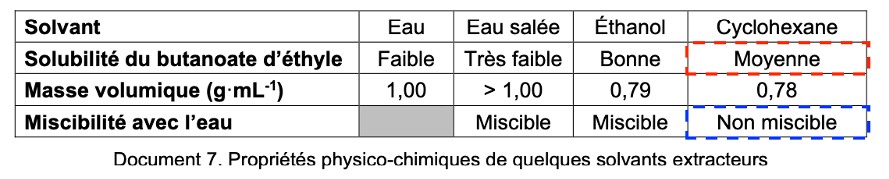
La molécule à extraire, le butanoate d’éthyle est moyennement soluble dans le cyclohexane.
Le cyclohexane est non miscible avec le solvant initiale (l’eau).
Ainsi, le cyclohexane ne se mélangera pas avec l’eau et le butanoate d’éthyle (l’espèce à extraire) migrera de l’eau salée vers le cyclohexane.
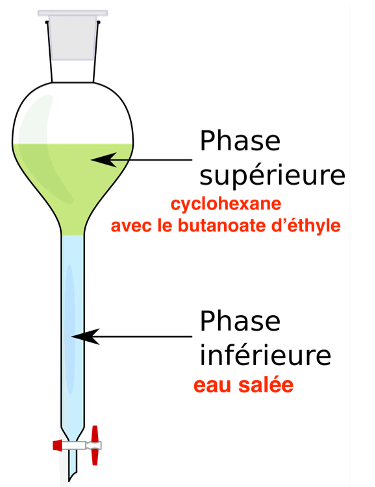
Q.11. Schématiser l’ampoule à décanter, la légender avec les termes : phase aqueuse et phase organique. Justifier la position de la phase contenant le butanoate d’éthyle.
La masse volumique du cyclohexane 0,78 g.mL-1 est inférieure à celle de l’eau salée (>1,00 g.mL-1).
Le cyclohexane contenant le butanoate d’éthyle sera donc au-dessus de l’eau salée.
Q.12. Montrer que l’éthanol est bien le réactif en excès, sachant que la quantité de matière initiale de l’acide butanoïque est $n\_{\text{acide}} = 4{,}4\times10^{-1}\ \mathrm{mol}$.
Calculons les quantités initiales des réactifs :
$$n=\frac{m}{M}$$
Or
$$\rho=\frac{m}{V}$$
$$\frac{m}{V}=\rho$$
$$m=\rho\times V$$
$$n=\frac{\rho\times V}{M}$$
Ainsi :
$$n_{éthanol}=ρéthanol \times Véthanol \times Méthanol$$
$$n_{éthanol}=0,79\times40,0 \times 46,0$$
$$n_{éthanol}=6,9 \times {10}^{-1}$$

$$x_{max1}=n_{éthanol1}=\frac{6,9 \times {10}^{-1}}{1}=6,9 \times {10}^{-1}mol$$
$$x_{max2}=\frac{n_{acide}}{1}=\frac{4,4\times {10}^{-1}}{1}=4,4\times {10}^{-1}\ mol$$
$x_{max2}<x_{max1}$ : $x_{max}=x_{max2}=4,4\times {10}^{-1}\ mol$, l’acide butanoique est le réactif limitant.
Ainsi, l’éthanol est bien le réactif en excès.
Q.13. Calculer alors la valeur du rendement de la réaction. Commenter.
$$\eta=\frac{m_{ester}^{exp}}{m_{ester}^{th}}$$
Avec :
$$m_{ester}^{th}=n_{ester}^{th}\times M_{ester}$$
$$m_{ester}^{th}=x_{max}\times M_{ester}$$
$$m_{ester}^{th}=4,4\times {10}^{-1}\times 116,0$$
$$m_{ester}^{th}=51\ g$$
$$\eta=\frac{m_{ester}^{exp}}{m_{ester}^{th}}$$
$$\eta=\frac{33,7}{51}$$
$$\eta=0,66$$
$$\eta=66%$$
Le rendement est inférieur à 100% : la réaction n’est pas totale.
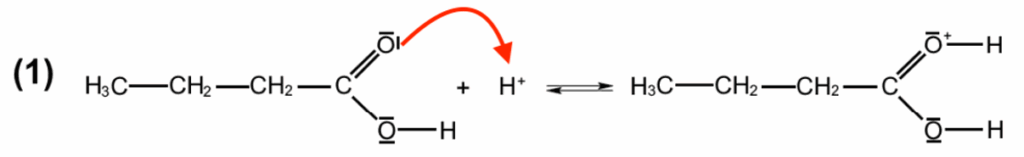
On s’intéresse à une partie du mécanisme réactionnel de la réaction dont les 2 premières étapes sont données ci-dessous :
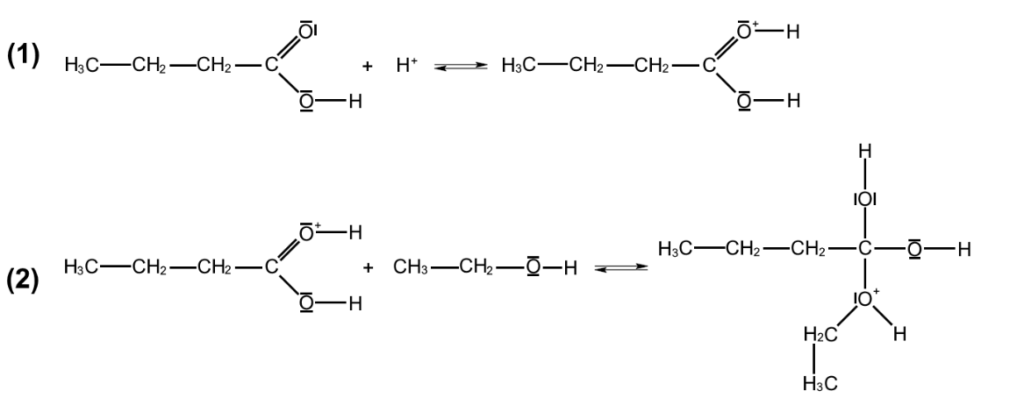
Q.14. Identifier un intermédiaire réactionnel dans les étapes du mécanisme réactionnel ci-dessus, en justifiant.
Un intermédiaire réactionnel est une espèce formée à une étape et consommée à l’étape suivante.
Un intermédiaire réactionnel est :
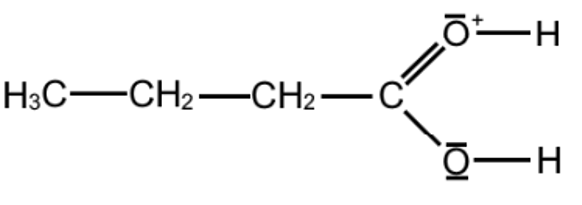
Q.15. Recopier l’étape (1) et représenter par une flèche courbe le déplacement d’électrons. Justifier son sens.
Lors d’une formation de liaison, le doublet d’électrons se déplace du site donneur (ici l’atome d’oxygène qui possède des doublets non liants) vers un site accepteur (ici l’ion H+).