Liban 2022 Sujet 1
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 22-PYCJ1LR1
La « Pizza Napoletana » se présente comme un aliment de forme arrondie cuit au four, au diamètre variable qui ne doit pas dépasser 35 cm, au bord surélevé et dont la partie centrale est garnie. La partie centrale a une épaisseur de 0,4 cm, avec une tolérance admise de ± 10 %, et le bord de 1 à 2 cm. La pizza dans son ensemble est tendre, élastique, facilement pliable en quatre.

D’après Journal Officiel de l’Union européenne 14.2.2008
Pour réussir une bonne pizza napolitaine, le repos de la pâte s’avère crucial. Lors de ce repos, la pâte gonfle : elle « s’aère » et les arômes se développent.
Les ingrédients de base d’une pâte à pizza napolitaine sont la farine, l’eau, le sel et la levure de boulanger. Cette dernière est composée de plusieurs souches de Saccharomyces cerevisiae, un champignon unicellulaire. Utilisée dans la fabrication de la pâte, la levure permet la dégradation des différents sucres présents (saccharose, glucose et maltose notamment) non seulement en dioxyde de carbone mais aussi en de nombreux composés aromatiques (dont des aldéhydes) responsables du goût de la pâte.
L’une des transformations chimiques responsables du gonflement de la pâte est la fermentation éthanolique, qui produit de l’éthanol et du dioxyde de carbone à partir de glucose ; elle est modélisée par la réaction dont l’équation est la suivante :
C6H12O6(s) → 2 C2H6O(ℓ)+ 2 CO2(g) (1)
D’après H.-D. Belitz, W. Grosh, P. Schierberle, Food Chemistry 4th ed., Springer
1. Gonflement de la pâte et production de dioxyde de carbone
Les évolutions temporelles des quantités d’éthanol, de glucose et de dioxyde de carbone, lors d’un essai de fermentation à partir de 100 g de farine, sont représentées graphiquement par les trois courbes ci-dessous.
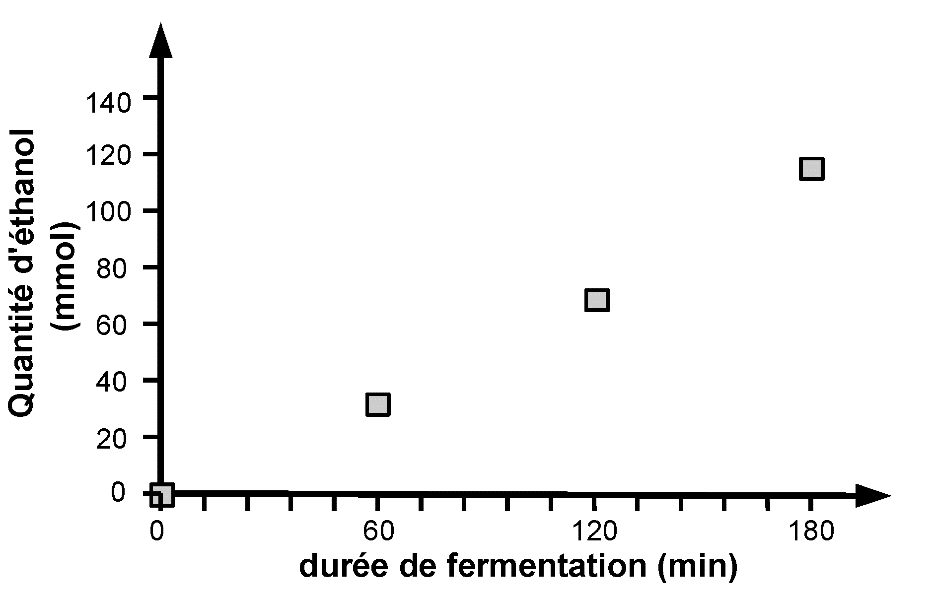
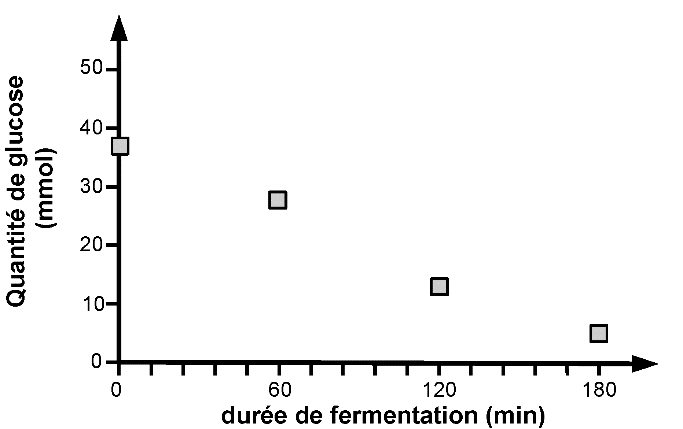
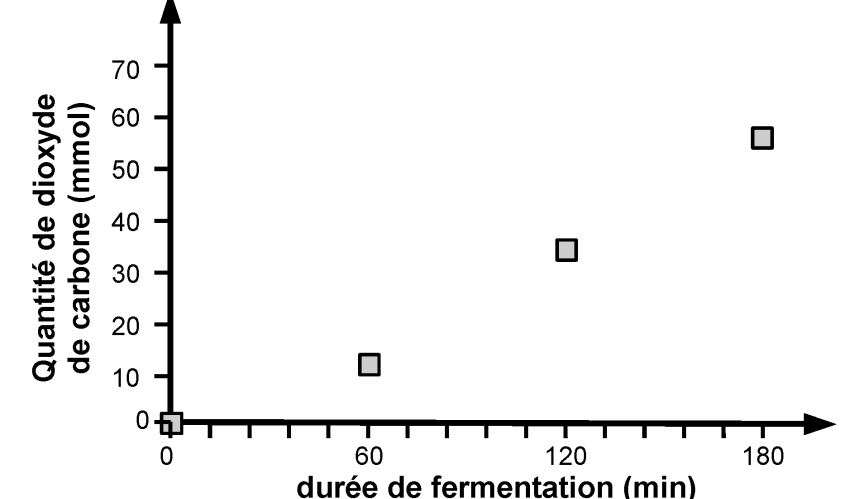
D’après Mapping of Saccharomyces cerevisiae metabolites in fermenting wheat straight-dough reveals succinic acid as pH-determining factor, Jayaram and coll., Food Chemistry 136 (2013) 301-308
1.1. Vérifier qualitativement la cohérence des évolutions temporelles présentées avec la modélisation de la fermentation proposée.
1.2. La hauteur de la pâte augmente au cours du temps. Identifier l’espèce chimique qui en est responsable.
1.3. On admet pour simplifier que la réaction est étudiée dans un milieu réactionnel de volume constant V = 1 L. Déterminer la valeur de la vitesse volumique moyenne d’apparition de l’éthanol sur une durée de 3 h. Déterminer également la vitesse volumique moyenne de disparition du glucose pour une même durée.
1.4. Effectuer le rapport entre ces deux valeurs de vitesse et indiquer si ce rapport est cohérent ou non avec la modélisation de la fermentation proposée.
1.5. La vitesse de disparition du glucose est-elle plus élevée ou plus faible que celle attendue ? Proposer une explication à cette observation expérimentale en relation avec la composition de la pâte.
1.6. Modélisation de la vitesse de la réaction
1.6.1. Parmi les deux modèles d’évolution temporelle de la quantité de dioxyde de carbone représentés ci-après, indiquer celui qui modélise le mieux les résultats expérimentaux.
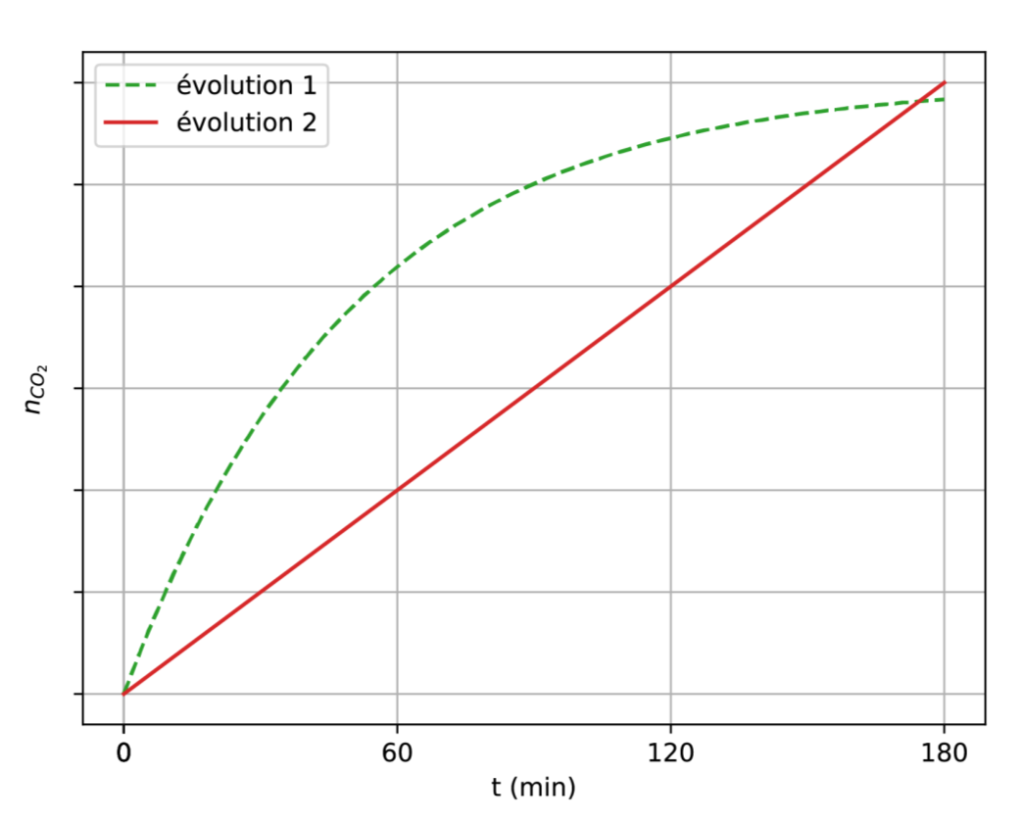
1.6.2. Dans le cadre du modèle choisi, préciser, en justifiant la réponse, si la vitesse d’apparition du dioxyde de carbone a une valeur constante ou non pendant la durée de l’expérience.
1.6.3. À l’aide de la définition d’une loi de vitesse d’ordre 1, expliquer qualitativement comment varie au cours du temps la vitesse d’apparition d’une espèce chimique qui suit une loi de vitesse d’ordre 1.
1.6.4. En raisonnant sur le coefficient directeur des tangentes aux courbes, expliquer, parmi les évolutions présentées à la question 1.6.1, laquelle peut modéliser une loi de vitesse d’ordre 1.
1.6.5. En déduire si la réaction de production de dioxyde de carbone dans la pâte suit une loi de vitesse d’ordre 1.
2. Acidification de la pâte et production de dioxyde de carbone
Lors de la fermentation, des mesures du pH de la pâte ont montré une acidification, le pH évoluant d’une valeur de 6,0 à environ 4,8.
Dans un premier temps, on peut supposer que l’acidification de la pâte est uniquement liée à la production de dioxyde de carbone. En effet, la forme solvatée du dioxyde de carbone, également appelée acide carbonique et notée (CO2, H2O)(aq), est l’acide du couple acide-base (CO2,H2O)(aq) / HCO3– (aq) dont le pKA a pour valeur 6,37.
L’équation de la réaction modélisant la transformation chimique entre le dioxyde de carbone solvaté et l’eau peut s’écrire :
(CO2,H2O)(aq) + H2O = HCO3– (aq) + H3O+(aq) (2)
2.1. Donner l’expression reliant le pH d’une solution et la concentration en ions oxonium [H3O+], puis indiquer qualitativement pourquoi la production de dioxyde de carbone au sein de la pâte peut être responsable de la baisse du pH observée.
2.2. Donner, à l’équilibre, la relation entre le quotient de réaction et la constante d’équilibre. Écrire l’expression de la constante d’équilibre en fonction des concentrations à l’équilibre des différentes espèces chimiques.
Pour évaluer l’influence de l’acide carbonique sur la diminution du pH, on réalise une solution de volume V = 50 mL, de concentration c = 7,0×10-6 mol·L-1 en dioxyde de carbone solvaté apporté qui correspond à la concentration en dioxyde de carbone dans la pâte en fin de levée. La mesure du pH de cette solution donne une valeur de pH = 5,8.
2.3. Justifier l’égalité des concentrations en H3O+ et en HCO3 – à l’équilibre chimique.
2.4. À l’aide de l’expression de la constante d’équilibre en fonction des concentrations à l’équilibre, déterminer la valeur de la concentration en dioxyde de carbone solvaté à l’équilibre. Commenter.
3. Rôle de l’acide succinique produit lors de la fermentation de la pâte
Pour expliquer la baisse de pH observée, on envisage l’effet des autres acides produits lors de la fermentation, notamment l’acide succinique, dont la formule topologique est donnée ci-contre.
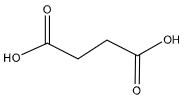
Données concernant l’acide succinique :
- l’acide succinique est un diacide ;
- pKA1 = pKA(C4H6O4(aq) / C4H5O4–(aq)) = 4,19 ;
- pKA2 = pKA(C4H5O4–(aq) / C4H4O42-(aq)) = 5,63 ;
- l’acide succinique est un solide blanc ;
- formule brute : C4H6O4 ;
- masse molaire moléculaire : M = 118,0 g·mol-1.
Données en spectroscopie IR
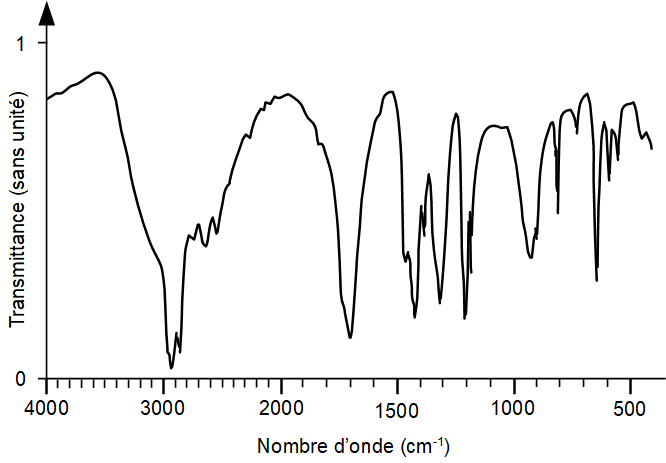
| Type de liaison | Nombre d’onde de la bande caractéristique (en cm-1) | Intensité et largeur de la bande |
| O-H alcool | 3200 – 3400 | Forte, large |
| O-H acide carboxylique | 2500 – 3200 | Forte à moyenne, large |
| C=O ester | 1735-1750 | Forte |
| C=O acide | 1700-1725 | Forte |
| C=C | 1620-1690 | Moyenne, fine |
3.1. Représenter la formule semi-développée de l’acide succinique. Justifier le fait que cet acide soit qualifié de « diacide ».
3.2. Choisir et justifier quel est le nom de l’acide succinique en nomenclature officielle, parmi les 4 propositions suivantes :
| ① | ② | ③ | ④ |
| éthanoate d’éthyle | Acide hexanoïque | Acide butanedioïque | Acide éthanedioïque |
3.3. Montrer que le spectre infrarouge présenté ci-après est cohérent et peut être attribué à l’acide succinique.
Transmittance (en %) en fonction du nombre d’onde (en cm-1)
3.4. Établir le diagramme de prédominance des différentes espèces acide-base issues de l’acide succinique qui peuvent éventuellement être présentes dans la pâte.
3.5. Une de ces espèces peut être qualifiée d’amphotère. Identifier cette espèce et justifier ce choix.
Pour montrer l’influence de l’acide succinique sur la baisse de pH, on envisage de réaliser 50 mL d’une solution de concentration 0,031 mol·L-1 en acide succinique apporté (concentration à la fin de la levée de la pâte) et de mesurer son pH. La valeur du pH mesuré vaut 5,0.
3.6. Déterminer la valeur de la masse d’acide succinique à prélever pour préparer par dissolution 50,0 mL d’une solution de concentration 0,031 mol·L-1.
3.7. Écrire le protocole succinct permettant de réaliser cette solution en précisant le matériel nécessaire et les différentes étapes.
3.8. Expliquer pourquoi l’hypothèse d’un lien entre acidification de la pâte et production d’acide succinique semble plausible.
