Bac Métropole Mars 2021 Sujet 1
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet et corrigé
EXERCICE C – FOUR À MICRO-ONDES POUR SYNTHÈSE ORGANIQUE
Mots-clés : synthèse organique
Un dispositif de chauffage est nécessaire pour réaliser de nombreuses synthèses organiques. Le montage à reflux est couramment utilisé au laboratoire ou dans l’industrie. Cependant depuis les années 1980, les fours micro-ondes domestiques constituent une alternative.

L’objectif de cet exercice est d’étudier la synthèse d’un principe actif utilisé dans le traitement de l’épilepsie : la phénytoïne.
Les trois étapes de cette synthèse sont représentées ci-dessous :
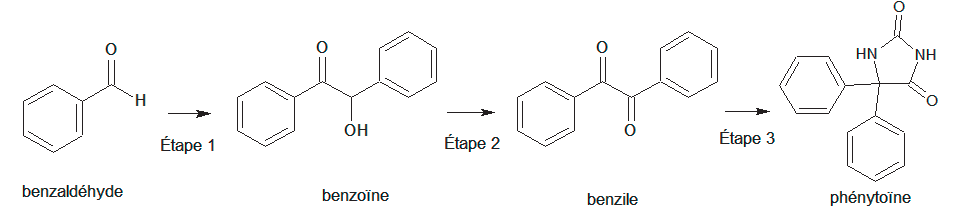
Figure 1. Schéma de synthèse de la phénytoïne
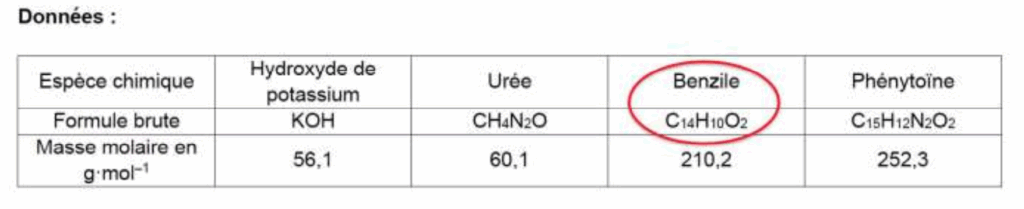
Données :
| Espèce chimique | Hydroxyde de potassium | Urée | Benzile | Phénytoïne |
| Formule brute | KOH | CH4N2O | C14H10O2 | C15H12N2O2 |
| Masse molaire en g·mol–1 | 56,1 | 60,1 | 210,2 | 252,3 |
1. Préparation de la benzoïne (étape 1)
On utilise un four à micro-ondes pour réaliser l’étape 1 de la synthèse qui est catalysée par le chlorure de thiamine.
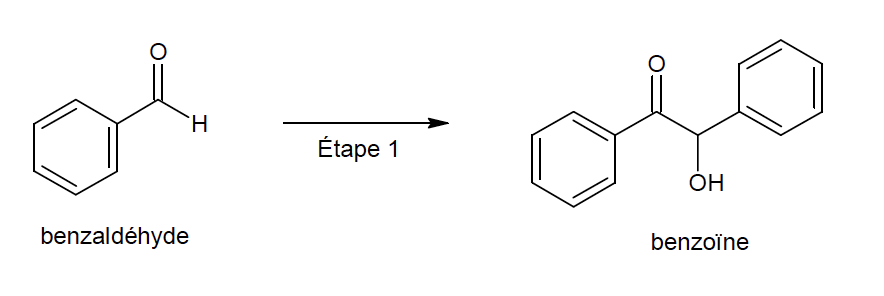
Le protocole expérimental simplifié est le suivant :
a – dans un erlenmeyer de 100 mL, introduire 1,35 g de chlorure de thiamine, environ 4 mL d’eau, 15 mL d’éthanol à 95 %, 7,0 mL d’une solution aqueuse d’hydroxyde de potassium (K+(aq) ; HO–(aq)) de concentration 1,1 mol·L–1 puis agiter à température ambiante ;
b – ajouter 2,0 mL de benzaldéhyde ;
c – recouvrir d’un entonnoir et chauffer à l’aide d’un four à micro-ondes pendant 1 min à la puissance de 600 W, sortir du four et laisser cristalliser à température ambiante puis refroidir dans un bain eau-glace ;
d – filtrer sur Büchner, laver les cristaux avec de l’eau glacée et les rincer avec un mélange refroidi eau- éthanol ; on obtient des cristaux blancs ;
e – purifier le produit à l’aide d’une recristallisation dans l’éthanol.
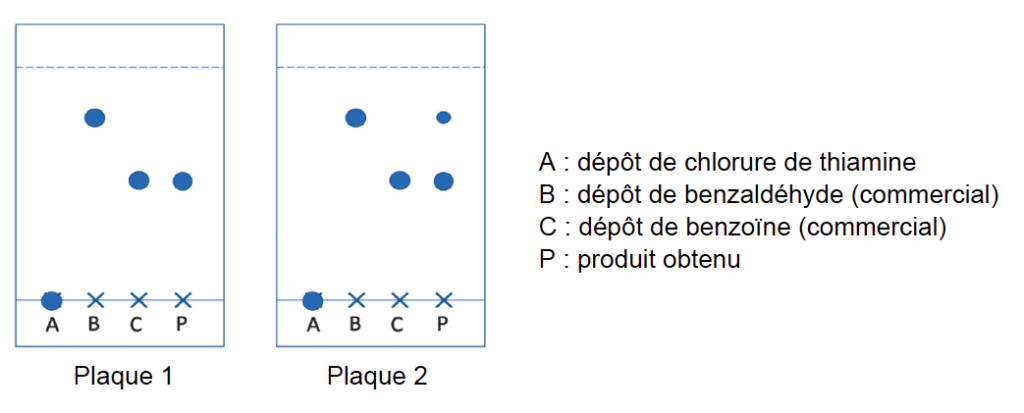
On réalise deux chromatographies sur couche mince (CCM) des cristaux obtenus : une avant l’étape de recristallisation et une après cette étape. L’éluant utilisé est un mélange d’éther de pétrole et d’acétate d’éthyle. La révélation s’effectue sous une lampe UV, et les dépôts proviennent de solutions diluées d’un facteur 100 dans l’acétate d’éthyle.
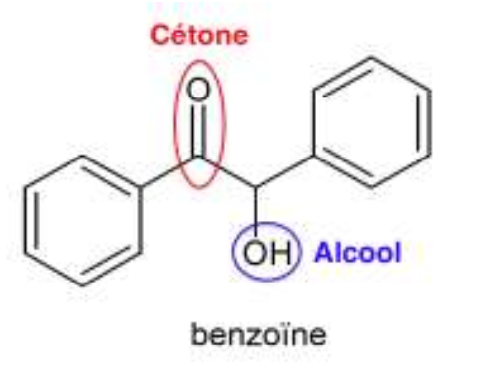
1.1. Recopier la formule topologique de la benzoïne sur la copie. Entourer les groupes caractéristiques et nommer les familles fonctionnelles correspondantes.
1.2. Déterminer la valeur de la masse d’hydroxyde de potassium solide à prélever pour préparer les 100,0 mL de solution aqueuse d’hydroxyde de potassium utilisée dans l’étape a.
$$m_{KOH}=n_{\ KOH} \times M_{\ KOH}$$
Or
$$n_{KOH}=C \times V$$
D’ou
$$m_{KOH}=C \times V \times M_{\ KOH}$$
$$m_{KOH}=1,1 \times 7,0 \times {10}^{-3} \times 56,1$$
$$m_{KOH}=0,43\ g$$
1.3. Donner l’état physique du produit obtenu à la fin de l’étape c du protocole expérimental.
Produit obtenu à la fin de l’étape c :
« Recouvrir d’un entonnoir et chauffer à l’aide d’un four à micro-ondes pendant 1 min à la puissance de
600 W, sortir du four et laisser cristalliser à température ambiante puis refroidir dans un bain eau-glace »
Le produit cristallise : c’est un solide.
1.4. Indiquer la plaque qui correspond à la CCM effectuée avant la purification. Justifier.
Sur la plaque 1, le produit obtenu ne présente qu’une tache : c’est une espèce pure. Cette tâche est au même niveau que la benzoine.
Sur la plaque 2, le produit obtenu présente deux taches : une au même niveau que la benzoine, et une deuxième au même niveau que le benzaldéhyde.
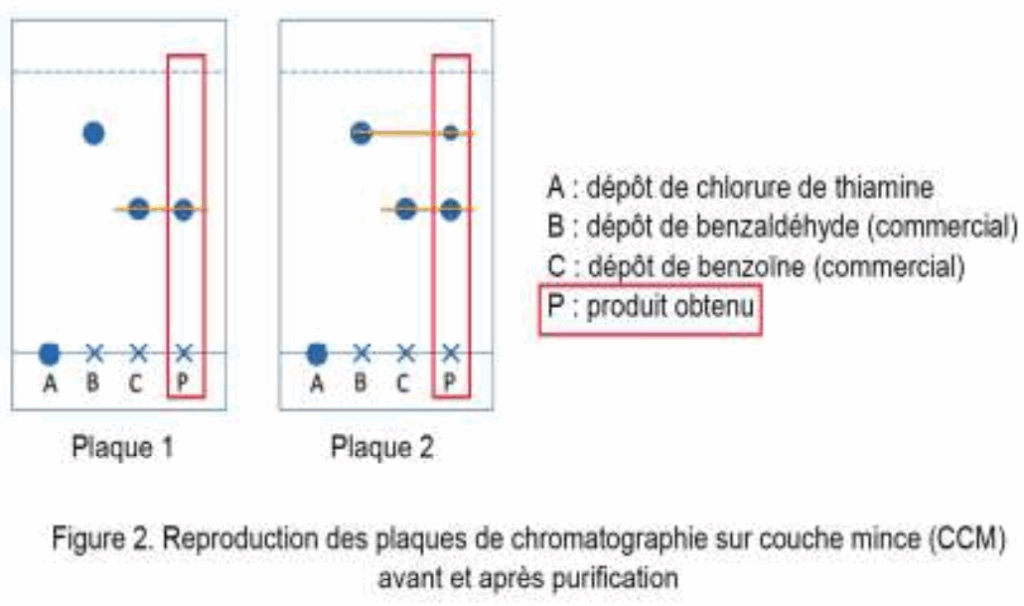
La plaque qui correspond à la CCM effectuée avant la purification est celle qui contient encore du réactif : la plaque 2.
1.5. Proposer une autre méthode d’identification du produit obtenu en fin de synthèse.
Autre méthode d’identification du produit obtenu en fin de synthèse : le spectre IR car la benzoine possède un groupe hydroxyle contrairement au benzaldéhyde.
2. Préparation du benzile (étape 2)
L’étape 2 de la synthèse est une oxydation de la benzoïne qui permet de former du benzile.
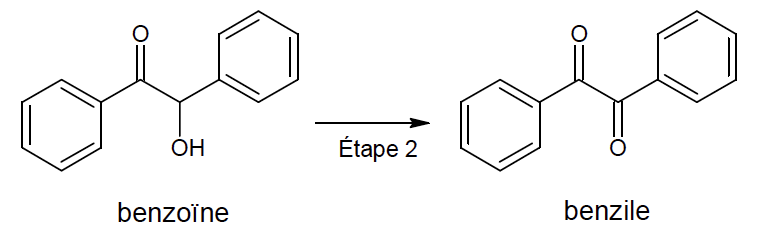
2.1. Donner la formule brute de la benzoïne.
Formule brute de la benzoine : $$C_{14}H_{12}O_2$$
2.2. Justifier, à partir de la demi-équation électronique associée au couple oxydant / réducteur benzile / benzoïne, que l’étape 2 correspond bien à une oxydation de la benzoïne.
$$C_{14}H_{12}O_2=C_{14}H_{10}O_2+2H^++2e^-$$
La benzoïne s’oxyde car elle perd des électrons
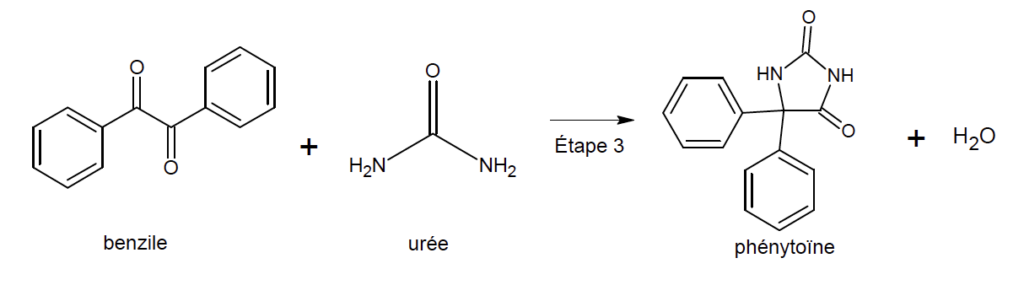
3. Préparation de la phénytoïne (étape 3)
L’étape 3 de la synthèse se réalise également à l’aide d’un four à micro-ondes, en milieu basique, en utilisant l’éthanol comme solvant. On introduit 1,00 g de benzile et 0,450 g d’urée. Après réaction, on obtient une masse de 1,11 g de phénythoïne.
Calculer le rendement de l’étape 3 de la synthèse de la phénytoïne.
Calculons les quantités de matière des réactifs :
$$n_{\ benzile}=\frac{m_{benzile}}{M_{\ benzile}}$$
$$n_{\ benzile}=\frac{1,00}{210,2}$$
$$n_{\ benzile}=4,76 \times {10}^{-3}\ mol$$
$$n_{\ uree}=\frac{m_{uree}}{M_{\ uree}}$$
$$n_{\ uree}=\frac{0,450}{60,1}$$
$$n_{\ uree}=7,49 \times {10}^{-3}\ mol$$
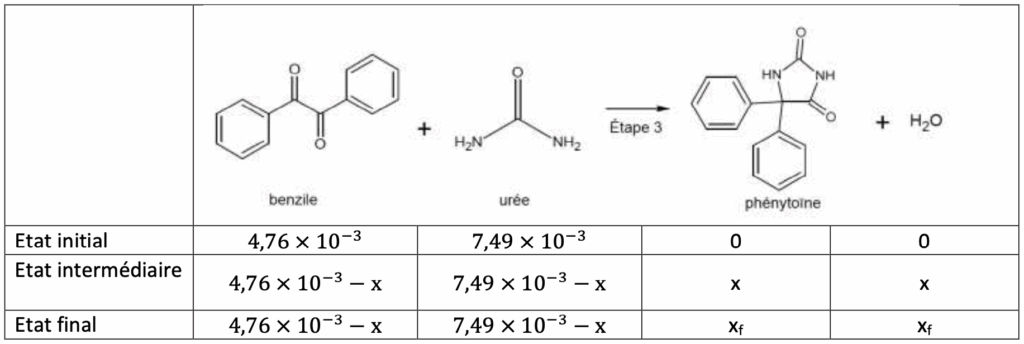
Trouvons $x_{max}$ :
$$4,76 \times {10}^{-3}-x_{max1}=0$$
$$x_{max1}=4,76 \times {10}^{-3}\ mol$$
$$7,49 \times {10}^{-3}-x_{max2}=0$$
$$x_{max2}=7,49 \times {10}^{-3}\ mol$$
$$x_{max}=4,76 \times {10}^{-3}\ mol$$
Le rendement est défini par :
$$\eta=\frac{m_{\ phenythoine}^{experimental}}{m_{\ phenythoine}^{Theorique}}$$
$$m_{\ phenythoine}^{experimental}=1,11\ g$$
$$m_{\ phenythoine}^{Theorique}=n_{\ phenythoine}^{Theorique} \times M_{phenythoine}$$
$$m_{\ phenythoine}^{Theorique}=x_{max} \times M_{phenythoine}$$
$$m_{\ phenythoine}^{Theorique}=x_{max} \times M_{phenythoine}$$
$$m_{\ phenythoine}^{Theorique}=4,76 \times {10}^{-3} \times 252,3$$
$$m_{\ phenythoine}^{Theorique}=1,20\ g$$
$$\eta=\frac{m_{\ phenythoine}^{experimental}}{m_{\ phenythoine}^{Theorique}}=\frac{1,11}{1,20}=0,925=92,5%$$
