E3C2 – 10 points – Durée 1h – calculatrice autorisée
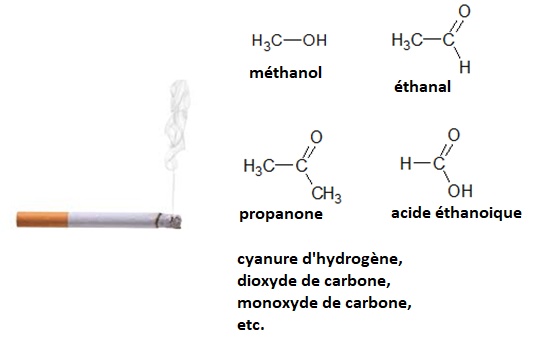
La fumée de cigarette est l’un des polluants atmosphériques les plus répandus dans l’environnement intérieur. Allumer une cigarette initie une série de processus chimiques impliquant la transformation ou la formation de plus de 4 000 espèces chimiques : des goudrons, des gaz toxiques, des composés irritants, etc. Les formules de quelques espèces chimiques présentes dans la fumée de cigarette sont représentées ou citées ci-dessous.
Le tabagisme passif est défini comme l’inhalation involontaire de la fumée de tabac présente dans l’air. Dans cette partie on cherche à déterminer si une femme enceinte est victime d’un tabagisme passif.
Données :
- Numéros atomiques : H (Z = 1) ; C (Z = 6) ; N (Z = 7)
- Masse molaire de l’ion thiocyanate SCN− : 58 g·mol-1
- Cercle chromatique :
1. Après avoir recopié la formule semi-développée de chacune des quatre molécules représentées ci-dessus, identifier le groupe caractéristique présent et l’associer à une famille de composés.
2. Justifier le nom donné à la propanone.
3. Établir le schéma de Lewis de la molécule de cyanure d’hydrogène de formule HCN et proposer une géométrie pour cette molécule.
Le cyanure d’hydrogène est absorbé par le corps, puis en partie dégradé en ions thiocyanate SCN− que l’on retrouve ensuite dans la salive ou dans l’urine. Dans la salive, par exemple, les concentrations en masse en ions thiocyanate sont en moyenne de 112 mg·L-1 chez les non-fumeurs et de 349 mg·L-1 chez les fumeurs. Les ions thiocyanate peuvent donc être considérés comme des marqueurs biologiques du tabagisme car leur concentration renseigne sur l’exposition d’une personne à la fumée du tabac.
Principe du dosage
Un échantillon noté S de 250 µL de salive d’une femme enceinte est prélevé. Les ions thiocyanate présents dans l’échantillon étant incolores et n’absorbant pas dans le proche ultraviolet, on les fait réagir avec une solution d’ions fer III, Fe3+(aq). On obtient 10,0 mL d’une solution S’dans laquelle s’est formée l’espèce ionique de formule Fe(SCN)2+, soluble dans l’eau. La transformation chimique est modélisée par la réaction d’équation suivante :
SCN–(aq) +Fe3+(aq) → Fe(SCN)2+(aq)
La courbe ci-dessous représente l’absorbance d’une solution aqueuse contenant l’espèce ionique Fe(SCN)2+ en fonction de la longueur d’onde.
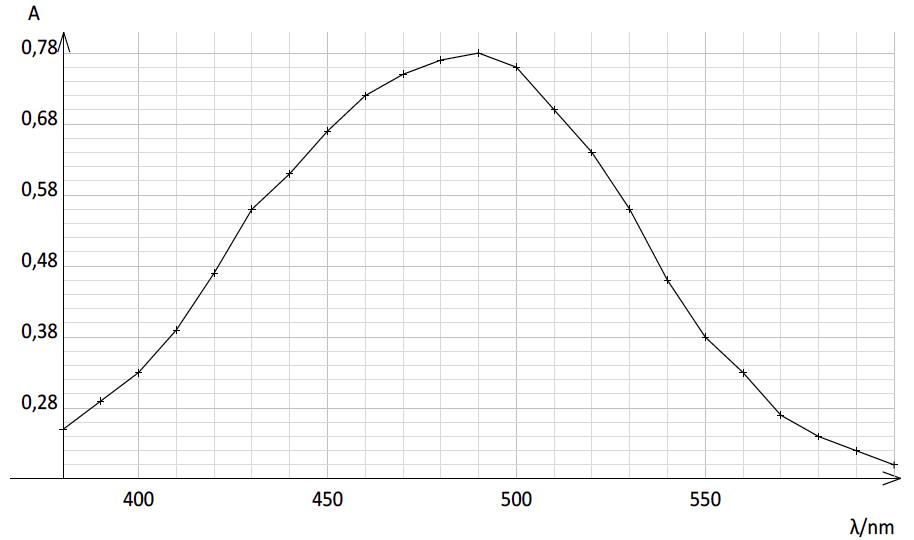
4. Expliquer pourquoi les ions thiocyanate ne peuvent pas être dosés directement par spectrophotométrie UV-visible. Indiquer l’intérêt de les faire réagir avec les ions Fe3+
Préparation de la gamme de solution étalon et tracé de la droite d’étalonnage
On cherche à doser l’espèce chimique Fe(SCN)2+ présente dans la solution S’.
À partir d’une solution S0de concentration C0= 2,0×10−4 mol.L-1 en ions Fe(SCN)2+, on prépare la gamme d’étalonnage composée des solutions S0, S1, S2, S3 et S4 dont les concentrations sont données dans le tableau ci-dessous.
| Solution | S0 | S1 | S2 | S3 | S4 |
| [Fe(SCN)2+] en mol·L-1 | 2,0×10-4 | 1,6×10-4 | 1,0×10-4 | 0,80×10-4 | 0,40×10-4 |
5. Indiquer la verrerie nécessaire pour préparer 50,0 mL de solution S2 à partir de la solution S0 en justifiant votre raisonnement.
On mesure l’absorbance de chacune des solutions et on trace le graphique ci-dessous donnant l’évolution de l’absorbance en fonction de la concentration en ions Fe(SCN)2+.
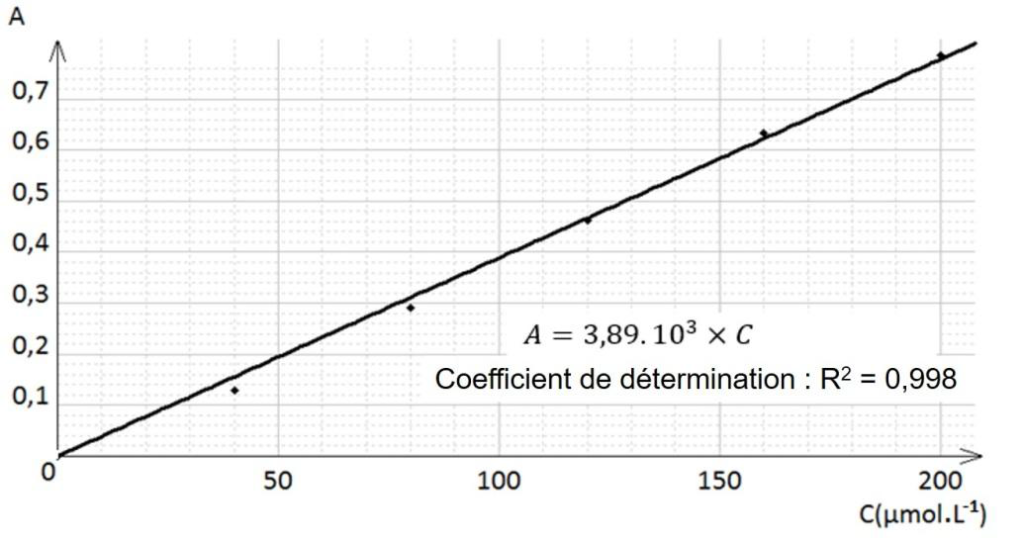
6. Après avoir rappelé l’expression de la loi de Beer-Lambert en indiquant les unités des grandeurs, déterminer si les résultats expérimentaux obtenus sont en accord avec cette loi.
Détermination de la concentration en ions thiocyanate dans la salive
Dans la solution S’ tous les ions thiocyanate contenus dans la salive de la femme enceinte ont réagi avec les ions Fe3+ présents en large excès. L’absorbance de la solution S’ a pour valeur A = 0,65.
7. Déterminer la concentration en quantité de matière des ions Fe(SCN)2+ dans la solution S’. En déduire leur quantité de matière dans la solution de volume V = 10,0 mL.
8. Recopier et compléter le tableau d’avancement ci-dessous. En déduire la relation entre la quantité de matière des ions Fe(SCN)2+ à la fin de la transformation et la quantité de matière en ions SCN– initialement présente dans la solution.
| SCN–(aq) | +Fe3+(aq) | → Fe(SCN)2+(aq) | ||
| État du système | Avancement (en mol) | n (SCN–) | n (Fe3+) | n (Fe(SCN)2+) |
| État initial | x = 0 | excès | ||
| État final | xmax | excès |
9. Déterminer la valeur de la concentration en masse des ions thiocyanate SCN− dans l’échantillon de salive de la femme enceinte et conclure sur le potentiel tabagisme passif de cette femme.
L’élève est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti.
