Nouvelle Calédonie 2022 Sujet 1
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ1NC1
Mots clés de l’EXERCICE C : oxydo-réduction, volume molaire des gaz, capacité électrique d’une pile.
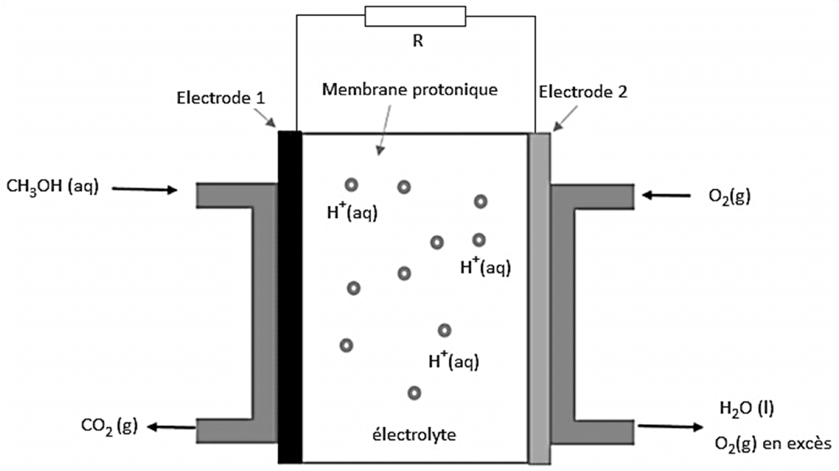
Une pile à méthanol fait partie de la famille des piles à combustibles. Elle est constituée de deux électrodes en platine, au niveau desquelles se produisent une réaction d’oxydation et une réaction de réduction. Le platine sert de catalyseur pour les réactions d’oxydo-réduction. Les deux électrodes sont séparées par une membrane poreuse riche en ions hydrogène
H+(aq), appelée membrane protonique. L’une des électrodes est alimentée par du dioxygène puisé dans l’air, et l’autre est alimentée par un combustible, ici le méthanol en solution aqueuse (figure 1).
Données :
- Masse molaire du méthanol : Mméthanol = 32,0 g.mol-1.
- Masse volumique du méthanol : ρéthanol = 0,792 g.mL-1.
- Composition volumique de l’air : 20 % de dioxygène et 80 % de diazote.
- Volume molaire du dioxygène dans les conditions de l’expérience : Vm = 24,5 L.mol-1.
- Constante de Faraday : J = 9,65 x 104 C.mol-1.
- Le rendement r d’une pile relie sa capacité électrique réelle Q‘max à sa capacité électrique théorique Qmax par la relation : Q‘max= r × Qmax
- Lorsqu’on associe des piles en série, leurs capacités électriques s’ajoutent.
PARTIE A : Étude du fonctionnement de la pile au méthanol
Les demi-équations traduisant les réactions au niveau des électrodes de la pile au méthanol sont données ci-dessous :
- Électrode 1 : CH3OH(aq) + H2O(l) = CO2(g) + 6 e– + 6 H+(aq)
- Électrode 2 : O2(g) + 4 e– + 4 H+(aq) = 2 H2O(l)
A.1.1. Identifier quelle électrode constitue l’anode et quelle électrode constitue la cathode dans la pile au méthanol.
A.1.2. Indiquer sur le schéma du circuit étudié donné dans l’ANNEXE À RENDRE AVEC LA COPIE (p18/18), les pôles de la pile ainsi que le sens du courant électrique.
A.1.3. Expliquer le rôle de la membrane protonique dans la pile au méthanol.
A.1.4. Indiquer le sens de circulation des porteurs de charge à l’intérieur et à l’extérieur de la pile sur le schéma de l’ANNEXE À RENDRE AVEC LA COPIE (p18/18).
A.2. Écrire l’équation de la réaction chimique modélisant le fonctionnement de la pile.
La pile est alimentée avec un volume V = 5,0 mL d’une solution aqueuse de méthanol à 10 % en volume et avec de l’air ambiant. Le compartiment qui contient l’air est constamment en contact avec l’air ambiant.
On s’intéresse au fonctionnement de la pile au méthanol jusqu’à son usure. La transformation chimique au sein de la pile étant considérée comme totale, le réactif limitant a entièrement disparu lorsque la pile est usée.
A.3.1. Montrer que la quantité de matière de méthanol introduite dans la pile au méthanol a pour valeur n(CH3OH) = 1,2 x 10-2 mol.
A.3.2. Justifier que le dioxygène est le réactif en excès.
A.3.3. Déterminer le volume d’air V(air) consommé lors du fonctionnement de la pile jusqu’à son usure.
PARTIE B : Alimentation d’un circuit comportant un petit ventilateur
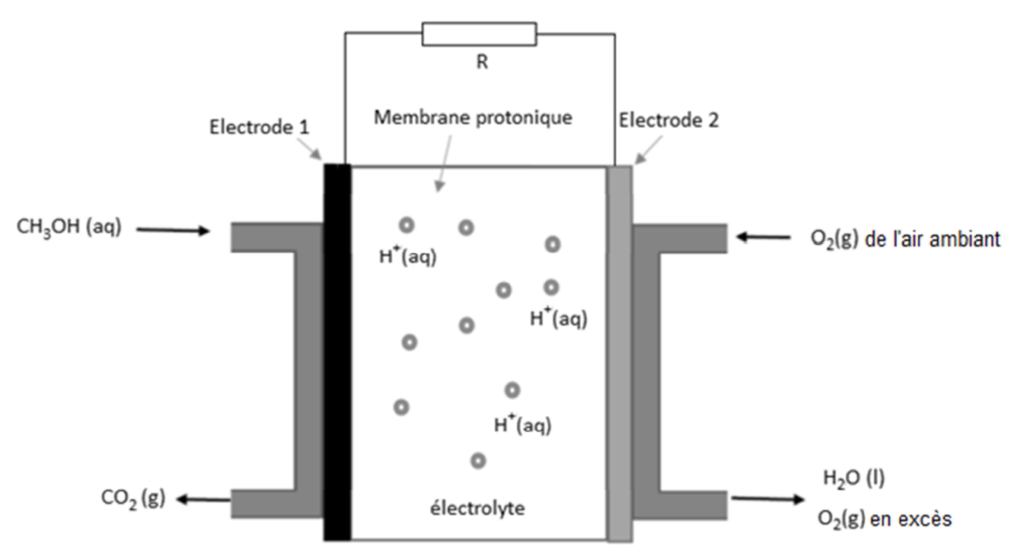
Au laboratoire du lycée, des élèves cherchent à faire fonctionner un petit ventilateur avec la pile au méthanol étudiée dans la partie A. Pour y parvenir, ils doivent associer deux piles en série (figure 2). Ils mesurent alors que l’intensité du courant qui circule dans le circuit lorsque le ventilateur fonctionne vaut I = 450 mA. Chacune des piles a un rendement de 70 %.

source : https://auditoires-physique.epfl.ch
B.1. Calculer la capacité électrique théorique de la pile au méthanol étudiée dans la partie A.
B.2. Les élèves souhaitent faire fonctionner le ventilateur pendant au moins une heure. Expliquer en argumentant la réponse s’ils y parviendront.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
ANNEXE À RENDRE AVEC LA COPIE (même non complétée)
Questions A.1.2. et A.1.4.