E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02691 , n°G1SPHCH02708 et n°G1SPHCH02778
Télécharger l’exercice en PDF :
Le dioxyde de soufre est un gaz sans couleur et ininflammable dont l’odeur pénétrante irrite les yeux et les voies respiratoires. Le dioxyde de soufre provient principalement des combustions des combustibles fossiles (charbons, fiouls, etc), au cours desquelles les impuretés soufrées contenues réagissent avec le dioxygène de l’air pour former le dioxyde de soufre SO2(g). Ce polluant gazeux est rejeté dans l’atmosphère par de multiples petites sources (installations de chauffage domestique, véhicules à moteur diesel,…) et par des sources ponctuelles plus importantes telles que les centrales thermiques qui constituent d’ailleurs la plus grande source de dioxyde de soufre, notamment par la combustion du charbon.
Les concentrations de dioxyde de soufre ont fortement baissé ces dernières années au rythme d’environ 10 % par an depuis cinq ans, pour atteindre une valeur plancher de l’ordre de 5 µg.m-3 en moyenne annuelle pour l’ensemble des agglomérations. Cette évolution récente s’explique notamment par l’amélioration des combustibles et carburants.
D’après www.actu-environnement.com
L’objectif de l’exercice est de comparer la teneur en soufre d’un fioul domestique datant de 1960 et d’un fioul domestique « nouvelle génération ».
La méthode européenne de référence utilisée pour la mesure de la quantité de matière de dioxyde de soufre gazeux est la fluorescence ultraviolette.
On se propose de déterminer la quantité de matière de dioxyde de soufre produite lors de la combustion des deux fiouls par une méthode pouvant être mise en œuvre dans un laboratoire de lycée, un titrage ayant pour support une réaction d’oxydo-réduction.
Données
- Couples oxydant-réducteur mis en jeu : $MnO_{4(aq)}^-$$/Mn_{(aq)}^{2+}$ ; $SO_{4(aq)}^{2-}$ $/SO_{2(aq)}$
- Dans le titrage, parmi les espèces présentes, seuls les ions permanganate $MnO_{4(aq)}^-$ confèrent à la solution aqueuse une couleur violette.
Soit S1 une solution aqueuse contenant une quantité de matière de dioxyde de soufre identique à celle utilisée pour la mesure, par la méthode européenne de référence, à la fin de la combustion totale du fioul « nouvelle génération ».
On réalise le titrage d’un volume V1 = 20,00 ± 0,02 mL de solution S1 introduite dans un bécher par une solution aqueuse de permanganate de potassium (K+(aq) + $MnO_{4(aq)}^-$) acidifiée dont la concentration en quantité de matière est C2 = (7,50 ± 0,01) x 10-3mol.L-1.
Lors du titrage, l’équivalence est obtenue pour un volume versé VE = 8,5 ± 0,4 mL de la solution aqueuse de permanganate de potassium.
1. Une des impuretés soufrées dans le fioul, évoqué dans l’introduction, est le soufre. Écrire l’équation de la réaction modélisant la combustion du soufre S(s).
« Les impuretés soufrées contenues réagissent avec le dioxygène de l’air pour former le dioxyde de soufre SO2(g) »
équation de la réaction modélisant la combustion du soufre S(s) :
$$S_{(s)}+O_{2(g)}\rightarrow SO_{2(g)}$$
2. Réaliser et légender précisément le schéma du montage utilisé pour réaliser le titrage.
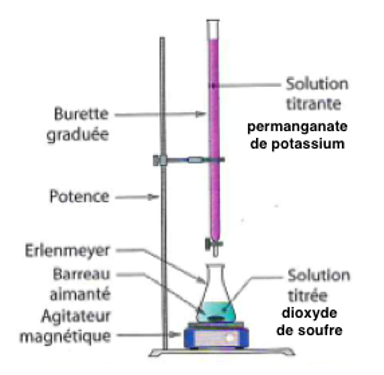
3. Établir, à l’aide des données l’équation de la réaction d’oxydo-réduction support du titrage écrite ci-après :
$2MnO_{4(aq)}^-$ $+ 5 SO_{2(aq)}$ $+ 2 H_2O{(l)}$ $\rightarrow$ $2 Mn_{(aq)}^{2+}$ $+5SO_{4(aq)}^{2-}$ + $4H_{(aq)}^{+}$
$$MnO_{4(aq)}^-/Mn_{(aq)}^{2+} : MnO_{4(aq)}^-+5 e^-+8 H^+=Mn_{(aq)}^{2+}+4 H_2O_{(l)}\times2$$
$$SO_{4(aq)}^{2-}/SO_{2(g)} : SO_{2(g)}+2 H_2O_{(l)}=SO_{4(aq)}^{2-}+4 H^++2 e^-\times5$$
$$2 MnO_{4(aq)}^-+16 H^++5 SO_{2(g)}+10 H_2O_{(l)}=2 Mn_{(aq)}^{2+}+8 H_2O_{(l)}+5 SO_{4(aq)}^{2-}+20 H^+$$
En simplifiant les $H^+$ et $H_2O_{(l)}$ présents dans les réactifs et les produits :
$$2 MnO_{4(aq)}^-+5 SO_{2(g)}+2 H_2O_{(l)}=2 Mn_{(aq)}^{2+}+5 SO_{4(aq)}^{2-}+4 H^+$$
4. Définir l’équivalence d’un titrage
On atteint l’équivalence, lorsqu’on a réalisé un mélange stœchiométrique des deux réactifs qui sont alors totalement consommés.
A l’équivalence, il y’a changement du réactif limitant.
5. Décrire qualitativement comment évoluent, au cours du titrage, les quantités de matière des espèces chimiques présentes dans le bécher.
| Espèces | Avant l’équivalence | Après l’équivalence |
| $MnO_{4(aq)}^-$ | N’existe pas car il réagit des son introduction | Augmente car il ne réagit pas |
| $SO_{2(g)}$ | Diminue | N’existe pas car il a totalement été consommé |
| $Mn_{(aq)}^{2+}$ | Augmente | Reste constant car il n’y a plus de réaction qui en produit |
| $SO_{4(aq)}^{2-}$ | Augmente | Reste constant car il n’y a plus de réaction qui en produit |
| $H^+$ | Augmente | Reste constant car il n’y a plus de réaction qui en produit |
6. Indiquer comment s’effectue le repérage de l’équivalence, en précisant votre raisonnement.
« Dans le titrage, parmi les espèces présentes, seuls les ions permanganate confèrent à la solution aqueuse une couleur violette. »
Avant l’équivalence, les ions permanganate sont consommés et constituent le réactif limitant : la solution est incolore.
A l’équivalence, il y’a changement du réactif limitant, les ions permanganate ne sont plus consommés : la solution devient violette.
On repère l’équivalence lorsque la solution passe de incolore à violet.
7. On note n1, la quantité de matière initiale de dioxyde de soufre et n2, la quantité de matière des ions permanganate versés pour atteindre l’équivalence. Donner la relation entre les quantités de matière de réactifs introduits à l’équivalence.
$$2 MnO_{4(aq)}^-+5 SO_{2(g)}+2 H_2O_{(l)}=2 Mn_{(aq)}^{2+}+5 SO_{4(aq)}^{2-}+4 H^+$$
A l’équivalence :
$$\frac{n_{MnO_{4(aq)}^-}^{eq}}{2}=\frac{n_{SO_{2(g)}}^i}{5}$$
$$\frac{n_2}{2}=\frac{n_1}{5}$$
8. L’incertitude-type sur la quantité de matière de dioxyde de soufre étant évaluée à une valeur de 8×10-6 mol lors de ce titrage, donner un encadrement à la valeur de la quantité de matière initiale de dioxyde de soufre dans la solution S1.
$$n_1=5\times\frac{n_2}{2}$$
$$n_1=5\times\frac{C_2\times V_e}{2}$$
$$n_1=5\times\frac{7,50.10^{-3}\times8,5.10^{-3}}{2}$$
$$n_1=1,59.10^{-4} mol$$
« L’incertitude-type sur la quantité de matière de dioxyde de soufre étant évaluée à une valeur de $8\times10^{-6}$ mol »
$$1,59.10^{-4}-8.10^{-6}<n_1<1,59.10^{-4}+8.10^{-6}$$
$$1,51.10^{-4}<n_1<1,67.10^{-4}$$
9. La quantité de matière de dioxyde de soufre dans le fioul datant de 1960 est déterminée égale à 2,5 x 10-2 mol, ce qui correspond à une teneur en soufre de 0,8 %. Estimer la teneur en soufre du fioul « nouvelle génération ». Commenter.
| Quantité de matière de dioxyde de soufre | Teneur en soufre |
| $2,5.10^{-2}$ mol | 0,8 % |
| $1,59.10^{-4}$ mol | x |
$$x=\frac{1,59.10^{-4}\times0,8}{2,5.10^{-2}}$$
$$x=0,005%$$
Commenter : la teneur est très faible. « Cette évolution récente s’explique notamment par l’amélioration des combustibles et carburants. »
10. Il est possible d’acheter du fioul domestique, notamment sur internet. Certains sites utilisent le terme de « fioul désoufré ». Justifier cette appellation.
« Fioul désoufré » : fioul sans soufre. En considérant la teneur extrêmement faible (voir question 9.), les sites considèrent que le fioul est sans soufre.
11. La fermeture des centrales thermiques produisant de l’électricité permettra-t-il d’atteindre les objectifs écologiques qui sont de réduire de façon significative les émissions de gaz à effet de serre d’ici 2050 et autres polluants gazeux ? Justifier et proposer une alternative pour produire de l’électricité.
Les centrales thermiques produisant de l’électricité produisent des gaz à effet de serre. Ainsi, leur fermeture contribuera à réduire de façon significative les émissions de gaz à effet de serre d’ici 2050.
Alternative pour produire de l’électricité : éoliennes, panneaux solaires …
