Bac Centres étrangers 2023 Sujet 2
Exercice 3 – (4,5 points) – Durée 0h47 – Calculatrice autorisée
Sujet n°23-PYCJ2G11
Sujet et corrigé
EXERCICE 3 – L’ACÉTANILIDE, MÉDICAMENT ANTIPYRÉTIQUE (4,5 points)
L’acétanilide est un composé organique, solide, blanc, obtenu par l’action de l’anhydride éthanoïque (CH3CO)2O sur l’aniline C6H5NH2, et utilisé en pharmacologie. Sa formule semi-développée est donnée figure 1 ci-dessous.
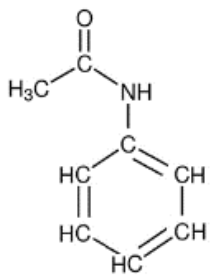
Figure 1 – Formule semi-développée de l’acétanilide
Cette molécule est obtenue selon la réaction d’équation :
(CH3CO)2O + C6H5NH2 CH3-CO-NH-C6H5 + CH3CO2H (équation 1)
Le but de l’exercice est d’étudier trois protocoles expérimentaux afin de déterminer les conditions optimales d’obtention de l’acétanilide CH3-CO-NH-C6H5.
Pour simplifier, les différents composés sont notés par des lettres :
A = (CH3CO)2O anhydride éthanoïque
B = C6H5NH2 aniline
C = CH3-CO-NH-C6H5 acétanilide
D = CH3CO2H acide éthanoïque
Données
- Masse volumique de l’anhydride éthanoïque : ρA = 1,08 g·mL-1
- Masse molaire de l’anhydride éthanoïque : MA = 102,09 g·mol-1
- Masse volumique de l’aniline : ρB = 1,02 g·mL-1
- Masse molaire de l’aniline : MB = 93,13 g·mol-1
- Masse molaire de l’acétanilide : MC = 135,17 g·mol-1
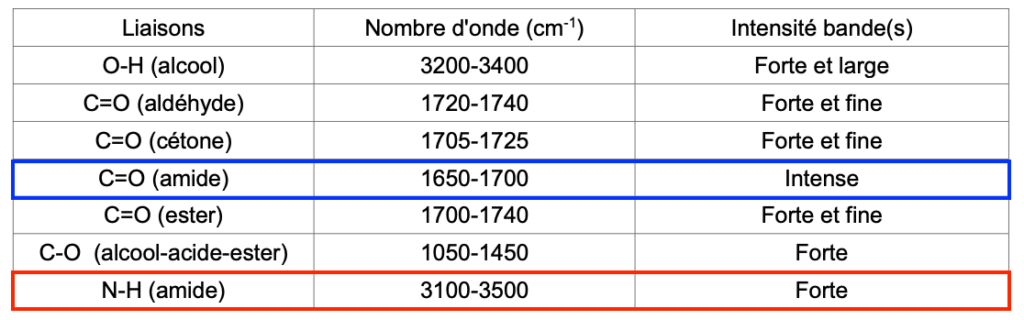
- Nombres d’onde et allure des bandes d’absorption de quelques liaisons :
| Liaisons | Nombre d’onde (cm-1) | Intensité bande(s) |
| O-H (alcool) | 3200-3400 | Forte et large |
| C=O (aldéhyde) | 1720-1740 | Forte et fine |
| C=O (cétone) | 1705-1725 | Forte et fine |
| C=O (amide) | 1650-1700 | Intense |
| C=O (ester) | 1700-1740 | Forte et fine |
| C-O (alcool-acide-ester) | 1050-1450 | Forte |
| N-H (amide) | 3100-3500 | Forte |
La molécule d’acétanilide
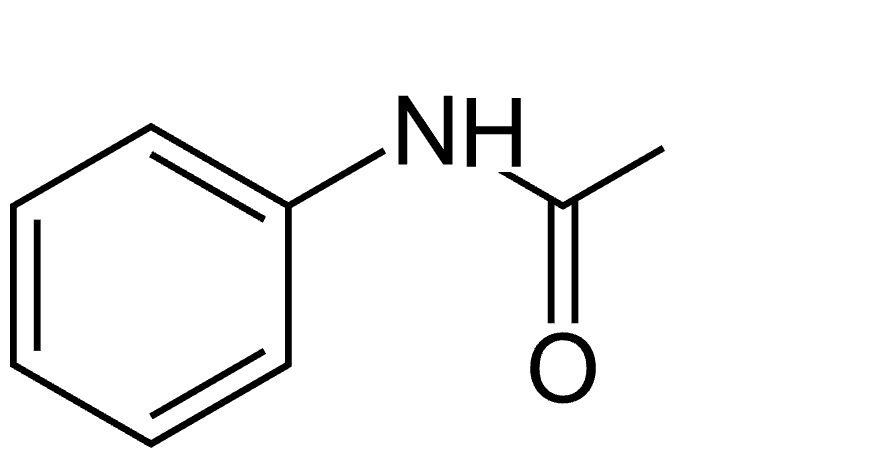
1. Représenter la formule topologique de l’acétanilide. Identifier la famille fonctionnelle à laquelle l’acétanilide appartient parmi les suivantes : alcool, aldéhyde, cétone, amide, ester.
L’acétanilide appartient à la famille des amides
2. Montrer que le spectre infrarouge de l’acétanilide (figure 2 ci-dessous) permet de confirmer que l’acétanilide appartient bien à cette famille fonctionnelle.
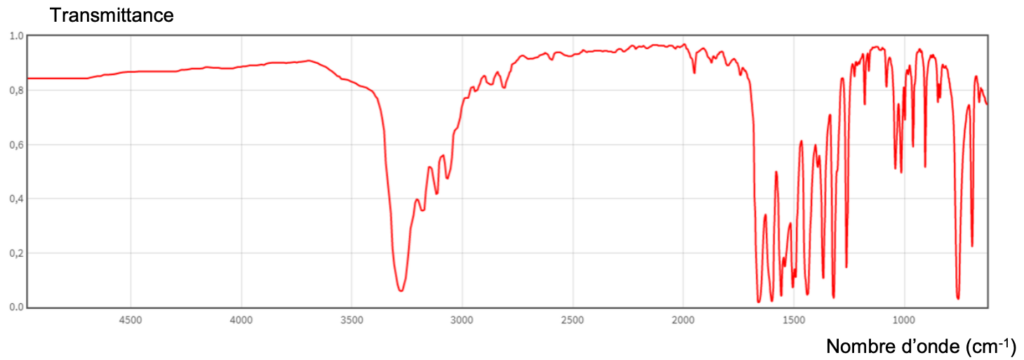
Figure 2 – Spectre infrarouge de l’acétanilide
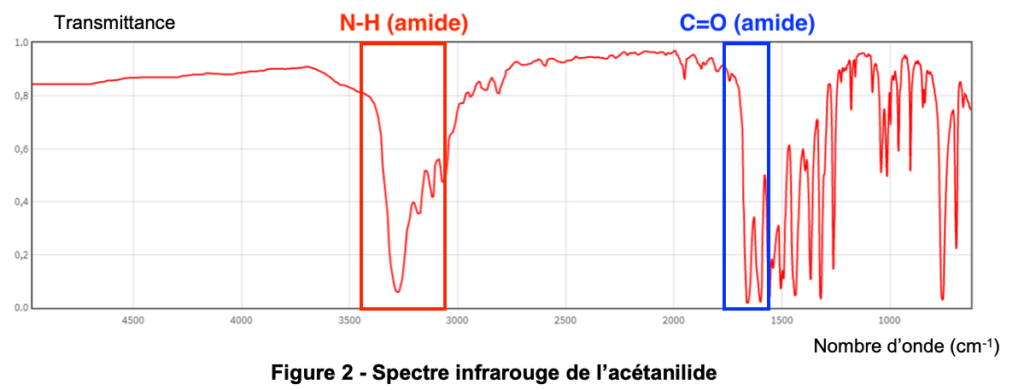
Le spectre infrarouge de l’acétanilide comporte des bandes d’absorption correspondant aux liaisons :
N-H (amide)
C=O (amide)
Ainsi, le spectre infrarouge de l’acétanilide permet de confirmer que l’acétanilide appartient bien à la famille fonctionnelle des amides.
Protocoles expérimentaux
On met en œuvre trois protocoles expérimentaux différents, présentés figure 3 ci-dessous, afin d’étudier les conditions optimales de synthèse de l’acétanilide.
Les réactifs sont introduits dans un ballon adapté aux montages des protocoles 1, 2 ou 3.
Après une vingtaine de minutes, le mélange est refroidi dans un bain d’eau glacée afin de faire précipiter le produit C obtenu.
On filtre ensuite le mélange, on le rince à l’eau distillée, puis les cristaux obtenus sont séchés à l’étuve. On pèse ensuite le produit C.
| Numéro du protocole | 1 | 2 | 3 |
| Montage utilisé | Chauffage à reflux | Chauffage à reflux adapté d’un montage DEAN-STARK* | Chauffage à reflux |
| Volume du réactif A (mL) (CH3CO)2O | 15,0 | 15,0 | 30,0 |
| Volume du réactif B (mL) C6H5NH2 | 14,5 | 14,5 | 14,5 |
| Masse mC du produit C (g) CH3-CO-NH-C6H5 | 10,7 | 21,4 | 14,3 |
| Rendement r | 1,0 | 0,67 |
Figure 3 – Récapitulatif des différents protocoles
(*) Un montage DEAN-STARK est un montage qui permet d’éliminer un produit au cours de sa formation.
Etude du protocole 1
3. Montrer que, dans le cas du protocole 1, les réactifs sont introduits dans le ballon en proportions stœchiométriques.
$n=\frac{m}{M}$
Or
$\rho=\frac{m}{V}$
$m=\rho\times V$
$n=\frac{\rho\times V}{M}$
$n_A=\frac{\rho_A\times V_A}{M_A}$
$n_A=\frac{1,08\times15,0}{102,09}$
$n_A=1,59{\times10}^{-1}\ mol$
$n_B=\frac{\rho_B\times V_B}{M_B}$
$n_B=\frac{1,02\times14,5}{93,13}$
$n_B=1,59{\times10}^{-1}\ mol$
$\frac{n_A}{1}=\frac{n_B}{1}\ $ :
Les réactifs sont introduits dans le ballon en proportion stoechiométrique.
La constante d’équilibre K associée à l’équation 1 a pour valeur K = 1,0 à la température de l’expérience.
Par ailleurs, on admet que, dans les conditions de l’expérience, le quotient de réaction 𝑄𝑅(𝑥) s’écrit, pour un avancement x donné :
$$Q_R(x)=\frac{n(C)\times n(D)}{n(A)\times n(B)}$$
𝑛(X) désigne la quantité de matière (en mol) de l’espèce X.
4. Donner la valeur du quotient de réaction initial, QR (𝑥 = 0), pour le protocole 1.
$Q_R(x)=\frac{n\left(C\right)\times n\left(D\right)}{n\left(A\right)\times n\left(B\right)}$
$Q_R(x=0)=\frac{0\times0}{1,59{\times10}^{-1}\times1,59{\times10}^{-1}}$
$Q_R(x=0)=0$
5. En déduire le sens d’évolution spontanée de la réaction chimique d’équation 1.
$K=1,0$
$Q_R\left(x=0\right)=0<K$
Ainsi, le sens d’évolution spontanée de la réaction chimique d’équation 1 est le sens direct.
6. Recopier et compléter le tableau d’avancement de la réaction de formation de l’acétanilide.
| Avancement x | (CH3CO)2O + C6H5NH2 | ||||
| État initial | x = 0 | n(A)i | n(B)i | 0 | 0 |
| État final | xf | ||||
| Avancement x | (CH3CO)2O + C6H5NH2 | ||||
| État initial | x = 0 | n(A)i | n(B)i | 0 | 0 |
| État final | xf | ${n\left(A\right)}_i-x_f$ | ${n\left(B\right)}_i-x_f$ | $x_f$ | $x_f$ |
7. Déterminer la masse maximale théorique mmax de produit C qui serait obtenue si la réaction était totale pour le protocole 1.
${n\left(A\right)}i-x{max1}=0$
$x_{max1}={n\left(A\right)}i$
$x{max1}=1,59{\times10}^{-1}\ mol$
${n\left(B\right)}i-x{max2}=0$
$x_{max2}={n\left(B\right)}i$
$x{max2}=1,59{\times10}^{-1}\ mol$
$x_{max}=1,59{\times10}^{-1}\ mol$
Calculons la masse maximale de produit C qui peut être obtenue :
$n_C^{maximale}=\frac{m_C^{maximale}}{M_C}$
$m_C^{maximale}=n_C^{maximale}\times M_C$
$m_C^{maximale}=x_{max}\times M_C$
$m_C^{maximale}=1,59{\times10}^{-1}\times135,17$
$m_C^{maximale}=21,5\ g$
8. Exprimer le rendement r de la réaction pour le protocole 1 en fonction de mC (voir figure 3) et de mmax. Calculer sa valeur.
$\eta=\frac{m_C^{experimentale}}{m_C^{maximale}}$
$\eta=\frac{10,7}{21,5\ }$
$\eta=0,498$
9. Exprimer le quotient de réaction 𝑄𝑅(𝑥 = 𝑥𝑓) à l’état final pour le protocole 1 en fonction de l’avancement final 𝑥𝑓.
$Q_R(x=x_f)=\frac{{n\left(C\right)}_f\times{n\left(D\right)}_f}{{n\left(A\right)}_f\times{n\left(B\right)}_f}$
$Q_R(x=x_f)=\frac{x_f\times x_f}{\left({n\left(A\right)}_i-x_f\right)\times\left({n\left(B\right)}_i-x_f\right)}$
10. Calculer la valeur de 𝑄𝑅(𝑥 = 𝑥𝑓) et, à partir de cette valeur, indiquer si l’état d’équilibre est atteint.
Trouvons $x_f$ :
$x_f=n_C^f=\frac{m_C^f}{M_C}$
$x_f=\frac{m_C^f}{M_C}$
$x_f=\frac{10,7}{135,17}$
$x_f=7,92{\times10}^{-2}\ mol$
$Q_R(x=x_f)=\frac{x_f\times x_f}{\left({n\left(A\right)}_i-x_f\right)\times\left({n\left(B\right)}_i-x_f\right)}$
$Q_R(x=x_f)=\frac{7,92{\times10}^{-2}\times7,92{\times10}^{-2}}{\left(1,59{\times10}^{-1}-7,92{\times10}^{-2}\right)\times\left(1,59{\times10}^{-1}-7,92{\times10}^{-2}\right)}$
$Q_R(x=x_f)=0,985$
$Q_R(x=x_f)\approx K$
L’état d’équilibre est atteint.
Les protocoles 2 et 3
11. Expliquer pourquoi la mise en œuvre des protocoles 2 et 3 permet d’optimiser le rendement.
Le protocole 2 utilise un montage de DEAN-STARK qui permet d’éliminer un produit au cours de sa formation. Ainsi, la quantité de matière d’un des produits est nulle (n(C)=0 ou n(D)=0) et donc
$Q_R\left(x\right)=\frac{n\left(C\right)\times n\left(D\right)}{n\left(A\right)\times n\left(B\right)}=0$
$Q_R\left(x\right)$ sera donc toujours inferieur à $K$ et donc la réaction se déroulera dans le sens direct jusqu’à épuisement des réactifs : la réaction sera totale.
Le protocole 3 utilise un volume du réactif A supérieur au protocole 1. Ainsi, pour atteindre l’équilibre $Q_R\left(x=x_f\right)=K$ il faut une quantité de matière des produits plus importante car $Q_R$ est inversement proportionnel à $n(A)$.
La quantité de matière des produits plus importante, le rendement est supérieure au rendement de la réaction 1.
Bilan
12. Indiquer le protocole le plus intéressant parmi les trois en justifiant.
Le protocole le plus intéressant est le protocole 2 car le rendement est maximal et on garde des proportions steochiometriques.
