Asie 2022 Sujet 2
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2JA1
Sujet et corrigé
Mots-clés: quantité de matière, conductivité, constante d’équilibre.
Le dihydrogène H2(g) est envisagé pour remplacer l’essence dans les moteurs à explosion, ou pour alimenter les piles à combustible, car son oxydation ne produit que de l’eau. Cependant, le dihydrogène pose certaines difficultés techniques : il est gazeux à température ambiante et hautement inflammable.
Une alternative consiste à « stocker » le dihydrogène en le faisant réagir avec du dioxyde de carbone pour former de l’acide formique, lequel est liquide et peu inflammable aux températures et pressions ambiantes. Pour récupérer le dihydrogène en vue de son utilisation, la transformation inverse est réalisée.
Dans cette perspective, des chercheurs de l’université de Rice (Etats-Unis) ont récemment trouvé un procédé catalytique permettant de produire de l’acide formique à bas coût.
Voici deux extraits parus dans des articles de vulgarisation scientifique :
Document 1. De l’acide formique dans le moteur.
« (…) Un litre d’acide formique contient plus de 53 grammes d’hydrogène, contre à peine 28 grammes pour un même volume d’hydrogène pur, pressurisé à 350 bar. »
D’après : www.enerzine.com
Document 2. Production de l’acide formique.
« (…) Avec leur réacteur actuel, les ingénieurs de l’université de Rice ont généré de l’acide formique, (…), en solution aqueuse contenant à peu près 30 % en masse d’acide formique, soit environ 7,0 mol·L-1 ».
D’après : www.futura-science.fr
Données :
- Loi des gaz parfaits : 𝑃 𝑉 = 𝑛 𝑅 𝑇, où 𝑃 est la pression du gaz en Pa, 𝑉 son volume en m3, 𝑛 sa quantité de matière en mol, 𝑇 sa température en K et 𝑅 la constante des gaz parfaits, 𝑅 = 8,314 J. K−1 · mol−1.
- 1 bar = 105 Pa
- 1 m3 = 103 L
- Conversion de température : 𝑇(K) = 𝜃(°C) + 273,15
- Masse molaire moléculaire de l’acide formique : 𝑀1 = 46,0 g · mol−1
- Masse molaire moléculaire du dihydrogène : 𝑀2 = 2,0 g · mol−1
- Masse volumique de l’acide formique pur à 25 °C : 𝜌 = 1,22 g·mL−1
- Préfixes utilisés pour la nomenclature :
| Nombre d’atomes de carbone | 1 | 2 | 3 | 4 | 5 |
| Préfixe | méth- | éth- | prop- | but- | pent- |
Partie A – Intérêt de l’acide formique pour le stockage du dihydrogène
L’objectif de cette partie A est d’étudier l’intérêt de l’acide formique pour le stockage du dihydrogène par rapport au stockage du gaz sous pression.
1. La formule semi-développée de l’acide formique est donnée ci-contre.
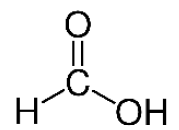
Justifier que cet acide se nomme acide méthanoïque dans la nomenclature officielle.
Acide méthanoïque :
méthan : 1 atome de carbone
acide ….. oïque : COOH
2. Vérifier qu’un litre de dihydrogène à la pression 𝑃 = 350 bar et à la température 𝜃 = 25 °C contient une masse 𝑚 = 28 g de dihydrogène. On supposera que ce gaz obéit à l’équation des gaz parfaits dans ces conditions de température et de pression.
$$n=\frac{m}{M}$$
$$m=n \times M$$
Or
$$PV=nRT$$
$$n=\frac{PV}{RT}$$
D’ou
$$m=\frac{PV}{RT} \times M$$
$$m=\frac{350{.10}^5 \times 1,0{.10}^{-3}}{8,314 \times \left(25+273,15\right)} \times 2,0$$
$$m=28\ g$$
Pour récupérer le dihydrogène à partir de l’acide formique, on réalise une transformation dont l’équation de réaction est :
HCOOH (l) → H2(g) + CO2(g)
Cette transformation est considérée comme totale.
3. Vérifier qu’un litre d’acide formique permet de produire 53 g de dihydrogène, comme indiqué dans le document 1.
$$n_{HCOOH}^i=\frac{m_{HCOOH}}{M_{HCOOH}}$$
Or
$$\rho_{HCOOH}=\frac{m_{HCOOH}}{V_{HCOOH}}$$
$$m_{HCOOH}=\rho_{HCOOH} \times V_{HCOOH}$$
D’ou
$$n_{HCOOH}^i=\frac{\rho_{HCOOH} \times V_{HCOOH}}{M_{HCOOH}}$$
$$n_{HCOOH}^i=\frac{1,22 \times 1,0{.10}^3}{46,0}$$
$$n_{HCOOH}^i=26,5\ mol$$
Construisons un tableau d’avancement :
| $HCOOH_{(l)}$ | $\rightarrow H_{2(g)}$ | $+ CO_{2(g)}$ | |
| État initial | $n_{HCOOH}^i=26,5$ | 0 | 0 |
| État intermédiaire | 26,5 -x | x | x |
| État final | 26,5 -xf=0 | xf | xf |
La réaction est considérée comme totale : $x_{max}=x_f$
$$26,5 -x_f=0$$
$$x_f=26,5\ mol$$
$$n_{H_2}=\frac{m_{H_2}}{M_{H_2}}$$
$$m_{H_2}=n_{H_2} \times M_{H_2}$$
Or $n_{H_2}=x_f$
$$m_{H_2}=x_f \times M_{H_2}$$
$$m_{H_2}=26,5 \times 2,0$$
$$m_{H_2}=53\ g$$
4. Citer deux avantages de l’acide formique pour le stockage du dihydrogène par rapport au stockage du gaz sous pression.
Deux avantages :
Le stockage est plus sûr car l’acide formique n’est pas hautement inflammable contrairement au dihydrogène.
Stockage plus facile : l’acide formique est liquide contrairement au dihydrogène qui a besoin d’être stocké sous pression.
Partie B – Contrôle de la teneur en acide formique d’une solution aqueuse d’acide formique
On met en œuvre une méthode conductimétrique pour contrôler rapidement la teneur en acide formique d’une solution aqueuse d’acide formique préparée par les chercheurs de l’université de Rice.
À cet effet :
- On dilue 100 fois la solution aqueuse S0 d’acide formique préparée par les chercheurs. On obtient une solution fille S1 de concentration 𝐶1.
- On prélève un volume 𝑉1 = 1,00 L de cette solution S1.
- On réalise une mesure de la conductivité de la solution S1. L’équation de la réaction acido-basique de l’acide formique avec l’eau est :
HCOOH(aq) + H2O ⇆ HCOO−(aq) + H3O+(aq) (réaction 1)
En vue de relier la conductivité à la concentration, on fait les hypothèses suivantes :
- On néglige l’effet de l’autoprotolyse de l’eau.
- On suppose que les seules espèces contribuant significativement à la conductivité de la solution sont les ions oxonium, H3O+, et les ions formiate, HCOO−.
Données :
- L’acide formique est un acide faible, il appartient au couple acide-base, acide formique / ion formiate : HCOOH / HCOO−
- Constante d’acidité du couple acide-base de l’acide formique 𝐾𝐴 = 1,77 × 10−4
- Conductivités molaires ioniques à 25 °C :
𝜆(H3O+) = 35,0 mS · m² · mol−1 ; 𝜆(HCOO−) = 5,46 mS · m² · mol−1
- Concentration standard : 𝑐0 = 1,00 mol · L−1
5. Exprimer la conductivité 𝜎 de la solution en fonction des concentrations et des conductivités molaires ioniques des ions oxonium et des ions formiate.
$$\sigma=\Sigma_i\lambda_i\left[X_i\right]$$
$$\sigma=\lambda_{H_3O^+}\left[H_3O^+\right]+\lambda_{{\rm HCOO}^-}\left[{\rm HCOO}^-\right]$$
6. En déduire une relation entre 𝜎, 𝜆(H3O+), 𝜆(HCOO−), 𝑉1 et l’avancement 𝑥𝑓 en fin de réaction pour la réaction 1 (𝑥𝑓 en mol).
Construisons un tableau d’avancement :
| $HCOOH_{(aq)}$ | $H_2O_{(l)}$ | $\rightleftarrows \ HCOO_{(aq)}^-$ | ${H_3O}_{(aq)}^+$ | |
| État initial | $n_{HCOOH}^i$ | Solvant | 0 | 0 |
| État intermédiaire | $n_{HCOOH}^i-x$ | Solvant | x | x |
| État final | $n_{HCOOH}^i-x_f=0$ | Solvant | xf | xf |
En fin de réaction :
$$\sigma=\lambda_{H_3O^+}\left[H_3O^+\right]f+\lambda{{\rm HCOO}^-}\left[{\rm HCOO}^-\right]_f$$
$$\left[H_3O^+\right]f=\frac{n{H_3O^+}^f}{V_1}=\frac{x_f}{V_1}$$
$$\left[{\rm HCOO}^-\right]f=\frac{n{{\rm HCOO}^-}^f}{V_1}=\frac{x_f}{V_1}$$
$$\sigma=\lambda_{H_3O^+}\frac{x_f}{V_1}+\lambda_{{\rm HCOO}^-}\frac{x_f}{V_1}$$
$$\sigma=\frac{x_f}{V_1} \times \left(\lambda_{H_3O^+}+\lambda_{{\rm HCOO}^-}\right)$$
La mesure de la conductivité de la solution S1 donne : 𝜎 = 144 mS · m−1 .
7. Montrer que l’avancement en fin de réaction a pour valeur :
𝑥𝑓 = 3,56 × 10−3mol
$$\frac{x_f}{V_1} \times \left(\lambda_{H_3O^+}+\lambda_{{\rm HCOO}^-}\right)=\sigma$$
$$x_f=\frac{\sigma \times V_1}{\lambda_{H_3O^+}+\lambda_{{\rm HCOO}^-}}$$
Remarque : $\sigma$ s’exprime en mS.m⁻¹ et $\lambda$ s’exprime en mS.m².mol⁻¹.
Le volume doit s’exprimer en m³. Or $1\ m^3=10^3\ L$
$$x_f=\frac{144 \times 1,00{ \times 10}^{-3}}{35,0+5,46}$$
$$x_f=3,56{.10}^{-3}\ mol$$
On admet que la constante d’équilibre 𝐾𝐴 peut s’écrire en fonction de l’avancement en fin de réaction 𝑥𝑓 (𝑥𝑓 en mol) sous la forme approchée :
$K_A=\left (\frac{x_f}{V_1}\right)^2 \times \frac{1}{c^0\times C_1} $
8. Déterminer la valeur de la concentration molaire 𝐶1 de la solution 𝑆1 .
$$K_A=\left(\frac{x_f}{V_1}\right)^2 \times \frac{1}{c^0 \times C_1}$$
$$C_1=\left(\frac{x_f}{V_1}\right)^2 \times \frac{1}{c^0 \times K_A}$$
$$C_1=\left(\frac{3,56{.10}^{-3}\ }{1,00}\right)^2 \times \frac{1}{1,00 \times 1,77{.10}^{-4}}$$
$$C_1=7,16{.10}^{-2}\ mol{.L}^{-1}$$
9. En déduire la concentration molaire 𝐶0 de la solution 𝑆0. Comparer qualitativement la concentration obtenue à la teneur en acide formique annoncée dans l’article du document
On dilue 100 fois :
$$C_0=100 \times C_1$$
$$C_0=100 \times 7,16{.10}^{-2}$$
$$C_0=7,16\ mol{.L}^{-1}$$
Document 2 : « soit environ $7,0\ mol{.L}^{-1}$ »
La teneur est celle annoncée dans le document 2.
