Centres étrangers 2022 Sujet 2
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 22-PYCJ2G11
L’acide formique est l’une des rares espèces chimiques dont le nom d’usage dérive d’une espèce animale, cet acide étant secrété par les fourmis pour se défendre des agresseurs. De nos jours, il est synthétisé industriellement et participe à de nombreux usages.

Cet exercice est composé de 3 parties indépendantes
Partie A : Un remède contre les piqûres de fourmi.
Partie B : Dosage d’un produit commercial à base d’acide formique.
Partie C : Synthèse d’un dérivé de l’acide formique utilisé dans l’industrie alimentaire.
Partie A – Un remède contre les piqûres de fourmis
Certaines espèces de fourmis peuvent mordre ou piquer l’épiderme et injecter leur venin qui est une solution aqueuse contenant de l’acide formique. Les piqûres de fourmis entrainent des rougeurs et des démangeaisons et peuvent également provoquer des allergies plus graves.
Afin de calmer les démangeaisons, un remède traditionnel consiste à frotter la partie irritée avec du carbonate de sodium, solide ionique de formule Na2CO3, pour neutraliser l’acide formique.
Données :
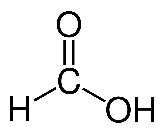
- Formule semi-développée de l’acide formique :
- Couples acide/base :
- Ion hydrogénocarbonate / ion carbonate HCO3 – / CO3 2-
- Acide formique / ion formiate HCOOH / HCOO–
Préfixes utilisés pour la nomenclature :
| Nombre d’atomes de carbone | 1 | 2 | 3 | 4 | 5 |
| Préfixe | méth- | éth- | prop- | but- | pent- |
1. Recopier la formule semi-développée de l’acide formique et entourer le groupe caractéristique justifiant le terme acide dans le nom de cette espèce chimique.
2. Justifier que l’acide formique se nomme acide méthanoïque dans la nomenclature officielle.
3. Écrire l’équation de dissolution du carbonate de sodium dans l’eau.
4. Écrire une équation de réaction qui met en évidence le rôle de l’ion carbonate lors de l’utilisation de ce remède. Préciser ce rôle.
Partie B – Dosage d’un produit commercial contenant de l’acide formique
On se propose de vérifier la qualité d’une solution aqueuse commerciale S0, contenant de l’acide formique, préconisée dans la lutte contre le varroa qui est un parasite tenu pour responsable de l’affaiblissement des colonies d’abeilles.
L’étiquette du flacon de la solution commerciale porte l’indication « 65 % », qui est la valeur du pourcentage en masse d’acide formique contenu dans la solution commerciale.
On souhaite vérifier cette valeur en réalisant un titrage par suivi pH-métrique.
Données :
- Pictogramme visible sur le flacon d’acide formique :

Corrosif
- Densité de la solution S0 d’acide formique : d = 1,15
- Masse volumique de l’eau : 𝜌𝑒𝑎𝑢 = 1 g∙mL-1Masse molaire moléculaire de l’acide formique : M = 46,0 g∙mol-1
- Couples acide / base :
- HCOOH / HCOO–
- H2O / HO–
Concentration de la solution commerciale
5. Montrer que, si l’indication « 65 % » portée sur l’étiquette est exacte, la concentration en acide formique de la solution commerciale a pour valeur C0 = 16,3 mol· L-1.
6. Citer deux règles de sécurité à respecter lors de l’utilisation de cette solution commerciale.
Préparation de la solution à doser
Pour effectuer le titrage, on dispose d’une solution aqueuse titrante d’hydroxyde de sodium (Na+(aq) + HO–(aq)) de concentration en soluté apporté CB = 1,00 x 10-1 mol·L-1.
7. Écrire la réaction support du dosage.
8. Définir l’équivalence et en déduire le volume VB0eq de solution d’hydroxyde de sodium qu’il faudrait verser à l’équivalence pour doser un volume VA = 10 mL de solution commerciale S0. Commenter la valeur de VB0eq.
9. Montrer qu’une dilution au 100ième de la solution S0 permet de réaliser le dosage de VA = 10,0 mL de cette solution diluée notée S1, avec un volume à l’équivalence VB1eq compris entre 15 mL et 20 mL.
Mise en œuvre du titrage pH-métrique d’une solution diluée S1 de S0.
On dose VA = 10,0 mL d’une solution diluée S1 de concentration C1 = C0/100, où C0 est la concentration de la solution S0, à l’aide de la solution aqueuse d’hydroxyde de sodium précédente.
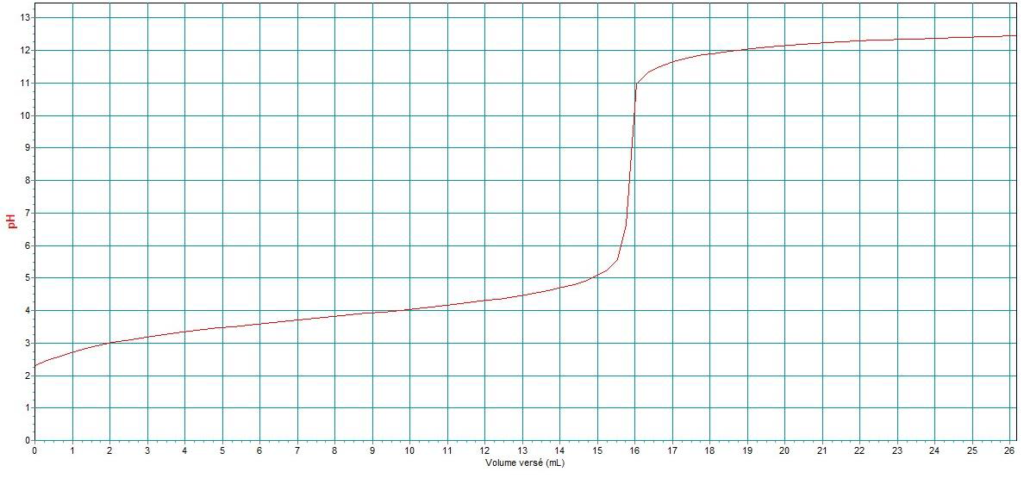
On obtient une courbe pH = f(VB) en annexe page 15/15 à rendre avec la copie, où VB est le volume de la solution d’hydroxyde de sodium versée.
10. Faire un schéma annoté du dispositif utilisé pour réaliser ce titrage.
11. À l’aide de la courbe pH = f(VB), déterminer si la solution d’acide formique S0 est bien une solution à 65 %. Commenter l’écart éventuel avec cette valeur.
Partie C – Synthèse d’un dérivé de l’acide formique utilisé dans l’industrie alimentaire : le formiate d’éthyle
Le formiate d’éthyle est un ester éthylique dérivé de l’acide formique. Il est utilisé comme colorant alimentaire. Sa formule brute est C3H6O2.
Sa synthèse est mise en oeuvre selon le schéma suivant :
Acide formique + éthanol ⇄ formiate d’éthyle + eau
Dans cette partie C, on analyse un protocole expérimental afin de déterminer le rendement et la pureté du produit obtenu.
Données :
| Espèce chimique | Masse molaire (g·mol-1) | Masse volumique (g·mL-1) | Température d’ébullition (°C) | Solubilité dans l’eau | Solubilité dans l’éthanol |
| Acide formique | 46 | 1,22 | 100,7 | Grande | Faible |
| Éthanol | 46 | 0,81 | 78,0 | Grande | *** |
| Formiate d’éthyle | 74 | 0,92 | 54,5 | Faible | Faible |
| Eau | 18 | 1,00 | 100,0 | *** | Grande |
Réalisation de la synthèse
Protocole :
- Placer dans un ballon, sous agitation, 20 mL d’acide formique et 20 mL d’éthanol.
- Ajouter goutte à goutte 2 mL d’acide sulfurique concentré qui joue le rôle de catalyseur.
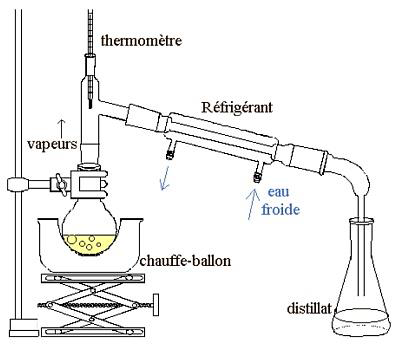
- Réaliser le montage de la figure 1 ci-dessous puis chauffer le mélange à ébullition douce.
Observation :
Quand les premières gouttes de distillat tombent dans l’erlenmeyer, la température θ en tête de colonne a pour valeur : θ = 55 °C.
12. Indiquer le rôle d’un catalyseur comme l’acide sulfurique dans cette synthèse.
13. Donner une raison pour laquelle il est nécessaire de chauffer lors de cette synthèse.
Rendement de la synthèse
14. Montrer que les quantités initiales de réactifs sont égales à :
ni acide formique = 0,53 mol et ni éthanol = 0,35 mol
15. Expliquer l’intérêt d’utiliser un réactif en excès pour la synthèse du formiate d’éthyle.
16. Indiquer la quantité de matière maximale de formiate d’éthyle formée si on suppose que la réaction est totale.
Expérimentalement, on obtient un distillat de masse m = 22,5 g.
On suppose que le distillat est composé uniquement d’ester.
17. En déduire la quantité de matière d’ester obtenue.
18. Exprimer puis calculer le rendement r de cette synthèse.
19. Justifier l’intérêt du montage utilisé pour favoriser le rendement de la synthèse.
On mesure le volume du distillat. On trouve V = 25,1 mL.
20. Déterminer la masse volumique du distillat et émettre une hypothèse sur sa pureté.
Le spectre IR du distillat est donné ci-dessous (figure 2).
21. À partir de l’analyse du spectre, dire si l’hypothèse émise à la question 20 est confirmée ou infirmée et préciser si la valeur du rendement obtenue à la question 18 doit être revue.
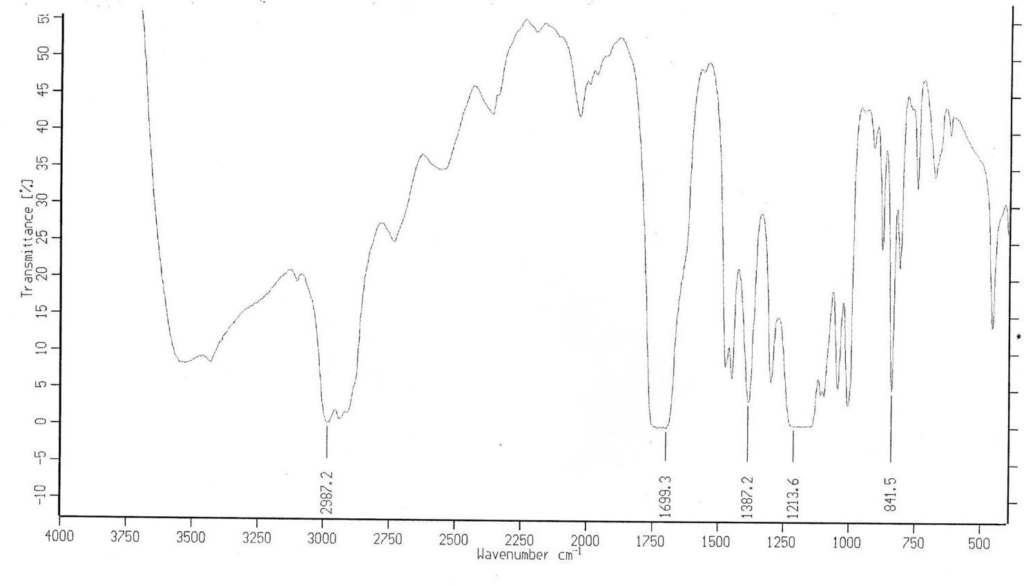
Figure 2. Spectre infrarouge du produit obtenu (distillat)
Données : bandes d’absorption en spectroscopie IR
| liaison | C=O | O-H (acide carboxylique) | C-H | O-H (alcool) |
| Nombre d’onde (cm-1) | 1700-1800 Bande forte et fine | 2500-3200 Bande forte et large | 2800-3000 | 3200-3700 Bande forte et large |
ANNEXE page 15/15 à rendre avec la copie
Évolution du pH en fonction du volume versé d’hydroxyde de sodium VB