Bac Polynésie 2021 Sujet 2
Exercice 1 – (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 21-PYCJ1PO1
Sujet et corrigé
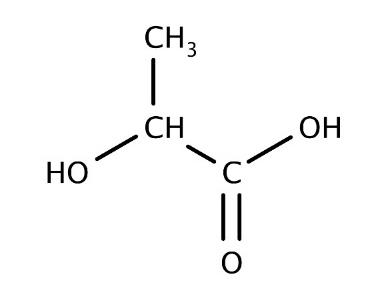
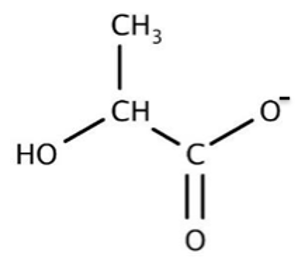
Figure 1. Formule
semi-développée de
l’acide lactique
L’acide lactique ou acide 2-hydroxypropanoïque est un acide carboxylique de formule brute C3H6O3 (figure 1). On le trouve dans le lait mais aussi dans le vin et dans certains fruits et légumes. Obtenu industriellement via des transformations chimiques de réactifs issus de la pétrochimie, l’acide lactique peut également être produit par fermentation à partir de sucres d’origine naturelle. Il est utilisé dans l’industrie alimentaire comme additif (E270) mais aussi en cosmétique et en tant que détergent.
Le but de l’exercice est d’étudier l’acide lactique et les réactions qui l’impliquent en tant que réactif dans des synthèses écoresponsables.
Données :
- Couple acide-base : H3O+/H2O
- Règles de nomenclature dans le cas de composés polyfonctionnels à chaîne non ramifiée :
① Dans un premier temps, on identifie la chaîne principale et le groupe caractéristique principal (cf. tableau 1) puis on numérote la chaîne pour que le carbone fonctionnel ait le plus petit indice possible.
② Ensuite, on nomme l’espèce en remplaçant le « e » final de l’alcane correspondant (cf. tableau 2) par le suffixe correspondant au groupe principal et en ajoutant le préfixe du groupe secondaire. On précise si besoin l’indice de position du groupe caractéristique.
Tableau 1. Suffixes et préfixes utilisés pour désigner quelques groupes importants. Les groupes présentés dans ce tableau sont rangés dans l’ordre décroissant de priorité.
Tableau 2. Nomenclature des alcanes.
| Nombre d’atomes de carbone | 1 | 2 | 3 | 4 | 5 | 6 |
| Nom | méthane | éthane | propane | butane | pentane | hexane |
A. Étude du caractère acide de l’acide lactique.
Le nom de cette molécule en nomenclature officielle est acide 2-hydroxypropanoïque.
A.1. Exploiter les règles de nomenclature fournies dans les données pour justifier son nom.
acide 2-hydroxypropanoïque :
propan : 3 atomes de carbone
acide ……… oïque : présence de la fonction Acide carboxylique (COOH)
hydroxy : présence de la fonction Alcool (OH)
2 : la fonction Alcool (OH) est située sur le 2éme atome de carbone de la chaine principale
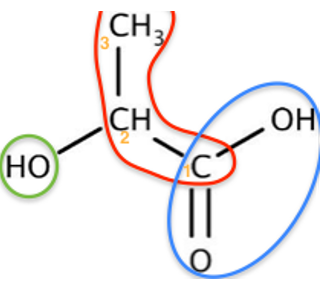
A.2. Donner le schéma de Lewis de l’acide lactique. Sur celle-ci, identifier, en l’entourant, l’atome d’hydrogène responsable de l’acidité de la molécule.
| Atome | Nombre de doublets liants | Nombre de doublets non liants |
| H | 1 | 0 |
| C | 4 | 0 |
| O | 2 | 2 |
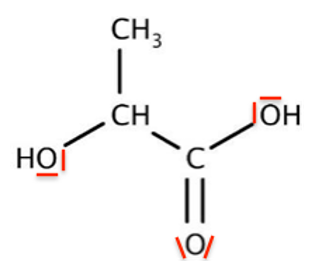
A.3. Écrire la formule semi-développée de l’ion lactate, base conjuguée de l’acide lactique.
Formule semi-développée de l’ion lactate :
On notera, par la suite, HA l’acide lactique et A– l’ion lactate. La valeur du pH d’un lait est égale à 6,4.
Donnée : La valeur de la concentration standard c° est égale à 1 mol∙L–1.
A.4. Pour ce lait, calculer la valeur de la concentration en ion oxonium [H3O+]eq .
$$[H_3O^+]{eq}=c^0\times10^{-pH}$$
$$[H_3O^+]{eq}=1\times10^{-6,4}$$
$$[H_3O^+]_{eq}=4,0\times10^{-7}\ mol.L^{-1}$$
A.5. Établir l’équation de réaction de l’acide lactique (HA) avec l’eau. Exprimer la constante d’acidité KA du couple acide HA/A– .
$$HA_{(aq)}+H_2O_{(l)}\rightleftarrows A^-{(aq)}+H_3O^+{(aq)}$$
$$K_a=\frac{[A^-]{eq}\times[H_3O^+]{eq}}{[HA]_{eq}\times c^0}$$
A.6. À partir de l’expression de la constante d’acidité KA du couple HA/A–, retrouver la relation : $pH=pK_A+ log\left (\frac{ [A^-]_{eq}}{[HA]_{eq}}\right)$
$$K_a=\frac{[A^-]{eq}\times[H_3O^+]{eq}}{[HA]{eq}\times c^0}$$
Or
$$pK_a=-\log(K_a)$$
$$-\log(K_a)=-\log\left(\frac{[A^-]{eq}\times[H_3O^+]{eq}}{[HA]{eq}\times c^0}\right)$$
$$pK_a=-\log\left(\frac{[A^-]{eq}}{[HA]{eq}}\right)-\log\left(\frac{[H_3O^+]{eq}}{c^0}\right)$$
$$pK_a=-\log\left(\frac{[A^-]{eq}}{[HA]{eq}}\right)+pH$$
$$pH=pK_a+\log\left(\frac{[A^-]{eq}}{[HA]_{eq}}\right)$$
Donnée : La valeur du pKA du couple HA/A– est égale à 3,9.
A.7. Calculer, à partir de la relation de la question 6, le rapport $\frac{ [A^-]_{eq}}{[HA]_{eq}}$ dans ce lait dont la valeur du pH est égale à 6,4. En déduire l’espèce prédominante.
$$pH=pK_a+\log\left(\frac{[A^-]{eq}}{[HA]{eq}}\right)$$
$$\log\left(\frac{[A^-]{eq}}{[HA]{eq}}\right)=pH-pK_a$$
$$10^{\log\left(\frac{[A^-]{eq}}{[HA]{eq}}\right)}=10^{pH-pK_a}$$
$$\frac{[A^-]{eq}}{[HA]{eq}}=10^{pH-pK_a}$$
$$\frac{[A^-]{eq}}{[HA]{eq}}=10^{6,4-3,9}=316$$
Donc
$$[A^-]{eq}=316[HA]{eq}$$
L’espèce prédominante est donc A⁻.
A.8. Tracer le diagramme de prédominance du couple HA/A–.
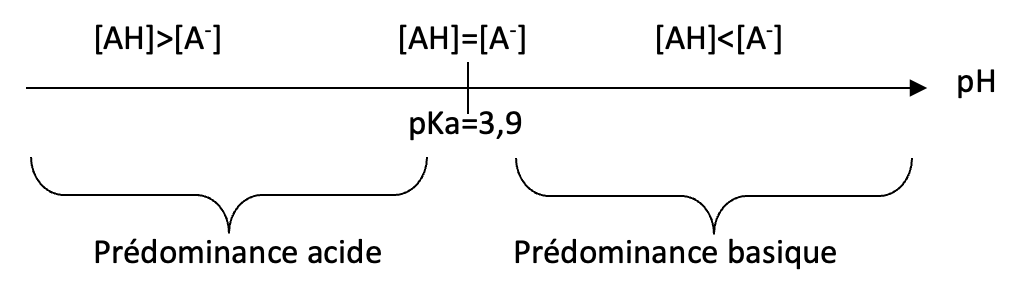
A.9. À l’aide du diagramme de prédominance, vérifier que l’espèce prédominante pour ce lait est en accord avec la réponse à la question 7.
D’après le diagramme, lorsque pH=6,4 , l’espèce prédominante est A–. C’est en accord avec la question 7.
On donne ci-dessous le spectre infrarouge de la molécule d’acide lactique (figure 2).
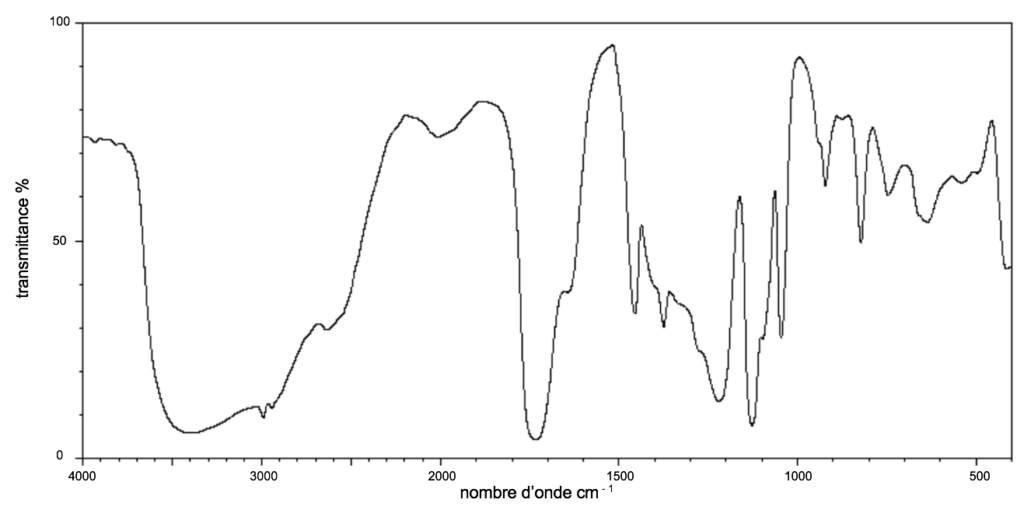
Figure 2. Spectre infrarouge de la molécule d’acide lactique.
Donnée :
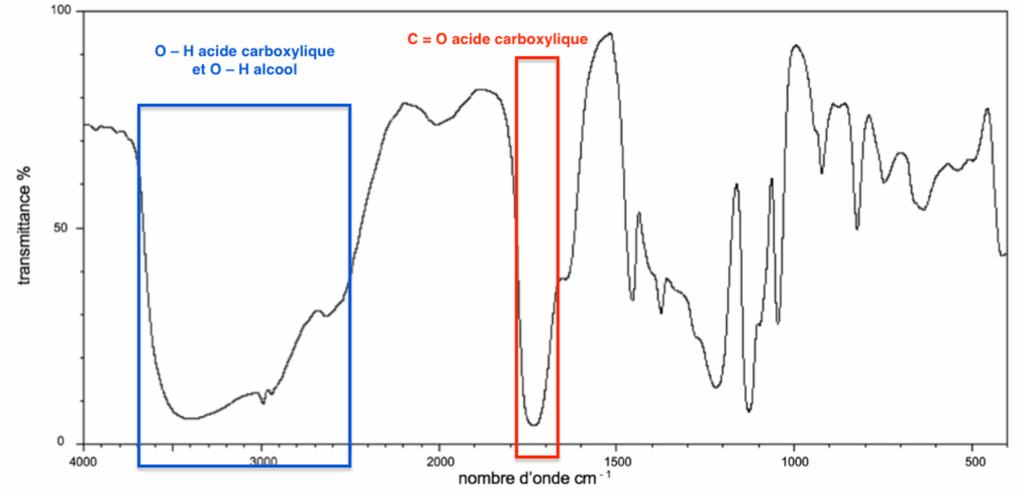
- Table spectroscopique infrarouge simplifiée :
| Liaison | Nombre d’onde (cm–1) | Intensité |
| O – H alcool libre | 3500 – 3700 | forte, fine |
| O – H alcool lié | 3200 – 3400 | forte, large |
| O – H acide carboxylique | 2500 – 3200 | forte à moyenne, large |
| C = O ester | 1700 – 1740 | forte |
| C = O amide | 1650 – 1740 | forte |
| C = O aldéhyde et cétone | 1650 – 1730 | forte |
| C = O acide carboxylique | 1680 – 1710 | forte |
A.10. Utiliser le spectre de la figure 2 et la table spectroscopique infrarouge simplifiée afin de justifier la présence de deux liaisons caractéristiques de la molécule d’acide lactique.
B. La synthèse du lactide.
Issu de l’acide lactique, le lactide est d’origine naturelle et renouvelable. L’équation de synthèse du lactide est donnée ci-dessous :
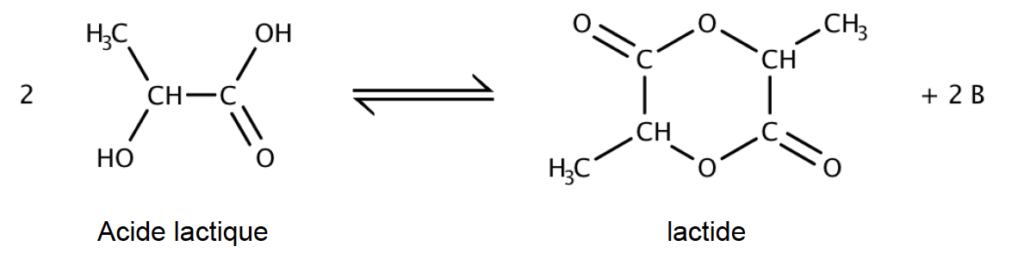
B.1. Identifier, en justifiant, la molécule notée B produite lors de la réaction.
| Atomes | Réactifs | Produits (Hors 2B) |
| C | 6 | 6 |
| O | 6 | 4 |
| H | 12 | 8 |
Il manque 2 atomes d’oxygène et 4 atomes d’hydrogène dans les produits à répartir dans 2B.
D’où B est constitué 1 atome d’oxygène et 2 atomes d’hydrogène.
La formule de B est donc : H2O
B.2. Écrire la formule topologique de la molécule de lactide.
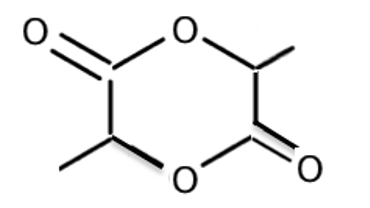
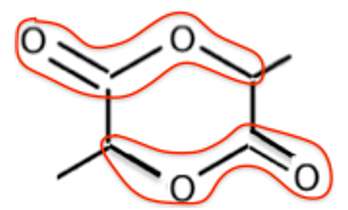
B.3. Sur cette formule topologique, entourer et nommer la fonction chimique présente dans la molécule de lactide.
Il y a 2 fois la fonction ester.
C. L’acide lactique : réactif de la synthèse du lactate d’éthyle
Document 1 : Synthèse d’un solvant agrosourcé : le lactate d’éthyle.
Les solvants constituent une classe de substances largement utilisées dans de nombreux secteurs économiques ou ils jouent des rôles divers. Ce sont des liquides capables de dissoudre, de diluer ou d’extraire d’autres composés sans engendrer de modifications chimiques. Cependant, les solvants traditionnels sont généralement des composés organiques volatils, nocifs pour la santé et pour l’environnement. Dans ce contexte, de nouveaux solvants, non toxiques et biodégradables, sont apparus sur le marché.
Le lactate d’éthyle est l’un de ces solvants agrosourcés. Il est produit par estérification de l’acide lactique avec l’éthanol (produit par fermentation de sucres). Un problème majeur de cette réaction est qu’elle est équilibrée. Pour obtenir un rendement correct, il est donc nécessaire de déplacer l’équilibre. Ceci est notamment possible en utilisant un excès d’éthanol.
Une autre solution est d’ajouter au milieu réactionnel un solvant insoluble dans l’eau dans lequel le lactate d’éthyle est plus soluble que dans la phase de départ (acide lactique, éthanol). D’après https://patents.google.com/patent/WO2011107712A1/fr
Le lactate d’éthyle est synthétisé par action de l’éthanol sur l’acide lactique. L’eau constitue un sous-produit de la réaction. L’équation de la réaction est donnée ci-dessous :
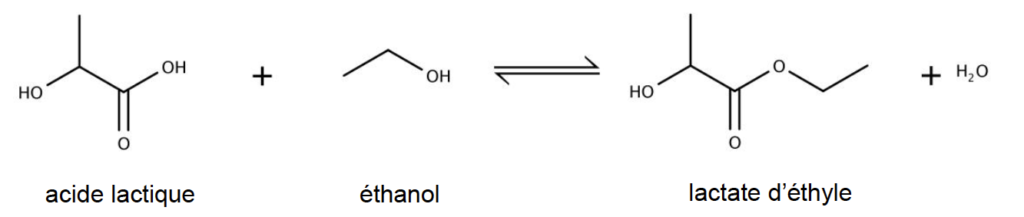
Cette estérification est réalisée selon deux modes opératoires :
Procédé a.
La synthèse de lactate d’éthyle est réalisée dans un ballon équipé d’un réfrigérant. Les quantités suivantes de réactifs sont introduites dans le réacteur : 66,7 g d’éthanol et 39,1 g d’acide lactique. 0,33 g d’acide sulfurique est ajouté aux réactifs. Le milieu réactionnel est agité au moyen d’un agitateur magnétique et porté à la température de 80 °C. Le rendement en lactate d’éthyle en fonction de la durée de la réaction est représenté sur la figure 4.
Procédé b.
La synthèse de lactate d’éthyle est réalisée de la même manière que pour le procédé a mais en ajoutant un solvant d’extraction aux réactifs. Le rendement en lactate d’éthyle en fonction de la durée de la réaction est représenté sur la figure 4.
D’après https://patents.google.com/patent/WO2011107712A1/fr
On obtient les résultats suivants :
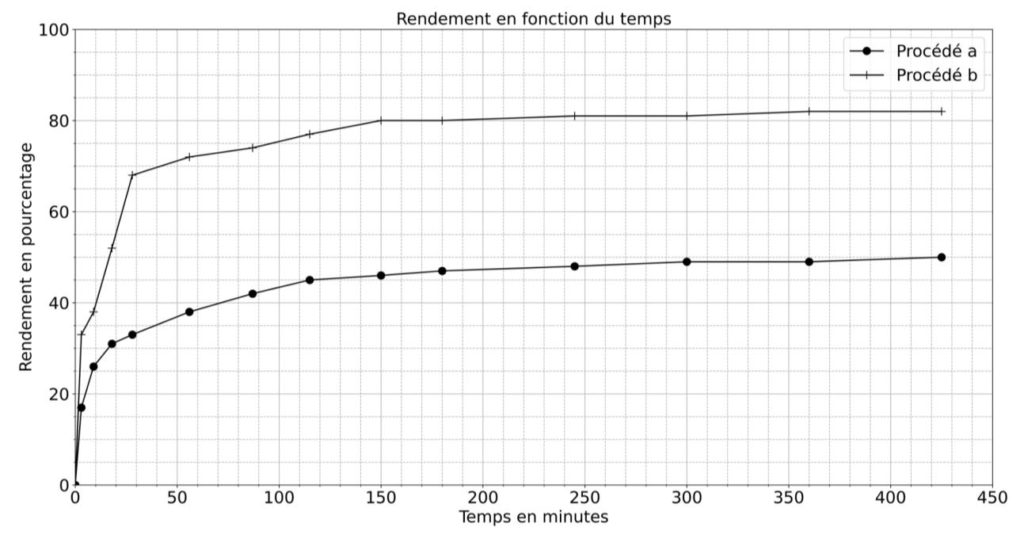
Figure 4. Évolution temporelle du rendement de la réaction d’estérification suivant le procédé a ou b.
Données :
- Caractéristiques physiques de quelques espèces chimiques :
| Acide lactique | Éthanol | Lactate d’éthyle | |
| Masse molaire (g∙mol–1) | 90,0 | 46,0 | 118 |
| Masse volumique (g∙cm–3) | 1,25 | 0,789 | 1,03 |
- Solubilités dans le solvant d’extraction utilisé lors de la synthèse du lactate d’éthyle :
| Acide lactique | Éthanol | Lactate d’éthyle | Eau | |
| Solubilité dans le solvant d’extraction ajouté dans le procédé b | insoluble | insoluble | soluble | insoluble |
C.1. Vérifier par calcul que l’éthanol est en excès dans les procédés a et b décrits précédemment.
Les quantités de matière d’éthanol et d’acide lactique sont identiques dans les procédés a et b.
$$n_{éthanol}^i=\frac{m_{éthanol}}{M_{éthanol}}$$
$$n_{éthanol}^i=\frac{66,7}{46,0}=1,45\ mol$$
$$n_{acide\ lactique}^i=\frac{m_{acide\ lactique}}{M_{acide\ lactique}}$$
$$n_{acide\ lactique}^i=\frac{39,1}{90,0}=0,434\ mol$$
Voici ton expression divisée par 1 à chaque terme (ce qui ne change pas sa valeur, mais correspond à ta demande littérale) :
$$\frac{n_{éthanol}^i}{1} > \frac{n_{acide\ lactique}^i}{1}$$
L’éthanol est en excès dans les procédés a et b.
C.2. Calculer la masse de lactate d’éthyle mlac que l’on pourrait obtenir si la transformation chimique était totale.
$$n_{lactate\ d’éthyle}^{max}=n_{acide\ lactique}^i$$
$$m_{lactate\ d’éthyle}=n_{lactate\ d’éthyle}^{max}\times M_{lactate\ d’éthyle}$$
$$m_{lactate\ d’éthyle}=0,434\times118=51,2\ g$$
C.3. En utilisant la figure 4, comparer les rendements obtenus par les deux procédés et indiquer le procédé le plus efficace.
Le procédé a permet un rendement de 50% et le procédé b un rendement de 82%.
Le procédé b est donc le plus efficace.
C.4. Donner l’expression du quotient de la réaction Qr d’estérification étudiée.
$$Q_r=\frac{[lactate\ d’éthyle]\times [eau]}{[acide\ lactique]\times [éthanol]}$$
C.5. Le lactate d’éthyle étant plus soluble dans le solvant introduit dans le procédé b que dans la phase de départ (acide lactique, éthanol), justifier que l’ajout d’un solvant lors de la synthèse du lactate d’éthyle permet de déplacer l’équilibre de la réaction d’estérification.
Pour la question suivante, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Le lactate d’éthyle étant plus soluble dans le solvant introduit dans le procédé b que dans la phase de départ (acide lactique, éthanol), sa concentration dans le milieu réactionnel est nulle et Qr=0 à tout moment de la réaction.
Ainsi, l’ajout d’un solvant lors de la synthèse du lactate d’éthyle permet de déplacer l’équilibre de la réaction d’estérification.
C.6. Certains solvants organiques sont nocifs pour la santé et dangereux pour l’environnement : ils peuvent dégrader la qualité de l’air ou encore contaminer les nappes phréatiques, les eaux de surface et les sols.
28 millions de tonnes de solvants organiques sont produits chaque année. Évaluer le volume d’éthanol nécessaire à la substitution de 80 % en masse des solvants organiques par des solvants agrosourcés.
On fera l’hypothèse que la totalité du solvant agrosourcé produit est du lactate d’éthyle obtenu par le procédé b décrit précédemment. Comparer cette valeur au volume d’éthanol produit annuellement dans le monde : 120 milliards de litres.
Avec un rendement de 100 % :
$$n_{acide\ lactique}^i=n_{lactate\ d’éthyle\ produit}$$
Or, d’après la question C.1, l’éthanol est introduit en excès.
$$n_{éthanol}^i=1,45\ mol \quad \text{et} \quad n_{acide\ lactique}^i=0,434\ mol$$
Calculons la proportion d’éthanol par rapport à l’acide lactique :
$$\frac{n_{éthanol}^i}{n_{acide\ lactique}^i}=\frac{1,45}{0,434}=3,34$$
$$n_{éthanol}^i=3,34\times n_{acide\ lactique}^i$$
$$n_{acide\ lactique}^i=\frac{n_{éthanol}^i}{3,34}$$
D’où :
$$\frac{n_{éthanol}^i}{3,34}=n_{lactate\ d’éthyle\ produit}$$
$$n_{éthanol}^i=3,34\times n_{lactate\ d’éthyle\ produit}$$
« On fera l’hypothèse que la totalité du solvant agrosourcé produit est du lactate d’éthyle obtenu par le procédé b décrit précédemment. »
Nous avons donc un rendement de 80 % :
$$\frac{80}{100}n_{éthanol}^i=3,34\times n_{lactate\ d’éthyle\ produit}$$
Or $n=\frac{m}{M}$ et $m=\rho V$ donc $n=\frac{\rho V}{M}$
Ainsi :
$$\frac{80}{100}\frac{\rho_{éthanol}V_{éthanol}}{M_{éthanol}}=3,34\times\frac{m_{lactate\ d’éthyle}}{M_{lactate\ d’éthyle}}$$
$$V_{éthanol}=3,34\times m_{lactate\ d’éthyle}\times\frac{M_{éthanol}}{\rho_{éthanol}M_{lactate\ d’éthyle}}\times\frac{100}{80}$$
« 28 millions de tonnes de solvants organiques sont produits chaque année. Évaluer le volume d’éthanol nécessaire à la substitution de 80 % en masse des solvants organiques par des solvants agrosourcés. »
Soit :
$$m_{lactate\ d’éthyle}=0,8\times28\times10^6\times10^6=2,24\times10^{13}\ g$$
$$V_{éthanol}=3,34\times\frac{2,24\times10^{13}\times46,0}{0,789\times118}\times\frac{100}{80}$$
$$V_{éthanol}=4,62\times10^{13}\ mL=4,62\times10^{10}\ L=46,2\ milliards\ de\ litres$$
Comparer cette valeur au volume d’éthanol produit annuellement dans le monde : 120 milliards de litres.
$$\frac{46,2}{120}=0,385=38,5%$$
Ce volume correspond à 38,5 % du volume d’éthanol produit annuellement dans le monde.
