Bac Amérique du nord 2021 Sujet 1
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1AN1
Sujet et corrigé
Mots clés : familles fonctionnelles ; couple acide-base ; facteurs cinétiques ; vitesse volumique d’apparition d’un produit ; incertitude-type.
L’acide lactique, obtenu par fermentation du glucose par exemple, est à la base de nombreux dérivés utilisés dans l’industrie, proposant ainsi une alternative à la pétrochimie.
L’un de ces dérivés, le lactate d’éthyle, est un ester ; il est utilisé comme additif alimentaire, dissolvant pour vernis, dégraissant de pièces métalliques…
Données
Formule brute de l’acide lactique : C3H6O3
Masse molaire de l’acide lactique : M = 90,0 g·mol-1
Formule topologique de l’acide lactique :
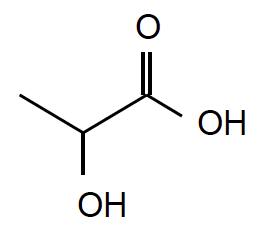
A. L’acide lactique ou acide 2-hydroxypropanoïque
A.1. Identifier et nommer les familles fonctionnelles présentes dans la molécule d’acide lactique.
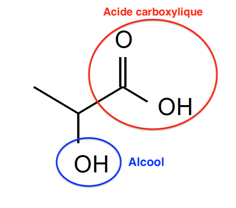
A.2. Représenter la formule topologique de l’isomère de position de l’acide lactique.
Isomère de position de l’acide lactique : Seul la fonction hydroxyle peut changer de position car la fonction carboxyle occupe toujours la 1ère position.
On souhaite mesurer le pKA du couple acide lactique/ion lactate.
L’équation de la réaction modélisant la transformation acido-basique entre l’acide lactique et l’eau est : C3H6O3(aq) + H2O(ℓ) ⇄ C3H5O3–(aq) + H3O+(aq)
A.3. Identifier les deux couples acide-base mis en jeu dans cette transformation.
Les deux couples acide-base mis en jeu dans cette transformation.
C3H6O3(aq) / C3H5O3–(aq)
H3O+(aq) / H2O(ℓ)
A.4. Montrer que la constante d’acidité KA du couple de l’acide lactique peut s’exprimer sous la forme :
$K_A=\frac{[H_3O^+]^2}{(C_A-[H_3O^+])C^0}$
avec C concentration en acide apporté et c° = 1 mol·L-1 la concentration standard.
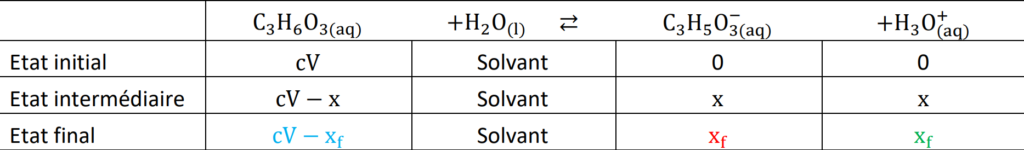
$K_A=\frac{[C_3H_6O_3^-]_{eq} \times [H_3O^+]_{eq}}{[C_3H_6O_3]_{eq} \times C^0}$
Or, d’après le tableau d’avancement :
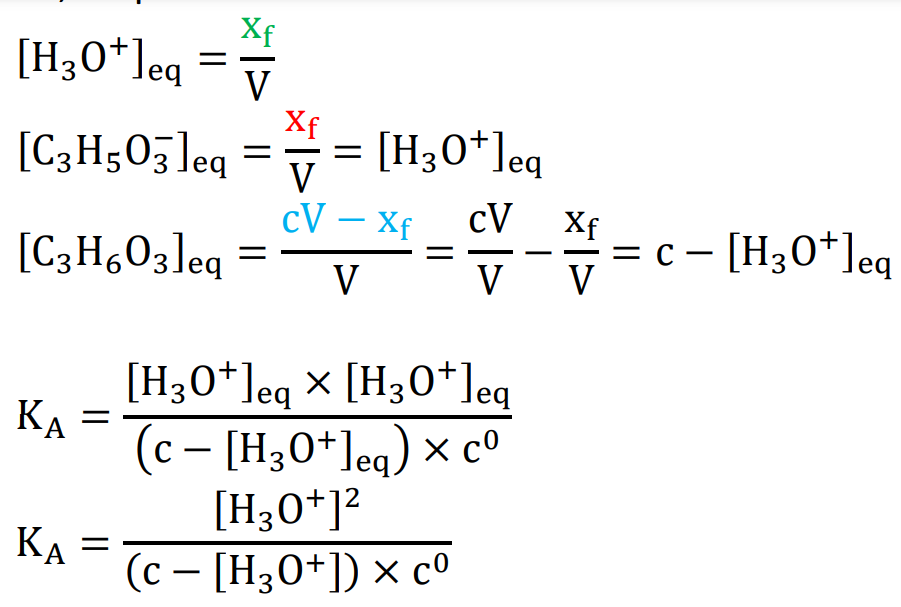
On mesure le pH d’une solution aqueuse d’acide lactique, de concentration en acide apporté
C = 8,00 × 10-3 mol·L-1 . On obtient : pH = 3,03.
A.5. Calculer la concentration en quantité de matière d’ions oxonium H3O+(aq) de cette solution.
$[H_3O^+]=C^0 \times 10^{-pH} }$
$[H_3O^+]=1 \times 10^{-3,03} }$
$[H_3O^+]=9,33 \times 10^{-4} mol.L^{-1}$
A.6. Justifier que l’acide lactique n’est pas un acide fort.
Pour un acide fort, l’acide réagit totalement avec l’eau :$[H_3O^+]=c$
Ici $[H_3O^+]<c$, l’acide n’a pas réagit totalement avec l’eau, c’est un acide faible.
A.7. En déduire la valeur de la constante d’acidité KA puis la valeur du pKA.
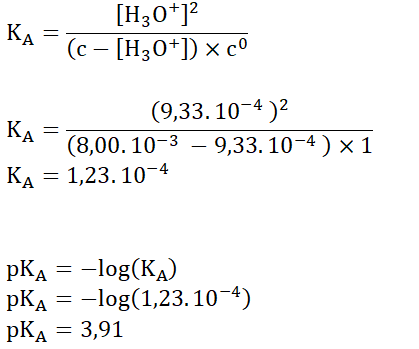
On effectue une série de douze mesures du pH de la solution aqueuse d’acide lactique, de concentration en acide apporté C = 8,00 × 10-3 mol·L-1.
Le traitement statistique des résultats de ces mesures aboutit à une valeur moyenne du pKA, notée pKAm, de 3,871667 avec une incertitude-type, notée u(pKA), de 0,026935.
A.8. Écrire, avec un nombre adapté de chiffres significatifs, le résultat de la mesure pKAm.
pKAm=3,87±0,03
Le diagramme de distribution suivant du couple de l’acide lactique est construit en utilisant la valeur de référence pKAref = 3,90 du pKA du couple de l’acide lactique.
Diagramme de distribution du couple de l’acide lactique
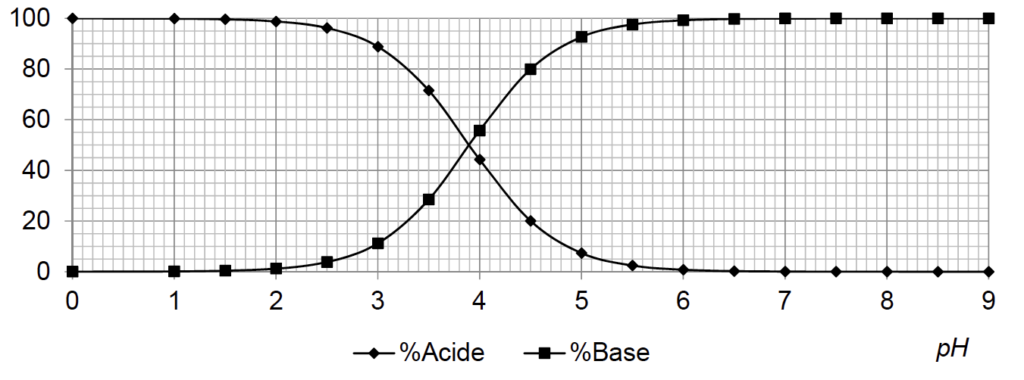
A.9. Expliquer et justifier la méthode permettant de retrouver sur le diagramme de distribution la valeur pKAref.

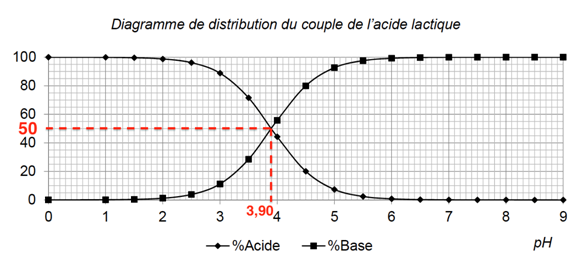
A.10. Comparer, en prenant appui sur un calcul, le résultat pKAm de la mesure avec la valeur de référence pKAref.
Calculons l’écart relatif :
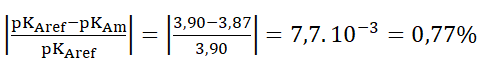
L’écart est faible : la valeur mesurée est proche de la valeur de référence.
B. Estérification de l’acide lactique
Le lactate d’éthyle peut être synthétisé à partir de l’acide lactique et de l’éthanol. L’équation de réaction d’estérification associée à cette transformation est la suivante :
C3H6O3 (ℓ) + C2H6O (ℓ) ⇄ C5H10O3 (ℓ) + H2O (ℓ)
Pour étudier l’influence de différents paramètres sur cette transformation, on fait réagir deux systèmes chimiques identiques de même volume mais dans des conditions différentes.
| Mélange initial | Protocole | |
| Expérience (a) | 0,741 mol d’acide lactique et 0,850 mol d’éthanol | Chauffage à reflux à 80 °C |
| Expérience (b) | 0,741 mol d’acide lactique, 0,850 mol d’éthanol et quelques gouttes d’acide sulfurique concentré | Chauffage à reflux à 80 °C |
Par une succession de dosages à différents instants, on peut suivre l’évolution temporelle de la transformation. On obtient alors les deux courbes suivantes :
Quantité d’ester formé nester au cours du temps
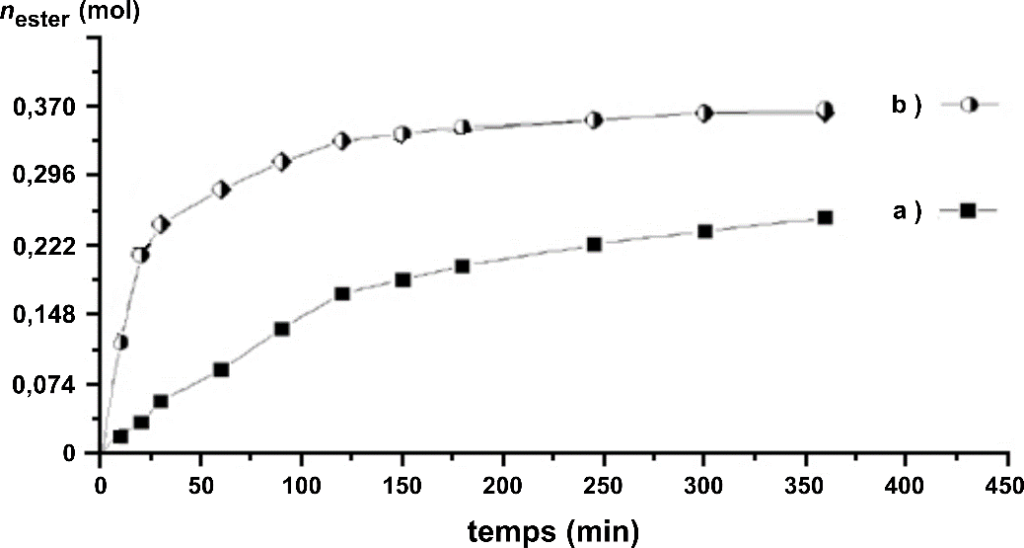
Source : D’après CNRS
On note V, le volume du milieu réactionnel, supposé constant.
B.1. Exprimer la vitesse volumique v d’apparition de l’ester.
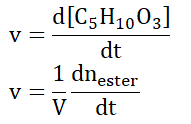
B.2. En analysant qualitativement la courbe (b), indiquer l’évolution de la vitesse volumique v d’apparition de l’ester.
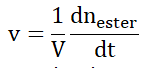
La dérivée correspond au coefficient directeur de la tangente.
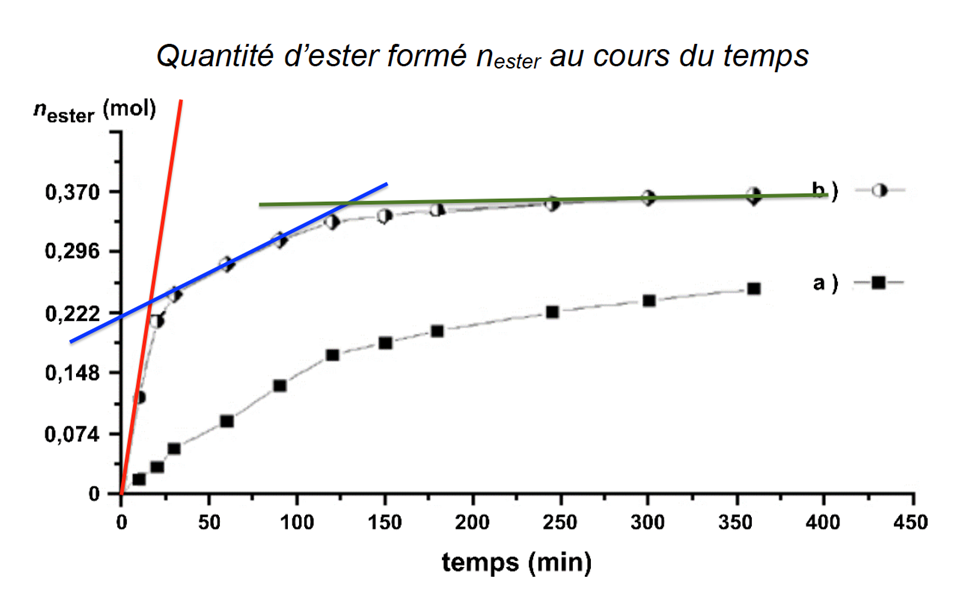
Au cours du temps le coefficient directeur de la tangente diminue, la vitesse de formation de l’ester diminue au cours du temps.
B.3. En analysant qualitativement la courbe (b), indiquer l’évolution de la vitesse volumique v Identifier le rôle joué par l’acide sulfurique.
L’acide sulfurique n’apparait pas dans l’équation de réaction. De plus, en sa présence (expérience b), la réaction est plus rapide : l’acide sulfurique est un catalyseur.
B.4. Indiquer, en argumentant, si pour l’expérience (a) l’état final est atteint au bout de 350 min.
Les expériences a et b ont les mêmes quantités initiale de réactifs. La seule différence est la présence d’un catalyseur dans l’expérience b.
Ainsi, les deux expériences conduiront au même état final $n_{ester}^{final a}=n_{ester}^{final b}$ , b étant plus rapide que a.
Au bout de 350 min, $n_{ester}^{final a}<n_{ester}^{final b}$ , l’état final n’est pas atteint.
