Bac Centres étrangers 2021 Sujet 2
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ2G11
Mots-clés : couples acide-base, titrage avec suivi pH-métrique.
« L’ammoniaque » est une solution obtenue en dissolvant du gaz ammoniac, NH3(g), dans l’eau. Cette solution est présente dans de nombreux produits d’entretien.
On dispose d’une bouteille « d’ammoniaque » achetée dans le commerce dont l’étiquette précise : « Ammoniaque concentration 13% ».
« 13% » correspond au titre massique de la solution commerciale en ammoniac.

On souhaite mettre en œuvre un protocole permettant de déterminer la concentration en ammoniac dans la solution commerciale.
Données à 25°C :
- Masse molaire de l’ammoniac : M(NH3) = 17,0 g⋅mol−1
- Produit ionique de l’eau : Ke = 1,0 ⋅ 10−14
- Densité de la solution d’ammoniaque commerciale : d = 0,97
- pKa = − log Ka
- couple acide-base : NH4+(aq)/NH3(aq), pKa = 9,2
- NH4+ est la formule chimique de l’ion ammonium
Étude préliminaire : étude du couple ion ammonium/ammoniac
L’ammoniac est très soluble dans l’eau.
1. Préciser si l’ammoniac est un acide ou une base en solution aqueuse. Justifier.
2. Écrire l’équation de la réaction modélisant la transformation mise en jeu entre l’ammoniac dissous, NH3 (aq), et l’eau.
3. Donner la valeur de la constante d’acidité Ka 𝑎 du couple NH4+(aq)/NH3(aq).Rappeler la relation la liant, à l’équilibre, aux concentrations des espèces.
4. Tracer le diagramme de prédominance du couple NH4+(aq)/NH3(aq).
5. Expliquer comment retrouver le pKa du couple NH4+(aq)/NH3(aq) à partir du diagramme de distribution représenté en figure 1.
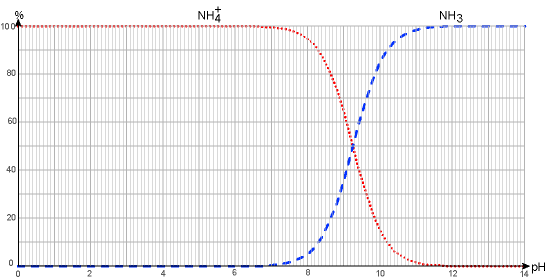
figure 1 : diagramme de distribution du couple NH4+(aq)/NH3(aq) en fonction du pH
Concentration attendue en ammoniac dans la solution commerciale
6. À partir de la donnée figurant sur l’étiquette, montrer que la concentration en quantité de matière de l’ammoniac dans la solution commerciale est de l’ordre de 7,4 mol. L−1.
Titrage de la solution « d’ammoniaque » commerciale
La solution S0 de la bouteille « d’ammoniaque » étant trop concentrée pour réaliser le titrage, une solution Sd, 100 fois moins concentrée est préparée et on réalise un titrage suivi par
pH-métrie de cette solution diluée.
- On prélève un volume Vd = 10,0 mL de solution Sd.
- On titre ce prélèvement par une solution d’acide chlorhydrique (H3O+(aq), Cl−(aq)) de concentration CA = (5,00 ± 0,02) × 10−2 mol⋅L−1.
Les résultats des mesures effectuées au cours du titrage et leur exploitation sont présentés dans la figure 2.
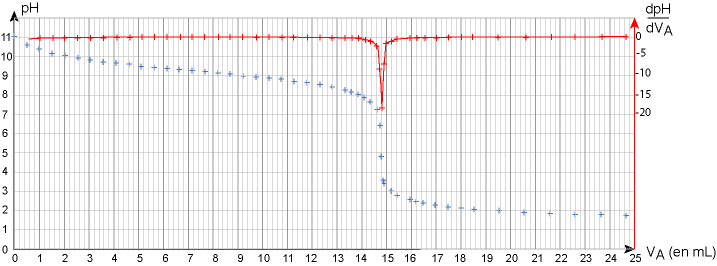
figure 2 : évolution du pHet de sa dérivée en fonction de VA
7. À partir des résultats expérimentaux,
– déterminer la valeur du pH de la solution Sd ;
– déterminer l’espèce de couple ammonium/ammoniac prédominante au début du titrage, et celle prédominante à la fin du titrage ;
– en déduire que l’équation de la réaction acide-base support du titrage est la suivante :
NH3(aq) + H3O+(aq) → NH4+(aq) + H2O(ℓ)
8. Définir l’équivalence du titrage et déterminer le volume équivalent 𝑉𝐸 de ce titrage.
9. Déterminer la valeur de la concentration Cd en ammoniac dans la solution Sd.
Les incertitudes-types sur les volumes prélevés sont estimées à 0,2 mL.
Par ailleurs, l’incertitude-type u(Cd) sur la concentration Cd se déduit des grandeurs mesurées par :
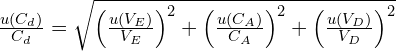
Enfin, dans ces conditions expérimentales, le rapport entre la concentration 𝐶 de la solution S0 de la bouteille « d’ammoniaque » et son incertitude u(𝐶) est considéré comme étant le même qu’entre la concentration Cd de la solution diluée Sd et son incertitude u(Cd) :
![]()
10. Déterminer la valeur de l’incertitude-type u(𝐶) sur la concentration en ammoniac de la solution S0 commerciale. Écrire le résultat de la mesure de cette concentration 𝐶 avec son incertitude.
11. Confronter la valeur de la concentration déterminée expérimentalement avec l’indication de l’étiquette de la bouteille « d’ammoniaque » commerciale. Commenter.
