Bac Métropole Mars 2021 Sujet 2
Exercice 1 – (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet et corrigé
EXERCICE 1 commun à tous les candidats (10 points) L’AQUARIUM RÉCIFAL

Depuis décembre 2019, le Parc Zoologique de Paris accueille un requin bambou. Il vit dans un aquarium qui cherche à reproduire l’environnement naturel de cette espèce.
Cet aquarium, dit récifal, est un bac marin destiné à héberger un écosystème très riche : coraux, crustacés et nombreux poissons tous originaires des eaux peu profondes des côtes de Madagascar. Cet écosystème est complexe et fragile. Plusieurs paramètres sont à contrôler pour maintenir l’équilibre du milieu et assurer le bien-être des différentes espèces vivantes qui y cohabitent.
Le but de cet exercice est d’étudier l’influence de certains de ces paramètres, pH et salinité, ainsi que des méthodes de traitement de l’eau.
Données à 25 °C :
- couples acide/base associés au dioxyde de carbone dissous (CO2, H2O)(aq) :
- (CO2, H2O)(aq)/HCO3–(aq) : pKA1 = 6,4 ;
- HCO3–(aq)/CO32–(aq) : pKA2 = 10,3 ;
- masse molaire atomique de l’ion chlorure : M(Cℓ –) = 35,5 g·mol–1 ;
- conductivités molaires ioniques :
| Ion | Ag+ | NO3– | Na+ | Cℓ – |
| λ (mS⋅m2⋅mol-1) | 6,19 | 7,14 | 5,01 | 7,63 |
- numéros atomiques et électronégativités :
| Hydrogène | Carbone | Oxygène | |
| Z (numéro atomique) | 1 | 6 | 8 |
| χ (électonégativité) | 2,20 | 2,55 | 3,44 |
1. Régulation de l’acidité
Dans un aquarium, le pH de l’eau est une grandeur à surveiller. Sa valeur doit rester proche d’une valeur optimale qui dépend des espèces vivantes présentes. Pour l’aquarium récifal, le pH optimal vaut 8,1.
En journée, la photosynthèse végétale augmente naturellement le pH, qui diminue ensuite pendant la nuit. Les différentes espèces vivantes de l’aquarium peuvent s’acclimater à des variations de la valeur du pH si elles restent faibles.
1.1. Indiquer ce qui peut être mis en œuvre si la valeur du pH devient trop élevée dans l’aquarium. On peut considérer que l’eau de l’aquarium se comporte comme une solution tampon.
Si pH devient trop élevé, il faut baisser sa valeur.
Or $pH=-\log\funcapply(\frac{\left[H_3O^+\right]}{c^0})$
Il faut donc que $\left[H_3O^+\right]$ augmente.
Pour cela on peut ajouter de l’acide.
1.2. Citer les propriétés d’une solution tampon. Justifier l’utilisation d’une telle solution dans l’aquarium récifal.
Les solutions tampons sont des solutions ou le pH ne varie presque pas lors d’une dilution modérée ou d’un ajout modéré d’acide ou de base.
D’après le sujet : « Sa valeur doit rester proche d’une valeur optimale qui dépend des espèces vivantes présentes »
L’utilisation d’une telle solution dans l’aquarium récifal est idéale pour que le pH ne varie pas.
Un diffuseur permet de réguler précisément la valeur du pH de l’aquarium en injectant au besoin du dioxyde de carbone à l’état gazeux dans l’aquarium.
Le dioxyde de carbone, CO2(g), se dissout faiblement dans l’eau de l’aquarium. Il devient du dioxyde de carbone dissous (CO2, H2O)(aq) qui peut se dissocier partiellement en ions hydrogénocarbonate HCO3–(aq) CO32–(aq) et en ions carbonate CO32–(aq).

(http://www.aquarium-aquariophilie.com)
Le schéma de Lewis de la molécule de dioxyde de carbone et celui de la molécule d’eau sont donnés ci- dessous.
1.3. En s’appuyant notamment sur les électronégativités des atomes, justifier la faible solubilité du dioxyde de carbone dans l’eau.
Une molécule est polaire si deux conditions sont réunies :
- Elle contient au moins une liaison polarisée
- Le barycentre (centre géométrique) des charges positives G+ est différent du barycentre des charges négatives G–.
Si ces deux conditions ne sont pas réunies, la molécule est apolaire.
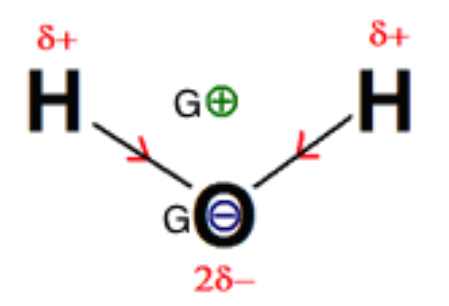
L’eau : $\mathcal{X}_H<\mathcal{X}_O$ , les liaisons OH sont donc polarisées.
Les barycentres des charges positives et des charges négatives ne sont pas confondus. La molécule est polaire.
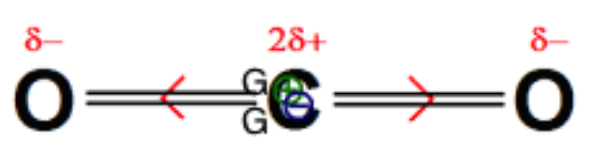
Le dioxyde de carbone : $\mathcal{X}_C<\mathcal{X}_O$ , les liaisons CO sont donc polarisées.
Les barycentres des charges positives et des charges négatives sont confondus. La molécule est apolaire.
Une molécule apolaire se dissout mal dans un solvant polaire ce qui explique la faible solubilité du dioxyde de carbone dans l’eau
1.4. Indiquer, parmi les espèces acido-basiques associées au dioxyde de carbone dissous, celles qui sont des acides de Brönsted et celles qui sont des bases de Brönsted.
$$CO_2,H_2O_{(aq)}/{\rm HCO}_{3(aq)}^- : CO_2,H_2O_{(aq)} acide , {\rm HCO}_{3(aq)}^- base$$
$${\rm HCO}_{3(aq)}^-/{\rm CO}_{3(aq)}^{2-} : {\rm HCO}_{3(aq)}^- acide , {\rm CO}_{3(aq)}^{2-} base$$
${\rm HCO}_{3(aq)}^-$ est une espèce amphotère
1.5. En précisant la démarche suivie, indiquer, parmi les espèces acido-basiques associées au dioxyde de carbone dissous, celle(s) qui prédomine(nt) dans l’aquarium récifal.
Diagramme de prédominance
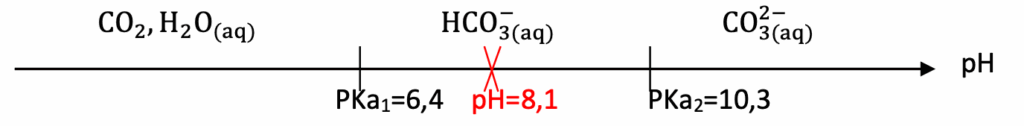
Pour pH=8,1 ${\rm HCO}_{3(aq)}^-$ est prédominant
Le squelette et la coquille des coraux sont constitués de calcaire, c’est-à-dire de carbonate de calcium CaCO3(s), qui se forme suivant une transformation modélisée par l’équation de réaction suivante :
Ca2+(aq) + CO32–(aq) → CaCO3 (s)
1.6. Expliquer pourquoi l’utilisation d’un diffuseur de CO2 dans l’aquarium peut freiner la formation du squelette et de la coquille des coraux.
La formation de coquillage (CaCO3) nécessite la présence de ${\rm CO}_{3(aq)}^{2-}$
Or la diffusion de CO2 , provoque une baisse du pH. Ainsi il y aura une baisse de concentration en ${\rm CO}_{3(aq)}^{2-}$.
La formation du squelette et de la coquille des coraux peut être freinée.
2. Contrôle de la salinité
Dans un aquarium, on trouve notamment des ions chlorure Cℓ–(aq) ainsi que des cations comme les ions sodium Na+(aq).
La salinité de l’eau d’un aquarium est assimilée à la concentration en masse en ion chlorure Cℓ–(aq). Celle de l’aquarium récifal doit être comprise entre 19,3 et 19,6 g·L-1.
Pour contrôler la salinité de l’eau de l’aquarium étudié, on se propose de réaliser le titrage des ions chlorure. Pour cela, on prélève de l’eau de l’aquarium que l’on dilue d’un facteur 10, puis on titre 10,0 mL de cette solution à laquelle on a ajouté 200 mL d’eau distillée, par une solution de nitrate d’argent (Ag+(aq) ; NO3– (aq)) de concentration égale à 5,00×10–2 mol⋅L–1.
Le titrage est suivi par conductimétrie. L’équation de la réaction support du titrage est :
Ag+(aq) + Cℓ–(aq) → AgCℓ(s)
On obtient la courbe de suivi du titrage de la figure 1.
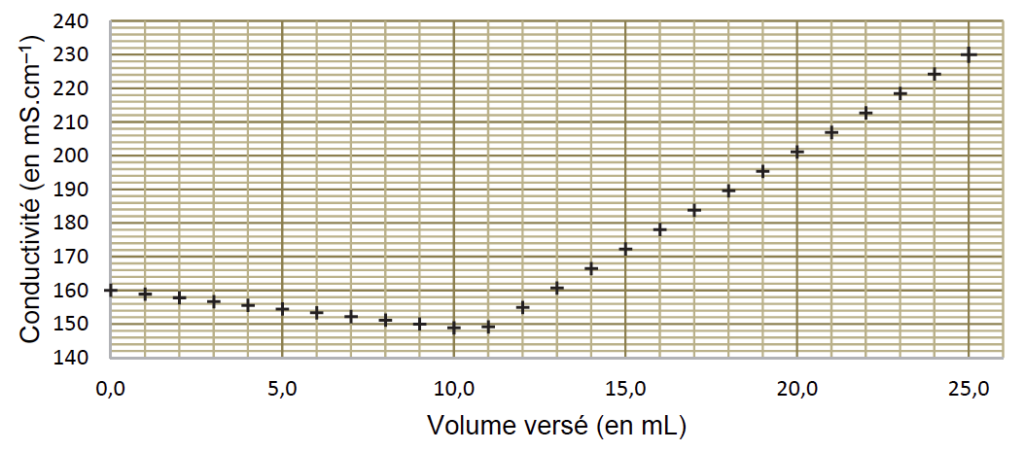
2.1. Justifier qualitativement l’évolution de la pente de la courbe lors du titrage.
Ag+ (aq) + Cl− (aq) → AgCl(s)
| Ions | Avant l’équivalence |
| Ag+ | 0 |
| Cl− | ↘ |
| NO3– | ↗ |
Avant l’équivalence :
- Les ions Ag+ sont ajoutés et consommés immédiatement, ils constituent le réactif limitant, la concentration des ions Ag+ est nulle.
- Les ions Cl− sont consommés, la concentration des ions Cl− diminue.
- Les ions NO3– sont ajoutés, ils ne réagissent pas, la concentration des ions augmente.
Or , diminue donc avant l’équivalence.
| Ions | Après l’équivalence |
| Ag+ | ↗ |
| Cl− | 0 |
| NO3– | ↗ |
Après l’équivalence :
- Les ions Ag+ sont ajoutés et ne sont plus consommés, la concentration des ions Ag+ augmente.
- Les ions Cl− n’existent plus, la concentration des ions Cl− est nulle.
- Les ions NO3– sont ajoutés, ils ne réagissent pas, la concentration des ions augmente.
La concentration des ions augmente, ainsi augmente donc après l’équivalence.
2.2. Indiquer si un traitement de l’eau est nécessaire à l’issue du contrôle de la salinité.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Il faut que $19,3\ g{.L}^{-1}<c_m<19,6\ g{.L}^{-1}$
Trouvons cm :
A l’équivalence :
$$\frac{n_{{\rm Cl}^-}^i}{1}=\frac{n_{{\rm Ag}^+}^{eq}}{1}$$
$$c_d \times V_d=\left[{\rm Ag}^+\right] \times V_{eq}$$
$$c_d=\frac{\left[{\rm Ag}^+\right] \times V_{eq}}{V_d}$$
Par lecture graphique $V_{eq}=11,0\ mL$
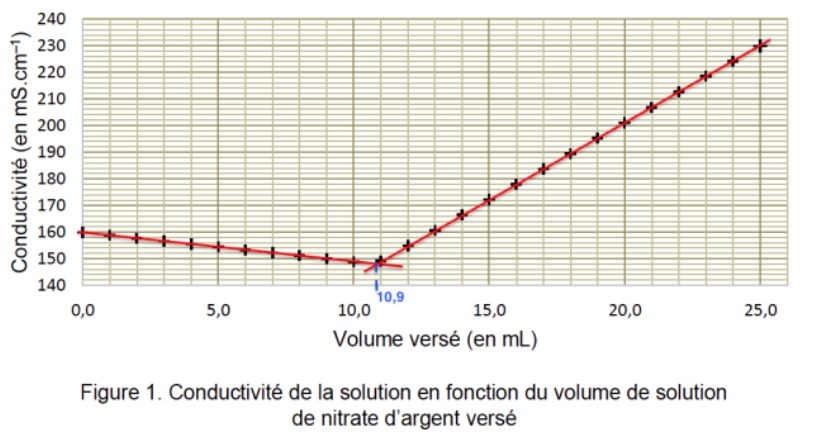
$$c_d=\frac{5,0.{10}^{-2} \times 10,9.{10}^{-3}}{10,0.{10}^{-3}}=5,5.{10}^{-2}mol.L^{-1}$$
Diluée 10 fois : c=10cd
$$c=10c_d=5,5.{10}^{-1}mol.L^{-1}$$
$$c_m=c \times M$$
$$c_m=5,5.{10}^{-1} \times 35,5$$
$$c_m=19,5\ g{.L}^{-1}$$
La valeur de la concentration est dans l’intervalle. Un traitement n’est donc pas nécessaire.
3. Traitement des poissons contre les vers
L’aquarium récifal peut être infesté par différents types de vers qui parasitent les intestins, les branchies ou la peau des poissons. Pour assurer une élimination chimique de ces vers, les poissons doivent être momentanément placés dans un bassin de quarantaine dans lequel est ajouté un vermifuge.
Le praziquantel est une espèce chimique qui entre dans la composition d’un vermifuge utilisé en aquariophilie, vendu en animalerie en solution liquide, de concentration en masse de 10,0 g·L–1.
En 2010, un procédé de synthèse du praziquantel impliquant trois étapes a été proposé, ce qui le rend plus éco- responsable et moins onéreux. L’étape 1 conduisant à l’obtention de la molécule A n’est pas présentée ici.
3.1. L’étape 2, représentée ci-dessous, permet de transformer les réactifs A (C9H9N), B, C et D (C4H11O2N) en produit E (C21H32O4N2) et produit F.

La formule développée du réactif B est représentée ci-contre :
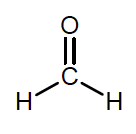
3.1.1. Justifier que la molécule B se nomme méthanal en nomenclature officielle.
1 atome de carbone : méthan
C=O en bout de chaine famille des aldéhydes, terminaison al
D’ou son nom méthanal
3.1.2. Donner la formule semi-développée, puis brute du réactif C.
Formule topologique du réactif C :
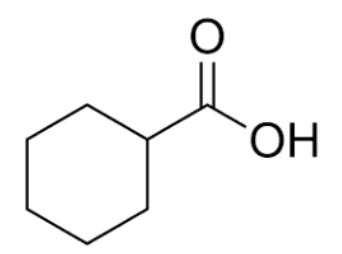
Formule semi développée du réactif C :
Formule brute du réactif C : C7H12O2
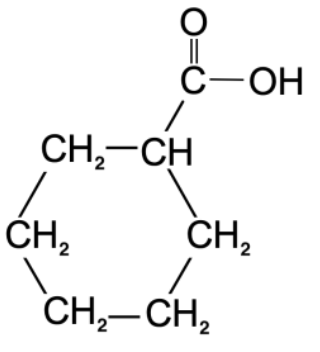
3.1.3. Déterminer le produit F formé à l’issue de l’étape 2 en s’appuyant sur les formules brutes des espèces chimiques mises en jeu.
A+B+C+D→ E+F
| Molécule | Formule Brute | |
| Réactifs | A | C9H9N |
| B | CH2O | |
| C | C7H12O2 | |
| D | C4H11O2N | |
| Produits | E | C21H32O4N2 |
| F | ? |
Conservation des éléments : les atomes présents du coté des réactifs se retrouvent chez les produits.
Réactifs : 21 C, 34 H, 5 O, 2 N
Produits : 21 C, 32 H, 4 O, 2 N et la molécule F.
On en déduit que F est constituée de 2 atomes d’hydrogènes et d’un atome d’oxygène. F à pour formule H2O
La synthèse de 40,9 g de la molécule E nécessite 0,110 mol de chacun des réactifs A, B, C et D. La masse molaire moléculaire de E est M(E) = 376,5 g·mol–1.
3.1.4. Déterminer le rendement de l’étape 2.
$$\eta=\frac{n_{experimentale}}{n_{theorique}}$$
$$n_{experimentale}=\frac{m_{experimentale}}{M_E}$$
Les réactifs sont introduits dans les proportions stœchiométriques, ainsi $n_{theorique}=0,110\ mol$
$$\eta=\frac{m_{experimentale}}{M_E \times n_{theorique}}$$
$$\eta=\frac{40,9}{376,5 \times 0,110}=0,988=98,8%$$
3.2. L’étape 3 permettant de synthétiser le praziquantel nécessite l’utilisation de l’acide méthylsulfonique, noté AMS. Cette étape comporte quatre opérations décrites ci-dessous.
a. 30,0 g de E sont ajoutés à 104,0 mL d’AMS puis l’ensemble est chauffé pendant 6 heures à 70°C. La solution obtenue est versée dans de l’eau glacée ajustée à un pH égal à 8 avec une solution aqueuse d’hydroxyde de sodium.
b. La solution est extraite quatre fois avec de l’éther diéthylique.
c. La phase organique est lavée par 100 mL d’une solution aqueuse salée saturée. La phase organique est ensuite séchée. Après évaporation de l’éther diéthylique, on obtient un solide jaune.
d. Ce résidu est recristallisé dans un mélange équimolaire d’acétate d’éthyle et d’hexane. On obtient un solide blanc.
D’après Dr. Haiping Cao Dr. Haixia Liu Prof. Alexander Dömling https://doi.org/10.1002/chem.201002046
3.2.1. Associer à chacune des opérations a. et c. du protocole un ou plusieurs des mots suivants : dissolution – séparation – purification – transformation chimique
| Opérations | |
| a | Dissolution et transformation chimique |
| c | Séparation |
3.2.2. Nommer une méthode d’identification possible pour le solide obtenu.
Un produit peut être identifié par plusieurs méthodes :
- C.C.M (chromatographie sur couche mince)
- Température de fusion
- Spectre IR
- …
4. Prévention des infections
Vue au microscope électronique des
pores d’un grain de charbon actif
Un aquariophile traite de manière préventive son aquarium contre les infections. Pour cela, il utilise une solution aqueuse antiseptique de bleu de méthylène. Le bleu de méthylène (C16H18CℓN3S) est un colorant faiblement biodégradable, de couleur bleue foncée. L’excès de bleu de méthylène est éliminé par des « filtres » à charbon actif.
Le charbon actif est une poudre noire dont les pores, observables au microscope électronique, permettent notamment de fixer et retenir des molécules organiques. C’est le phénomène d’adsorption.
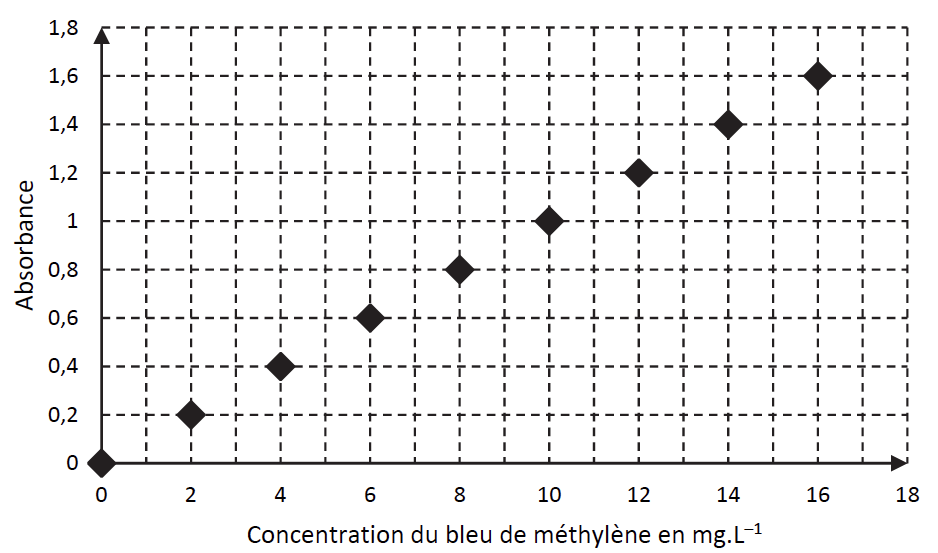
La capacité d’adsorption du charbon actif peut être évaluée à l’aide d’un dosage par étalonnage en suivant le protocole expérimental suivant :
- tracer la courbe d’étalonnage de l’absorbance, à λ= 650 nm, pour des solutions étalon de bleu de méthylène ;
- mesurer l’absorbance d’un échantillon d’eau polluée en bleu de méthylène ;
- prélever un volume V de 50,0 mL d’eau polluée et y ajouter 100,0 mg de charbon actif ;
- agiter le mélange puis filtrer ;
- mesurer l’absorbance de la solution filtrée après traitement au charbon actif.
4.1. Justifier l’intérêt de l’étape de filtration.
Le charbon actif est une poudre noire. Le but de la filtration est de séparer solide et liquide.
Ainsi charbon actif (solide) sera enlevé de la solution pour qu’ils n’interviennent pas lors de la mesure d’absorbance.
Pour les questions suivantes, le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
On applique le protocole précédent et on obtient les résultats suivants :
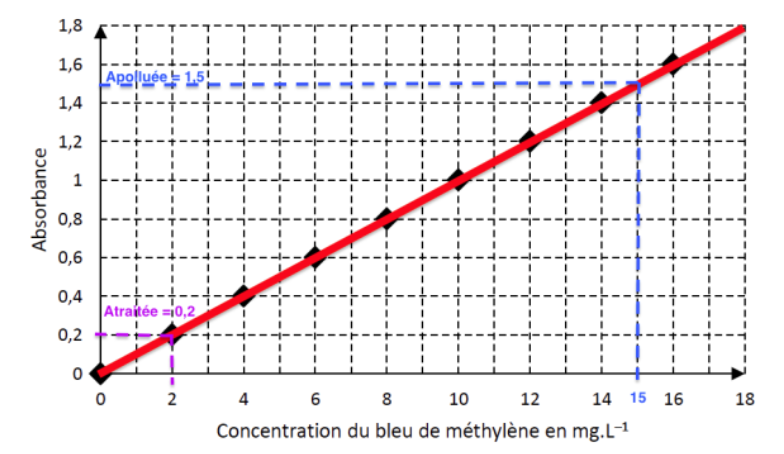
Les valeurs d’absorbance obtenues avant et après traitement de l’eau de l’aquarium pour éliminer l’excès de bleu de méthylène sont Apolluée = 1,5 et Atraitée = 0,2.
4.2. Montrer que la masse ma de colorant adsorbée par gramme de charbon actif est voisine de 7 mg.
$$m_{abs}=m_{avant}-m_{après}$$
Or $m=c_m \times V$
$$m_{abs}=c_{mavant} \times V-c_{maprès}×V$$
$$m_{abs}=(c_{mavant}-c_{maprès})×V$$
Par lecture graphique :
$$c_{mavant}=15,0\ mg{.L}^{-1}$$
$$c_{maprès}=2,0 mg.L^{-1}$$
$$m_{abs}=(15,0 \times {10}^{-3}-2,0 \times {10}^{-3}) \times 50 \times {10}^{-3}$$
$$m_{abs}=6,5 \times {10}^{-4}g=0,65\ mg$$
| Pour 100 mg de charbon actif | $m_{abs}=0,65\ mg$ |
| Pour 1 g de charbon actif | $ m_a$ |
m_a=\frac{1 \times 0,65 \times {10}^{-3}\ }{100 \times {10}^{-3}}=6,5\ g
La masse ma de colorant adsorbée par gramme de charbon actif est voisine de 7 mg.
4.3. Sachant qu’un traitement préventif de l’aquarium, de volume V = 8 000 L, nécessite 1 à 2 mg de bleu de méthylène par litre d’eau, calculer la masse de charbon actif nécessaire afin de réaliser le traitement pour cet aquarium récifal. Commenter.
Un traitement préventif de l’aquarium, de volume V = 8 000 L, nécessite 1 à 2 mg de bleu de méthylène par litre d’eau.
Calculons la masse de bleu de méthylène à éliminer pour l’aquarium :
$$8000 \times 1 \times {10}^{-3}<m<8000 \times 2 \times {10}^{-3}$$
$$8\ g<m<16\ g$$
D’après la question précédente : la masse ma de colorant adsorbée par gramme de charbon actif est voisine de 7 mg.
Calculons la masse de charbon actif nécessaire :
| Pour 1 g de charbon actif | 7 mg |
| x | 8 g |
x=\frac{8 \times 1\ }{7 \times {10}^{-3}}=1,1 \times {10}^3\ g
| Pour 1 g de charbon actif | 7 mg |
| x | 16 g |
$$x=\frac{16 \times 1\ }{7 \times {10}^{-3}}=2,3 \times {10}^3\ g$$
La masse de charbon actif nécessaire est comprise entre 1,1 Kg et 2,3 Kg.
Pour être sûr d’enlever la totalité de bleu de méthylène, on prendra une masse de 2,28 Kg de charbon actif.
