Bac Centres étrangers 2024 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n° 24-PYCG22BIS
Sujet et corrigé
EXERCICE 1 – L’ARÔME D’ANANAS (9 points)
Les esters sont des composants organiques qui ont des arômes souvent agréables et fruités. Ils sont utilisés dans l’industrie alimentaire pour reproduire des arômes de fruits.
Certains arômes de fruits sont obtenus à partir de mélanges d’esters et d’autres espèces. C’est le cas pour l’arôme d’ananas, fruit dont l’odeur est très complexe à reproduire. Son arôme est obtenu en mélangeant plusieurs substances, dont le butanoate d’éthyle qui constitue l’espèce majoritaire du mélange.
Cet exercice s’intéresse aux caractéristiques (rendement, durée) de la synthèse de cet ester afin de chercher à l’optimiser. Les trois parties de cet exercice peuvent être traitées indépendamment les unes des autres.
La synthèse de l’ester « butanoate d’éthyle » est modélisée par l’équation chimique suivante :
1. Caractérisation des réactifs
Les formules chimiques des réactifs A et B sont données dans le document 1.
Document 1 – Données sur les espèces chimiques en jeu dans la transformation
| Noms | Formules chimiques | Caractéristiques physiques | Pictogrammes | |
| Masses molaires et masses volumiques | Températures d’ébullition | |||
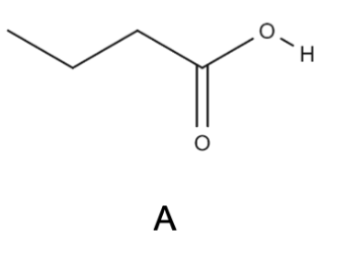
| acide butanoïque A | C4H8O2 | 𝑀A = 88,0 g ∙ mol−1 𝜌A = 0,96 g ∙ mL−1 | 𝑇ébullition = 164 °C | 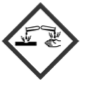 |
| B | C2H6O | 𝑀B = 46,0 g ∙ mol−1 𝜌B = 0,79 g ∙ mL−1 | 𝑇ébullition = 79 °C |  |
| butanoate d’éthyle | C6H12O2 | 𝑀ester = 116 g ∙ mol−1 𝜌ester = 0,88 g ∙ mL−1 | 𝑇ébullition = 121 °C |  |
| eau | H2O | 𝑀eau = 18,0 g ∙ mol−1 𝜌eau = 1,0 g ∙ mL−1 | 𝑇ébullition = 100 °C | |
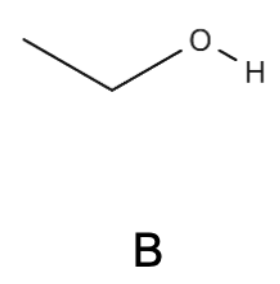
Q1. Nommer le réactif B de la synthèse et donner le nom de la fonction présente dans ce réactif.
Le réactif B à une chaine carbonée comportant 2 atomes de carbone : Ethan
Le réactif B porte un groupe OH : … ol
Nom du réactif B : éthanol.
Nom de la fonction présente dans ce réactif : Fonction hydroxyle (non demandé : famille Alcool)
Q2. Dessiner la représentation de Lewis du réactif A de la synthèse et expliquer pourquoi cette molécule est un acide au sens de Brönsted.
Représentation de Lewis du réactif A :
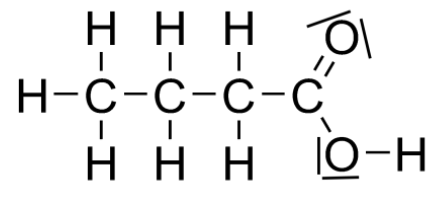
Cette molécule est un acide au sens de Brönsted car elle est capable de céder un proton H+.
Sur l’étagère, deux flacons sans étiquette sont présents, appelés par la suite « flacon 1 » et
« flacon 2 ». L’un d’entre eux contient de l’acide butanoïque, l’autre contient de la butanone. Les spectres infrarouge (IR) du contenu de chaque flacon sont réalisés pour les identifier. Les spectres obtenus sont reproduits dans le document 2.
Q3. À l’aide du tableau des bandes d’absorption du document 2, retrouver parmi les deux spectres « flacon 1 » et « flacon 2 » celui correspondant au réactif A et justifier la réponse.
Document 2 – Bandes d’absorption caractéristiques en infrarouge (IR) et spectres étudiés
| Liaison | Nombre d’onde (cm−1) | Intensité |
| O-H | 2500 à 3200 | forte, large |
| C-H | 2800 à 3000 | moyenne |
| C=O | 1650 à 1750 | forte |
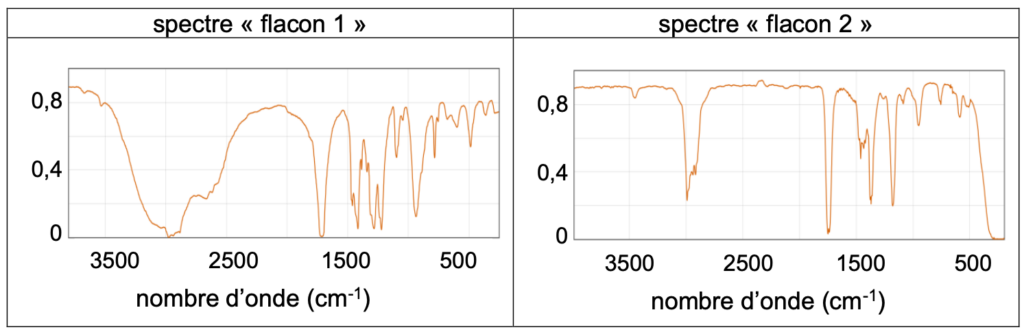
L’un des deux flacons contient de l’acide butanoïque, l’autre contient de la butanone.
Le spectre du flacon 1 présente :
Une bande forte et large entre 2500 et 3200 cm$^{-1}$ caractéristique d’une liaison O-H
Une bande forte vers 1700 cm$^{-1}$ caractéristique d’une liaison C=O
Le spectre du flacon 2 présente :
Une bande moyenne vers 3000 cm$^{-1}$ caractéristique d’une liaison C-H
Une bande forte vers 1700 cm$^{-1}$ caractéristique d’une liaison C=O
L’acide butanoïque est dans le flacon 1 et la butanone est dans le flacon 2.
2. Optimisation du rendement de synthèse
Dans cette partie, on souhaite déterminer le rendement 𝜂 de la synthèse du butanoate d’éthyle effectuée selon le protocole ci-dessous, puis on s’intéresse à sa potentielle optimisation.
Pour réaliser cette synthèse, on introduit dans un ballon un volume 𝑉A = 13,8 mL de réactif A et un volume 𝑉B = 8,8 mL de réactif B correspondant à une quantité de matière
𝑛B = 0,15 mol du réactif B. On chauffe à reflux pendant 30 min dans un bain thermostaté. Après refroidissement, on isole l’ester synthétisé.
Q4. À l’aide du document 1, page 2, indiquer les précautions à prendre lors du prélèvement des réactifs de cette synthèse.
On utilise l’acide butanoïque A comme réactif : il est corrosif. Il faut donc utiliser une blouse, des gants et des lunettes de protection.
On utilise l’éthanol B comme réactif : il est inflammable. Il faut donc s’éloigner du feu ou de toutes sources de chaleur.
On produit du butanoate d’éthyle qui est nocif. Il faut donc travailler sous hôte aspirante.

Q5. Donner deux avantages du chauffage à reflux dans ce type de synthèse.
Le chauffage à reflux permet d’accélérer la réaction sans perte de matière.
Q6. Montrer que la quantité de matière de réactif A utilisé est 𝑛A = 0,15 mol.
$$n_A=\frac{m_A}{M_A}$$
Or
$$\rho_A=\frac{m_A}{V_A}$$
$$\frac{m_A}{V_A}=\rho_A$$
$$m_A=\rho_A\times V_A$$
D’où
$$n_A=\frac{\rho_A\times V_A}{M_A}$$
$$n_A=\frac{0,96\times 13,8}{88,0}$$
$$n_A=0,15\ mol$$
Q7. Indiquer si le mélange réactionnel est stœchiométrique et justifier la réponse.
Calculons la quantité de matière du réactif B :
$$n_B=\frac{\rho_B\times V_B}{M_B}$$
$$n_B=\frac{0,79\times 8,8}{46,0}$$
$$n_B=0,15\ mol$$
Le mélange réactionnel est stœchiométrique si :
$$\frac{n_A}{1}=\frac{n_B}{1}$$
$$\frac{0,15}{1}=\frac{0,15}{1}$$
Ainsi, le mélange réactionnel est stœchiométrique.
Après l’avoir isolé, on pèse l’ester formé, on obtient 𝑚ester = 11,7 g.
Q8. En déduire la valeur de 𝜂, le rendement de cette synthèse.
Calculons la masse d’ester maximale qu’on peut théoriquement atteindre lors de cette synthèse :
$$n_{ester,\ max}=\frac{m_{ester,\ max}}{M_{ester}}$$
$$\frac{m_{ester,\ max}}{M_{ester}}=n_{ester,\ max}$$
$$m_{ester,\ max}=n_{ester,\ max}\times M_{ester}$$
Or
$$n_{ester,\ max}=x_{max}=\frac{n_A}{1}=0,15$$
D’où
$$m_{ester,\ max}=0,15\times 116$$
$$m_{ester,\ max}=17,4\ g$$
Le rendement est défini par :
$$\eta=\frac{m_{ester,\ reel}}{m_{ester,\ max}}$$
$$\eta=\frac{11,7}{17,4}$$
$$\eta=0,67$$
$$\eta=67\ %$$
Q9. Citer deux méthodes permettant d’optimiser le rendement d’une estérification.
Pour optimiser le rendement d’une estérification, on peut :
Mettre un réactif en excès
Éliminer un produit au fur et à mesure de sa synthèse
Une de ces méthodes n’est pas applicable à cette synthèse.
Q10. À l’aide des caractéristiques physiques des espèces chimiques mentionnées dans le document 1, page 2, indiquer quelle méthode n’est pas applicable et justifier pourquoi.
Pour éliminer un produit au fur et à mesure de sa synthèse, il faut que sa température d’ébullition soit inférieure à celle des autres espèces (réactifs et produits).
L’espèce B (l’éthanol) à une température d’ébullition plus basse que le butanoate d’éthyle et que l’eau (les deux produits). Ainsi, la méthode qui consiste à éliminer un produit au fur et à mesure de sa synthèse n’est pas applicable

3. Suivi cinétique de la synthèse par titrage de l’acide A restant
Dans cette partie, on réalise le suivi cinétique de la synthèse de l’ester en comparant deux protocoles afin de déterminer si la cinétique de cette synthèse peut être optimisée par l’ajout d’acide sulfurique.
Dans un premier temps, on étudie la cinétique de la synthèse présentée précédemment, sans ajout d’acide sulfurique concentré.
À l’instant 𝑡0 = 0 s, les réactifs A (𝑉A = 13,8 mL) et B ( 𝑉B = 8,8 mL) sont mélangés dans un ballon placé dans un bain thermostaté.
Afin de réaliser un suivi temporel de la synthèse du butanoate d’éthyle, on titre l’acide butanoïque restant dans le ballon à des dates choisies. Pour cela :
- À chaque date choisie, on prélève un volume 𝑉 = 1,0 mL de mélange réactionnel du ballon que l’on verse dans un bécher.
- Ce dernier est plongé instantanément dans un bain d’eau glacée.
- L’acide butanoïque A restant dans le volume 𝑉 prélevé est titré par de la soude (solution aqueuse d’hydroxyde de sodium contenant les ions Na+ et HO−) de concentration en quantité de matière de soluté apporté 𝐶base = 5,0 × 10−1 mol ∙ L−1.
L’équation support de la réaction du titrage est :
C4H8O2(aq) + HO−(aq) → C4H7O2−(aq) + H2O(𝓁)
On note 𝑛A la quantité de matière d’acide titré et 𝑛base,éq la quantité de matière de base introduite à l’équivalence. On appelle 𝑉éq le volume de soude versé à l’équivalence.
Q11. Définir l’équivalence et donner la relation entre les quantités de matière des réactifs à l’équivalence du titrage.
$$C_4H_8O_2\left(aq\right)+HO^-\left(aq\right)\rightarrow C_4H_7O_2^-\left(aq\right)+H_2O\left(l\right)$$
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques :
$$\frac{n_{C_4H_8O_2}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$$
$$\frac{n_A}{1}=\frac{n_{base,eq}}{1}$$
$$n_A=n_{base,eq}$$
Les résultats expérimentaux des titrages successifs sont donnés ci-dessous. On désigne par 𝑉éq le volume de soude nécessaire au titrage de l’acide butanoïque présent dans le volume 𝑉 de mélange réactionnel à l’instant 𝑡.
| 𝑡 (en min) | 5 | 10 | 15 | 20 | 30 | 45 | 60 |
| 𝑉éq (en mL) | 7,7 | 6,2 | 5,4 | 4,9 | 4,6 | 4,2 | 4,1 |
Pour étudier la cinétique de la synthèse, on souhaite tracer la représentation graphique de la concentration en quantité de matière d’acide butanoïque restant dans le mélange réactionnel, notée [A], en fonction du temps 𝑡.
Q12. Connaissant les valeurs du volume équivalent 𝑉éq en fonction du temps, expliquer comment obtenir les valeurs de la concentration en quantité de matière d’acide butanoïque [A] en fonction du temps 𝑡. Illustrer la démarche en calculant la valeur de [A] à l’instant 𝑡 = 5 min.
$$n_A=n_{base,eq}$$
$$\left[A\right]\times V=C_{base}\times V_{eq}$$
$$\left[A\right]=\frac{C_{base}\times V_{eq}}{V}$$
Pour obtenir les valeurs de la concentration en quantité de matière d’acide butanoïque [A] en fonction du temps $t$, il faut faire le calcul suivant :
$$\left[A\right]=\frac{C_{base}\times V_{eq}}{V}$$
Calculons la valeur de [A] à l’instant $t = 5\ min$ :
$$\left[A\right]=\frac{C_{base}\times V_{eq}}{V}$$
$$\left[A\right]=\frac{5,0\times 10^{-1}\times 7,7}{1,0}$$
$$\left[A\right]=3,9\ mol.L^{-1}$$
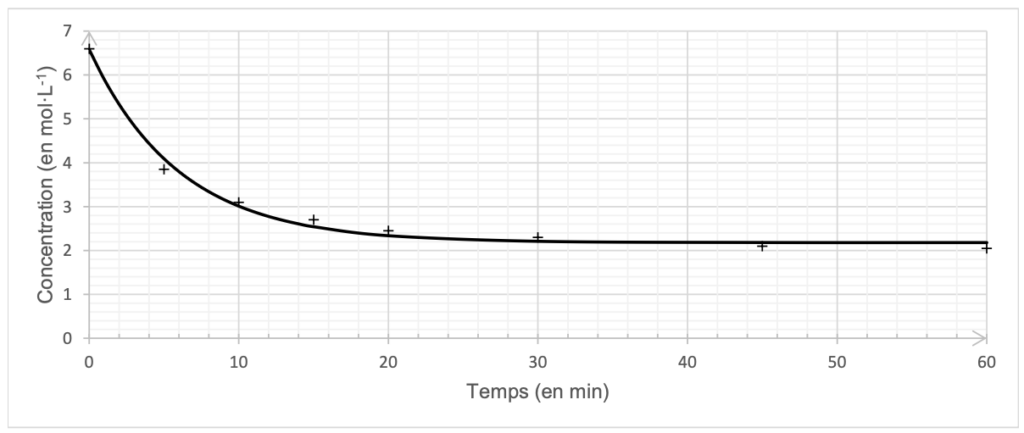
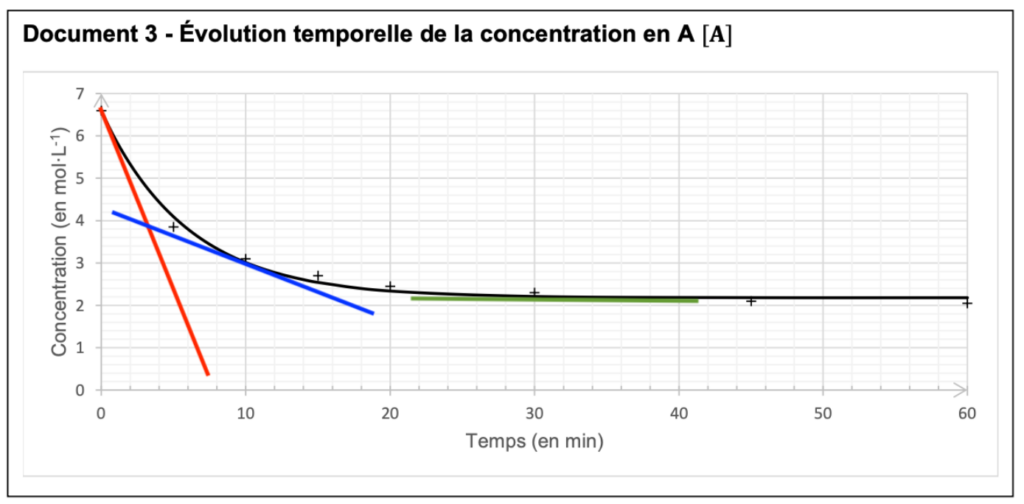
On trace alors la représentation graphique de l’évolution de la concentration en quantité de matière d’acide butanoïque [A] restant au cours de la synthèse du butanoate d’éthyle en fonction du temps 𝑡 (document 3).
Document 3 – Évolution temporelle de la concentration en A [𝐀]
Q13. Donner la définition et l’unité de la vitesse volumique de disparition 𝑣d,A du réactif A lors de la synthèse du butanoate d’éthyle.
La vitesse volumique de disparition $v_{d,A}$ du réactif A lors de la synthèse du butanoate d’éthyle est définie par :
$$v_{d,A}=-\frac{d\left[A\right]}{dt}$$
Avec $v_{d,A}$ en mol.L$^{-1}$.s$^{-1}$
Q14. Déterminer comment la vitesse volumique de disparition du réactif A varie au cours de la synthèse. Justifier sans calcul à l’aide de la courbe du document 3, page 5.
$$v_{d,A}=-\frac{d\left[A\right]}{dt}$$
Graphiquement, la vitesse volumique de disparition $v_{d,A}$ du réactif A est l’opposé (signe moins dans la formule) du coefficient directeur de la tangente à la courbe (dérivée).
En traçant la tangente à la courbe pour différents temps, on observe que la valeur absolue de la pente diminue au cours du temps.
Ainsi, la vitesse volumique de disparition du réactif A diminue au cours de la synthèse.
Dans un second temps, on étudie la synthèse de l’ester, réalisée avec le même mélange initial de réactifs A et B que dans le premier protocole, dans les mêmes conditions de température et de pression mais avec ajout d’acide sulfurique concentré. On admet que la variation du volume total du mélange réactionnel dû à l’ajout d’acide sulfurique est négligeable.
Le document 4 présente l’évolution de la concentration en quantité de matière d’acide butanoïque en fonction du temps dans le cas des deux protocoles de synthèse de l’ester. La courbe 1 correspond à la synthèse sans ajout d’acide sulfurique et la courbe 2 correspond à la synthèse avec ajout d’acide sulfurique.
Document 4 – Évolution temporelle de la concentration en A sans acide sulfurique (courbe 1) et avec acide sulfurique (courbe 2)
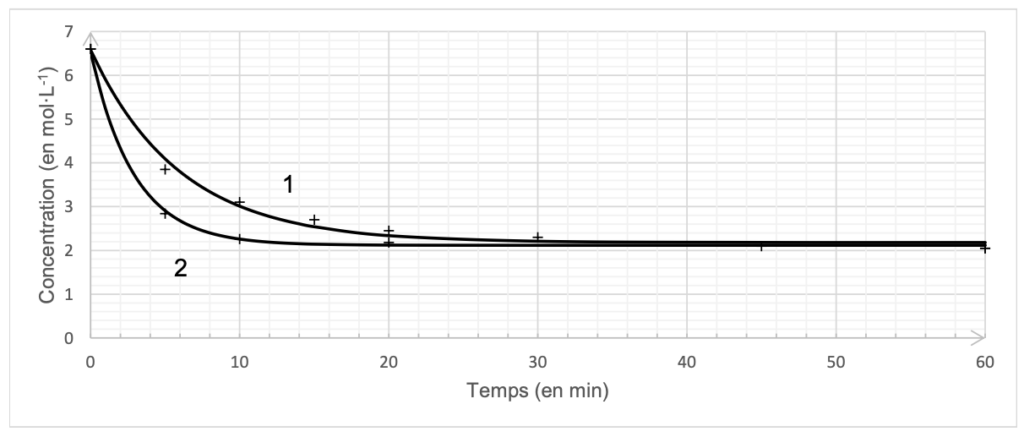
Q15. Déterminer, en justifiant, si l’ajout d’acide sulfurique a permis d’améliorer la cinétique de cette synthèse.
Avec de l’acide sulfurique, la concentration finale en 1 est atteint plus rapidement.
Ainsi, l’ajout d’acide sulfurique a permis d’améliorer la cinétique de cette synthèse car il réduit sa durée.
Q16. Identifier alors le rôle de l’acide sulfurique.
L’acide sulfurique accélère la réaction sans modifier l’état final de la réaction.
Ainsi, l’acide sulfurique joue le rôle de catalyseur de cette réaction.
