Bac Amérique du nord 2025 Sujet 2 Bis
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCPE2
Sujet et corrigé
EXERCICE 1 – L’ATROPINE (9 POINTS)
L’atropine est un antispasmodique employé par l’anesthésiste lorsque le patient présente une bradycardie, une diminution du réflexe vagal ou un rythme cardiaque bas. Elle a pour effet d’augmenter le rythme cardiaque du patient. Elle fait partie de la famille des alcaloïdes, molécules qui comportent un atome d’azote aux propriétés basiques.
L’atropine a été extraite d’une plante : la belladone. De nos jours, de nombreuses molécules isolées de la belladone ont été identifiées et on sait que l’atropine provient d’une réaction au sein de la plante entre l’acide tropique et le tropanol.
L’objectif de cet exercice est d’étudier l’utilisation d’une des formes de l’atropine en milieu hospitalier ainsi que son obtention par extraction et par synthèse.
Données :
- représentation topologique de l’atropine :
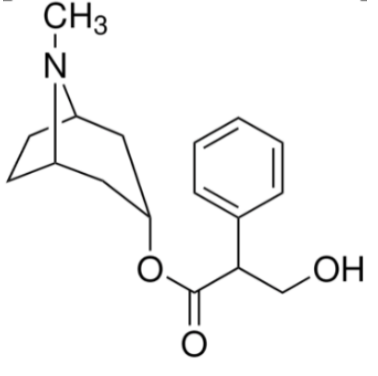
- formule brute de l’atropine : C17H23O3N ;
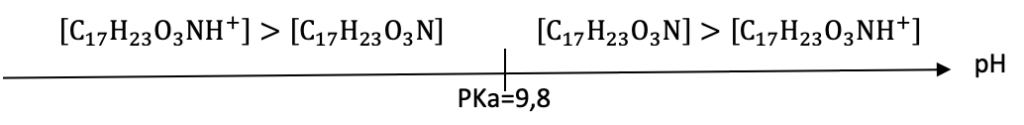
- couple acide-base de l’atropine : C17H23O3NH+ / C17H23O3N ;
- valeur du pKa du couple : 9,8.
1. Étude des ampoules pharmacologiques d’atropine.
Q1. Construire le diagramme de prédominance du couple acide/base de l’atropine.
Diagramme de prédominance :
En milieu hospitalier, on utilise des ampoules contenant du sulfate d’atropine, une solution limpide et incolore injectable par voie intraveineuse ou intra musculaire à une concentration en masse d’atropine CmA= 25 mg·L–1. Elle est conditionnée en ampoule de volume VA = 20 mL possédant un pH stabilisé aux alentours de 4,0.
Q2. Préciser sous quelle forme acide ou basique est présente l’atropine dans l’ampoule.
Diagramme de prédominance :
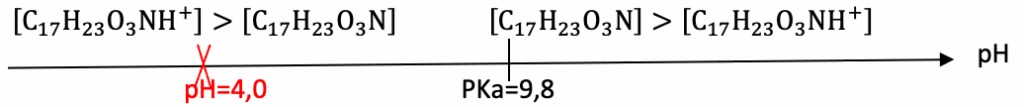
Dans l’ampoule, pour pH=4,0 : la forme acide $C_{17}H_{23}O_3{\rm NH}^+$ est prédominante.
Données :
- masse molaire moléculaire de l’atropine MA = 289,4 g∙mol–1 ;
- concentration standard c° = 1,0 mol∙L–1 .
Q3. Calculer la concentration en quantité de matière des ions oxonium [H3O+] de la solution contenue dans l’ampoule.
$$\left[H_3O^+\right]=c^0\times 10^{-pH}$$
$$\left[H_3O^+\right]=1,0\times 10^{-4}$$
$$\left[H_3O^+\right]=1,0\times 10^{-4}\ mol{.L}^{-1}$$
Q4. Calculer la concentration en quantité de matière CA d’atropine présente dans l’ampoule. Vérifier que la quantité de matière nA d’atropine dans l’ampoule est voisine de nA= 1,7×10–6 mol.
$$C_{mA}=C_A\times M_A$$
$$C_A\times M_A=C_{mA}$$
$$C_A=\frac{C_{mA}}{M_A}$$
$$C_A=\frac{25\times 10^{-3}}{289,4}$$
$$C_A=8,6\times 10^{-5}\ mol{.L}^{-1}$$
$$C_A=\frac{n_A}{V_A}$$
$$\frac{n_A}{V_A}=C_A$$
$$n_A=C_A\times V_A$$
$$n_A=8,6\times 10^{-5}\times 20\times 10^{-3}$$
$$n_A=1,7\times 10^{-6}mol$$
On trouve également des ampoules de concentration en quantité de matière CB= 1,7×10–3 mol·L–1.
Q5. Calculer le volume VB de cette ampoule pour que la quantité de matière nB en atropine soit égale à la quantité de matière nA déterminée en question Q4.
$$C_B=\frac{n_B}{V_B}$$
$$C_B\times V_B=n_B$$
$$V_B=\frac{n_B}{C_B}$$
$$V_B=\frac{1,7\times 10^{-6}}{1,7\times 10^{-3}}$$
$$V_B=1,0\times 10^{-3}\ L$$
$$V_B=1,0\ mL$$
2. Étude de l’extraction de l’atropine.
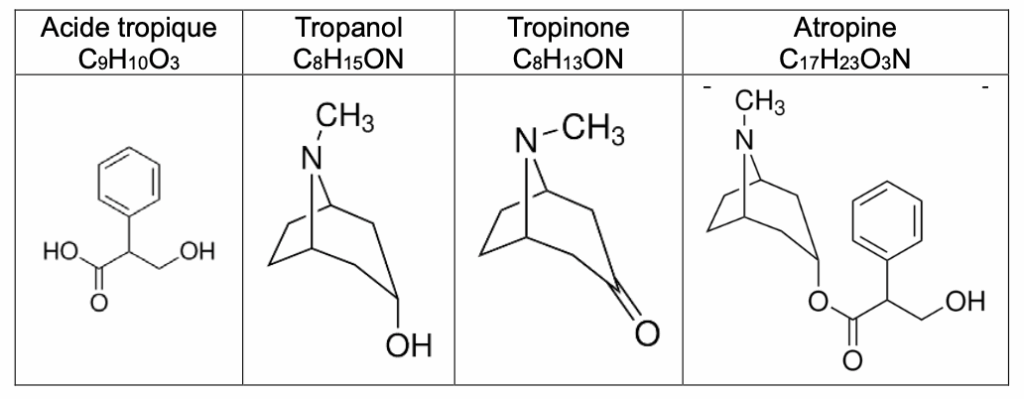
À partir de feuilles de belladone, on débute une succession d’extractions solide/liquide et liquide/liquide. L’extrait final présente différentes substances dont le tropanol, la tropinone et l’atropine. On isole chaque substance et on réalise une spectroscopie infrarouge de l’une d’elle. Le spectre infrarouge de cette substance est représenté sur la figure 1.
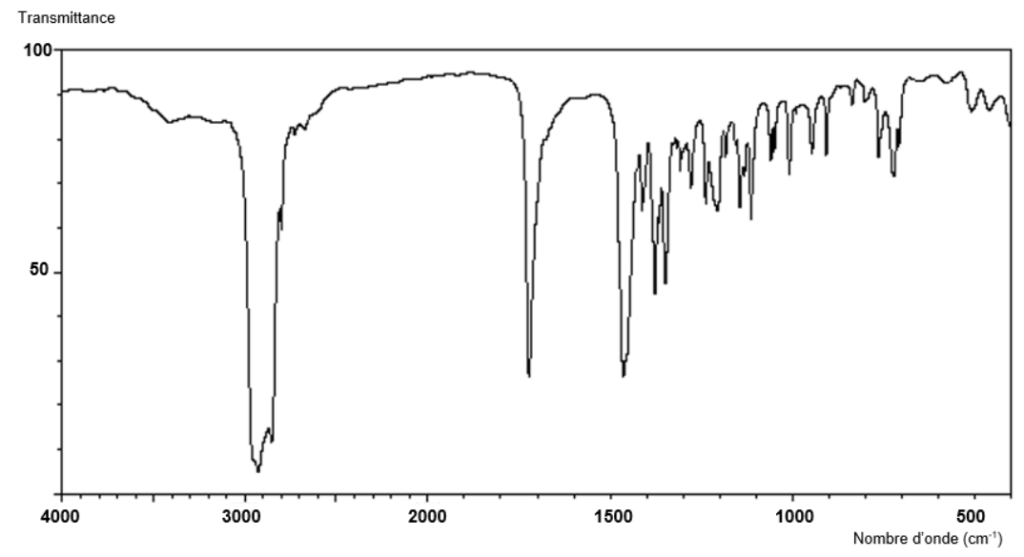
https://www.chemicalbook.com/SpectrumEN_532-24-1_IR2.htm
Figure 1. Spectre infrarouge de la substance testée.
Données :
- informations sur les molécules :
- tables de données spectroscopiques dans l’infrarouge :
| Liaison | Nombre d’onde (cm–1) | Intensité |
| O-H alcool libre | 3500-3700 | Forte, fine |
| O-H alcool lié | 3200-3400 | Forte, large |
| C-H alcane | 2800-3000 | Forte, multiple |
| C=O amide | 1650-1740 | Forte |
| C=O aldéhyde et cétone | 1650-1730 | Forte, fine |
| C=O acide | 1680-1710 | Forte |
Q6. Identifier, parmi les quatre molécules citées dans les données ci-dessus, celle qui est incompatible avec le spectre infrarouge de la figure 1.
Le spectre présente un pic autour de 1710 cm-1 caractéristique d’une liaison C = O.
Le spectre présente un pic autour de 2900 cm-1 caractéristique d’une liaison C -H.
Le spectre ne présente pas de pic autour de 2900 cm-1 caractéristique d’une liaison O-H.
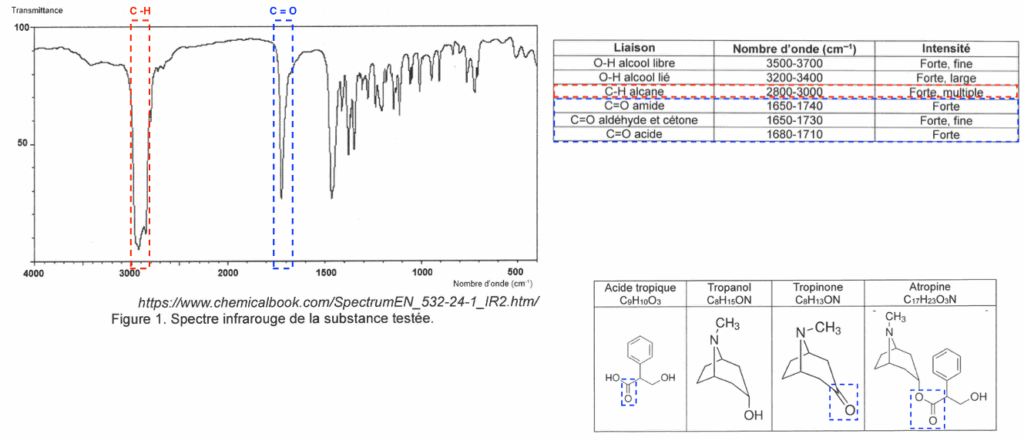
La seule molécule possible est la tropinone car elle possède une liaison C = O, des liaisons C -H et ne présente pas de liaison O-H.
Remarque : il y a une erreur sur le sujet, il faut lire « celle qui est incompatible avec le spectre infrarouge de la figure 1. »
Q7. L’identification des substances peut faire appel à la chromatographie sur couche mince (CCM) sur plaque de gel de silice. Décrire le protocole expérimental général associé à cette technique d’identification. Répondre en dix lignes au maximum.
La chromatographie sur couche mince (CCM) permet d’identifier des substances par séparation. On dépose un point d’échantillon sur une plaque de silice, puis on place celle-ci dans un récipient contenant un solvant. Le solvant monte par capillarité et entraîne les composés à des vitesses différentes. Après migration, on révèle les taches (UV ou révélateur) et on mesure les distances. L’identification se fait en comparant les positions des taches avec celles de substances de référence analysées dans les mêmes conditions.
3. Étude de la synthèse de l’atropine.
Dans la plante, la tropinone est réduite en tropanol à l’aide d’une enzyme TRI dite réductase.
Donnée :
- couple d’oxydoréduction tropanol-tropinone : C8H13ON/ C8H15ON.
Q8. Écrire la demi-équation électronique du couple tropanol-tropinone.
$$C_8H_{13}ON\ /C_8H_{15}ON$$
$$C_8H_{13}ON\ +2H^++2e^-=C_8H_{15}ON$$
Q9. En notant TRI/TRI-H le couple d’oxydoréduction de l’enzyme, établir l’équation de la réaction modélisant la transformation entre l’enzyme et la tropinone.
D’après le sujet l’enzyme est notée TRI
Couple d’oxydoréduction tropanol-tropinone : $C_8H_{13}ON\ /C_8H_{15}ON$.
Couple d’oxydoréduction de l’enzyme :$TRI\ /TRI-H$
Transformation entre l’enzyme et la tropinone
Dans le tableau des données la Tropinone est notée $C_8H_{13}ON$ et le Tropanol $C_8H_{13}ON$.
Il y a une erreur sur le sujet ! (c’est la 2e)
Il faut lire Couple d’oxydoréduction tropinone-tropanol : $C_8H_{13}ON\ /C_8H_{15}ON$.
Or la tropinone est un oxydant, il faut qu’il réagisse avec un réducteur donc TRI-H du Couple d’oxydoréduction de l’enzyme :$TRI\ /TRI-H$
Il y a une erreur sur le sujet ! (c’est la 3e)
$$TRI\ /TRI-H\ : TRI-H=TRI+H^++e^-\ \ \ \ \ \times 2$$
$$C_8H_{13}ON\ /C_8H_{15}ON : C_8H_{13}ON\ +2H^++2e^-=C_8H_{15}ON$$
$$2TRI-H+C_8H_{13}ON\ +2H^+\longrightarrow C_8H_{15}ON\ +2TRI+2H^+$$
$$2TRI-H+C_8H_{13}ON\ \longrightarrow C_8H_{15}ON\ +2TRI$$
Les quantités de tropanol, tropinone et d’atropine présentes lors de l’extraction sont trop faibles. L’industrie pharmaceutique se tourne alors vers la synthèse de la molécule afin de produire de plus gros volumes.
Q10. Sur le document réponse À RENDRE AVEC LA COPIE, identifier en les entourant et nommer les trois familles fonctionnelles présentes dans la molécule d’atropine.
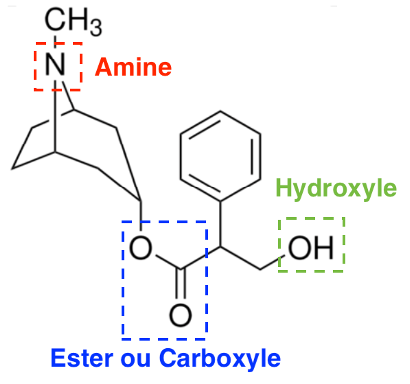
La synthèse résulte de la réaction entre l’acide tropique et le tropanol pour donner l’atropine. Pour accélérer la transformation, l’ensemble est chauffé après l’ajout de quelques gouttes d’une solution aqueuse d’acide sulfurique (2H+(aq), SO42−(aq)).
Q11. Compléter, sur le document réponse À RENDRE AVEC LA COPIE, l’équation de réaction modélisant la synthèse proposée.
$$C_9H_{10}O_3+C_8H_{16}ON^+\rightleftarrows C_{17}H_{24}O_3N^+\ +H_2O$$
Q12. Le montage de synthèse repose sur un montage à reflux. Citer deux intérêts de ce dispositif expérimental.
Le chauffage a reflux permet d’accélérer la réaction sans perte de matière.
Q13. Indiquer le rôle de l’acide sulfurique (2H+(aq), SO42−(aq)) dans le milieu réactionnel.
L’acide sulfurique dans le milieu réactionnel joue le rôle de catalyseur.
On notera nA, nB, nC et nD les quantités de matières à l’équilibre des espèces chimiques intervenant dans la transformation représentée dans le document réponse.
Q14. Donner l’expression littérale de la constante d’équilibre notée K, à l’aide des quantités de matière à l’équilibre nA, nB, nC et nD.
$$C_9H_{10}O_3+C_8H_{16}ON^+\rightleftarrows C_{17}H_{24}O_3N^+\ +H_2O$$
$$A+B\rightleftarrows C\ +D$$
$$K=\frac{n_C^{eq}\times n_D^{eq}}{n_A^{eq}\times n_B^{eq}}$$
Pour améliorer le dispositif expérimental, on utilise une verrerie spécifique dite de Dean-Stark qui élimine progressivement l’eau du reste du milieu réactionnel.
Q15. Justifier à l’aide du quotient de réaction Qr l’effet de l’utilisation de cette verrerie sur le déplacement d’équilibre.
$$Qr=\frac{n_C\times n_D}{n_A\times n_B}$$
La verrerie spécifique dite de Dean-Stark qui élimine progressivement l’eau du reste du milieu réactionnel.
On a donc, $n_D=0\ mol$ et $Qr=0$ à tout moment de la réaction.
Ainsi, $Qr$ est toujours inferieur à $K$ : la réaction se déroule toujours dans le sens direct et sera totale.
DOCUMENT RÉPONSE À RENDRE AVEC LA COPIE
Question Q10.
Question Q11.
C9H10O3 + C8H16ON+ → C17H24O3N+ + …….
A B C D
