Métropole 2022 Sujet 1
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 22-PYCJ1ME1
Sujet et corrigé
Le colorant E127, de couleur rouge, est utilisé pour teinter certains aliments comme les cerises confites. Il est
également présent dans des médicaments comme les révélateurs de plaque dentaire. C’est un composé ionique, de formule brute Na2C20H6I4O5 noté plus simplement Na2Ery, présent en solution sous la forme d’ions Na+ et Ery2–. Les ions Ery2– constituent l’une des trois formes acide-base de l’érythrosine.
Les objectifs de l’exercice sont d’étudier le dosage de ce colorant dans un révélateur de plaque dentaire, la synthèse de la forme la plus acide, notée H2Ery, de l’érythrosine et la cinétique de la décoloration de celle-ci par l’eau de Javel.
Données :
- écriture simplifiée et formule topologique des différentes formes acide-base associées à l’érythrosine :
| Écriture simplifiée | H2Ery | HEry– | Ery2– |
|---|---|---|---|
| Formule topologique | 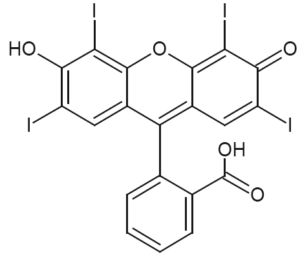 | 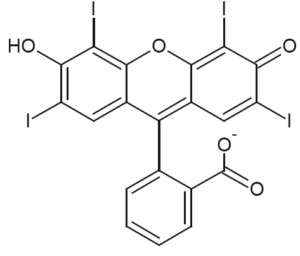 | 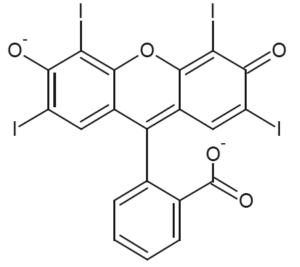 |
- valeurs de pKA à 25 °C des couples acide-base associés à l’érythrosine :
– H2Ery / HEry – : pKA1 = 2,4 ;
– HEry – / Ery2– : pKA2 = 3,8.
- valeurs de masses molaires de quelques espèces :
| Nom | Colorant E127 | Forme la plus acide de l’érythrosine | Forme la plus acide de la fluorescéine | Diiode |
| Écriture simplifiée ou formule brute | Na2Ery | H2Ery | H2Flu | I2 |
| Masse molaire (g·mol–1) | 880 | 836 | 332 | 254 |
1. Dosage du colorant E127 dans un révélateur de plaque dentaire
Un révélateur de plaque dentaire est une solution vendue en pharmacie permettant d’améliorer le brossage des dents. Elle est préparée à partir du colorant E127.
Données :
- masse volumique du révélateur de plaque dentaire étudié : ρ = 1,0 g·mL–1 ;
- pH du révélateur de plaque dentaire étudié : pH = 7,0 ;
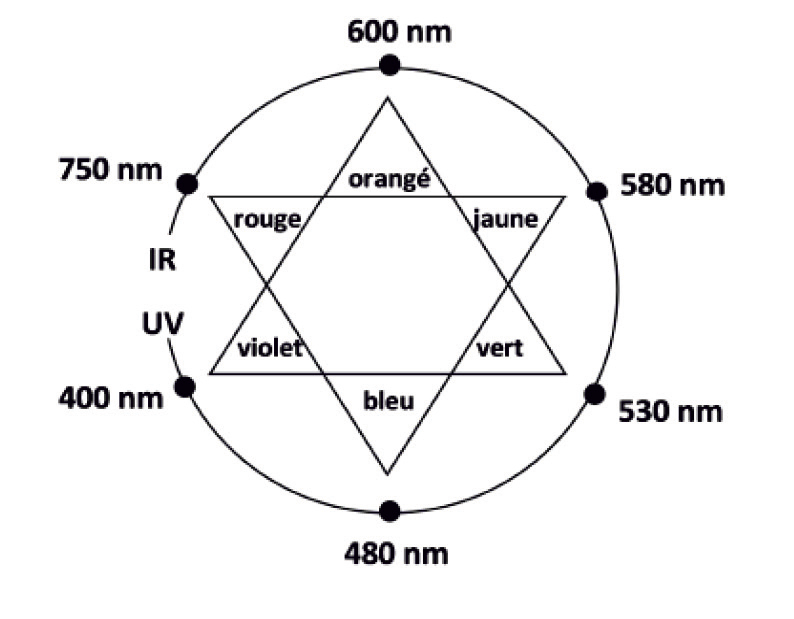
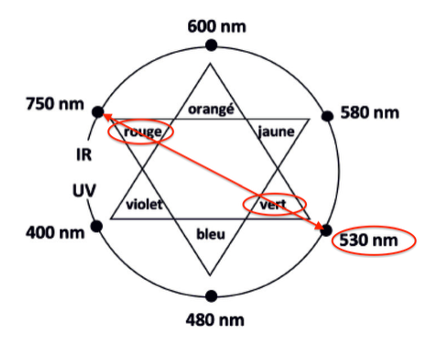
- cercle chromatique :
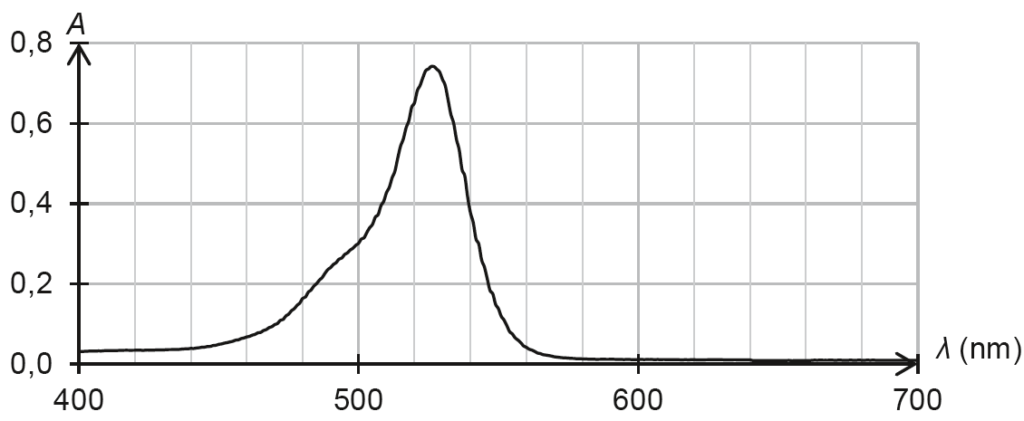
- spectre d’absorption d’une solution aqueuse du colorant E127 de concentration en soluté apporté égale à 1,7×10–5 mol·L–1 et de pH égal à 7,0 :
Q1. À l’aide de la formule topologique de la forme H2Ery de l’érythrosine ci-dessous, nommer les familles fonctionnelles associées aux groupes caractéristiques A, B et C.
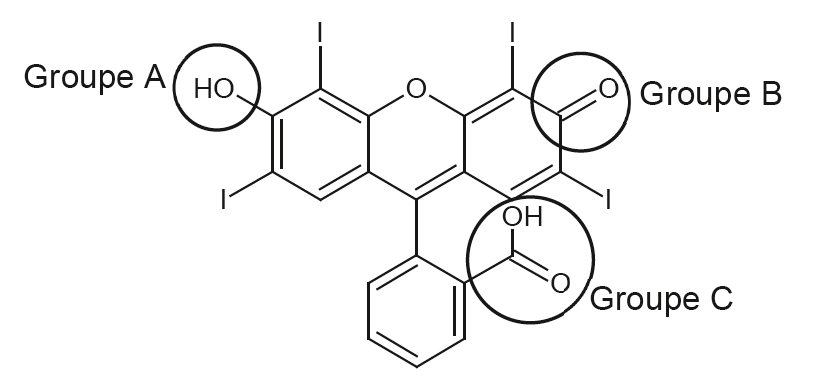
Groupe A : Famille Alcool
Groupe B : Famille cétone
Groupe C : Famille acide carboxylique
Q2. Identifier, en justifiant, la forme de l’érythrosine qui prédomine dans le révélateur de plaque dentaire étudié.
Diagramme de prédominance :
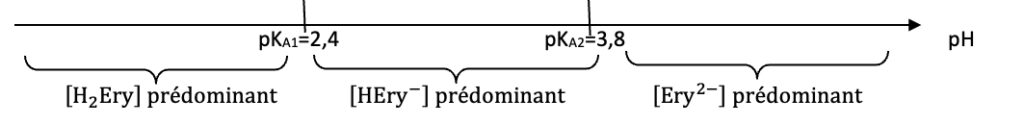
Le pH du révélateur de la plaque dentaire étudié est $pH = 7{,}0$ : ${\rm Ery}^{2-}$ est prédominant.
Sur le site du fabriquant, il est indiqué que le révélateur de plaque dentaire, de couleur rouge, est une solution hydroalcoolique contenant le colorant E127 à 2 % en masse.
Afin de vérifier l’indication précédente sur le titre massique, on réalise les expériences décrites ci-dessous. Préparation de la solution à doser :
- on introduit 0,5 mL de révélateur de plaque dentaire dans une fiole jaugée de 2,0 L que l’on complète avec de l’eau distillée : on obtient la solution S.
Dosage spectrophotométrique par étalonnage :
- à partir d’une solution aqueuse de colorant E127 de concentration en soluté apporté égale à 1,7×10–5 mol·L–1, on prépare par dilution six solutions filles ;
- on mesure l’absorbance de chacune de ces solutions à une longueur d’onde appropriée ; les mesures sont reportées sur le graphe de la figure 1 ;
- on mesure l’absorbance de la solution S à la même longueur d’onde ; on obtient A = 0,484.
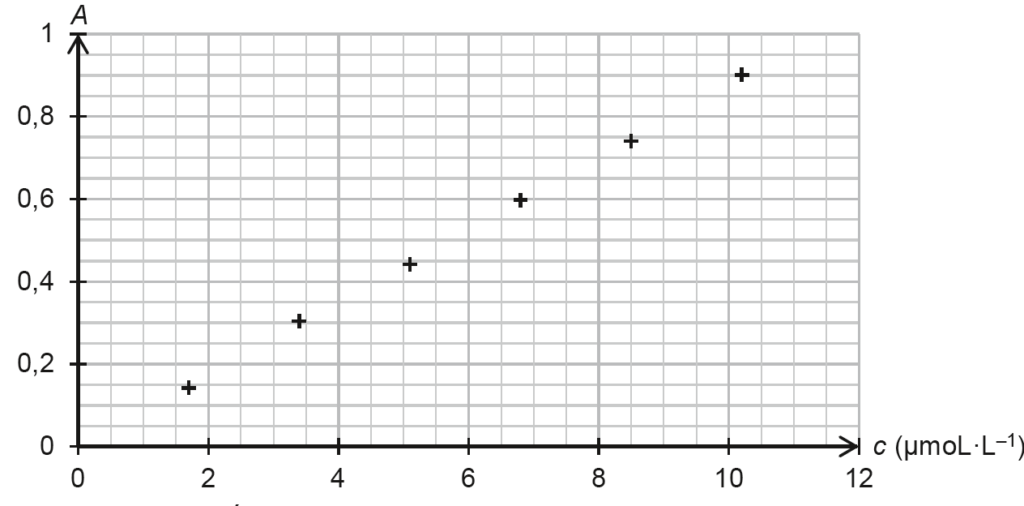
Figure 1. Évolution de l’absorbance en fonction de la concentration en quantité de matière de colorant E127 apporté
Q3. Justifier la couleur rouge du révélateur de plaque dentaire étudié.
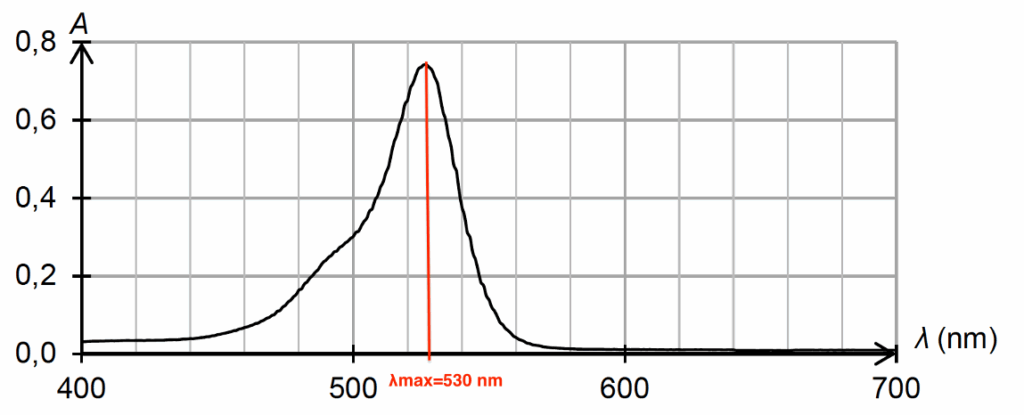
La couleur absorbée correspond à $\lambda_{max} = 530\ \text{nm}$, couleur verte.
Sa couleur est la couleur complémentaire du vert (couleur opposée sur le cercle chromatique) : le rouge.
La solution est donc de couleur rouge.
Q4. Après avoir montré que la concentration du colorant E127 apporté dans le révélateur de plaque dentaire est égale à 2,2×10–2 mol·L–1, déterminer la valeur du titre massique en colorant E127 du révélateur de plaque dentaire analysé. Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Le graphique est une droite passant par l’origine : A et C sont proportionnel ainsi A=KC . La loi de Beer Lambert est vérifiée.
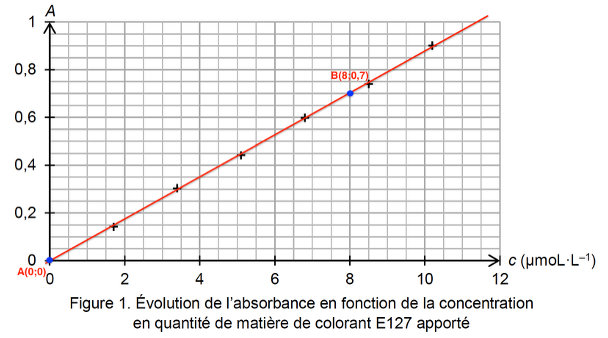
Trouvons le coefficient directeur $K$ :
$$k = \frac{y_B – y_A}{x_B – x_A}$$
$$k = \frac{0{,}7 – 0}{8{,}0 \times 10^{-6} – 0}$$
$$k = 8{,}8 \times 10^4\ \text{L·mol}^{-1}$$
$$A = 8{,}8 \times 10^4\ C$$
Trouvons $C_S$ :
$$C_S = \frac{A}{8{,}8 \times 10^4}$$
$$C_S = 5{,}5 \times 10^{-6}\ \text{mol·L}^{-1}$$
Trouvons $C$ :
« On introduit 0,5 mL de révélateur de plaque dentaire dans une fiole jaugée de 2,0 L que l’on complète avec de l’eau distillée : on obtient la solution S. »
Lors d’une dilution, la quantité de matière se conserve :
$$n = n_s$$
$$C V = C_S V_S$$
$$C = \frac{C_S V_S}{V}$$
$$C = \frac{5{,}5 \times 10^{-6} \times 2{,}0}{0{,}5 \times 10^{-3}}$$
$$C = 2{,}2 \times 10^{-2}\ \text{mol·L}^{-1}$$
Déterminons la valeur du titre massique :
$$\text{titre} = \frac{m_{E127}}{m_{\text{Révélateur}}}$$
$$m_{E127} = n_{E127} \times M_{E127}$$
$$m_{E127} = C \times V \times M_{E127}$$
$$m_{E127} = 2{,}2 \times 10^{-2} \times 0{,}5 \times 10^{-3} \times 880$$
$$m_{E127} = 9{,}68 \times 10^{-3}\ \text{g}$$
$$m_{\text{Révélateur}} = \rho_{\text{Révélateur}} \times V$$
$$m_{\text{Révélateur}} = 1{,}0 \times 0{,}5$$
$$m_{\text{Révélateur}} = 0{,}5\ \text{g}$$
$$\text{titre} = \frac{9{,}68 \times 10^{-3}}{0{,}5}$$
$$\text{titre} = 0{,}019$$
$$\text{titre} = 1{,}9\ %$$
Le résultat est proche de la valeur donnée par le fabricant : ils sont compatibles.
2. Synthèse de l’érythrosine à partir de la fluorescéine
L’érythrosine peut être synthétisée à partir d’un autre colorant, la fluorescéine, en présence d’acide iodique et d’éthanol ; l’équation de la réaction modélisant cette synthèse est donnée ci-dessous :
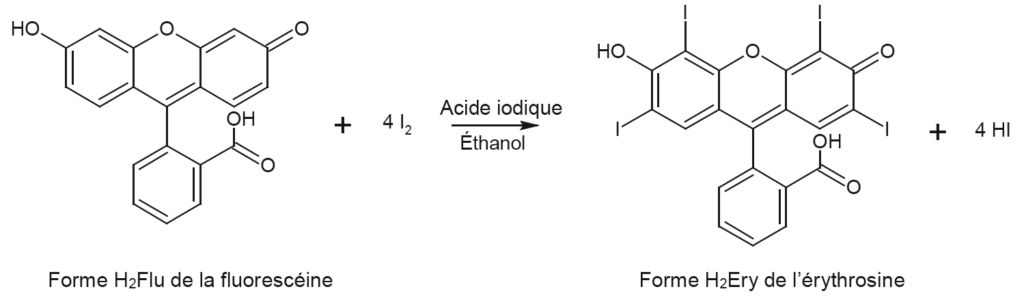
Dans une publication scientifique, on trouve les informations suivantes :
- les différentes étapes d’un protocole de synthèse de l’érythrosine :
- étape n°1 : réaliser la synthèse de la forme H2Ery de l’érythrosine à partir de 5,0 g de fluorescéine H2Flu et de 9,5 g de diiode I2, en présence d’éthanol et d’acide iodique ; chauffer et agiter le mélange pendant deux heures à une température de 60 °C ;
- étape n°2 : après refroidissement, filtrer le mélange à l’aide d’un filtre Büchner puis laver le solide rouge obtenu avec de l’eau et de l’éthanol ;
- étape n°3 : mesurer la température de fusion du solide rouge obtenu.
- la valeur du rendement r de la synthèse : r = 59 %.
D’après N. Pietrancosta et al. / Bioorganic & Medicinal Chemistry 18 (2010) 6922–6933
Q5. Identifier le rôle des étapes n°1, n°2 et n°3 du protocole expérimental de synthèse de l’érythrosine.
Étape n°1 : synthèse
Étape n°2 : séparation
Étape n°3 : identification
Q6. Identifier l’opération du protocole expérimental réalisée pour optimiser la vitesse de formation de l’érythrosine.
Pour optimiser la vitesse, on chauffe pendant 2 h.
Q7. Déterminer le réactif limitant de la synthèse de l’érythrosine.
Calculons les quantités de matière des réactifs :
$$n_{H_2Flu} = \frac{m_{H_2Flu}}{M_{H_2Flu}}$$
$$n_{H_2Flu} = \frac{5{,}0}{332}$$
$$n_{H_2Flu} = 1{,}5 \times 10^{-2}\ \text{mol}$$
$$n_{I_2} = \frac{m_{I_2}}{M_{I_2}}$$
$$n_{I_2} = \frac{9{,}5}{254}$$
$$n_{I_2} = 3{,}7 \times 10^{-2}\ \text{mol}$$
Calculons $x_{max}$ :
$$x_{max1} = \frac{n_{H_2Flu}}{1} = 1{,}5 \times 10^{-2}\ \text{mol}$$
$$x_{max2} = \frac{n_{I_2}}{4} = \frac{3{,}7 \times 10^{-2}}{4} = 9{,}3 \times 10^{-3}\ \text{mol}$$
$$x_{max2} < x_{max1}$$
$$x_{max} = x_{max2} = 9{,}3 \times 10^{-3}\ \text{mol}$$
Le réactif limitant est le diiode I2.
Q8. Montrer que la masse d’érythrosine de forme H2Ery obtenue expérimentalement est d’environ 4,6 g.
$$m_{H_2Ery}^{\text{théorique}} = n_{H_2Ery}^{\text{théorique}} \times M_{H_2Ery}$$
$$m_{H_2Ery}^{\text{théorique}} = x_{max} \times M_{H_2Ery}$$
$$m_{H_2Ery}^{\text{théorique}} = 9{,}3 \times 10^{-3} \times 836$$
$$m_{H_2Ery}^{\text{théorique}} = 7{,}8\ \text{g}$$
Le rendement $r$ :
$$r = \frac{m_{H_2Ery}^{\text{expérimentale}}}{m_{H_2Ery}^{\text{théorique}}}$$
$$m_{H_2Ery}^{\text{expérimentale}} = \frac{59}{100} \times 7{,}8$$
$$m_{H_2Ery}^{\text{expérimentale}} = 4{,}6\ \text{g}$$
Q9. Déterminer le nombre de flacons de 10 mL de révélateur de plaque dentaire, de pH égal à 7 et de concentration égale à 2,2×10–2 mol·L–1 en colorant E127, qu’il est possible de fabriquer grâce à cette synthèse.
Trouvons le volume de révélateur de plaque dentaire de concentration $C = 2{,}2 \times 10^{-2}\ \text{mol·L}^{-1}$ qu’il est possible de fabriquer avec $m_{H_2Ery}^{\text{expérimentale}} = 4{,}6\ \text{g}$ :
$$m_{H_2Ery}^{\text{expérimentale}} = n_{H_2Ery} \times M_{H_2Ery}$$
$$m_{H_2Ery}^{\text{expérimentale}} = C \times V \times M_{H_2Ery}$$
$$C \times V \times M_{H_2Ery} = m_{H_2Ery}^{\text{expérimentale}}$$
$$V = \frac{m_{H_2Ery}^{\text{expérimentale}}}{C \times M_{H_2Ery}}$$
$$V = \frac{4{,}6}{2{,}2 \times 10^{-2} \times 836}$$
$$V = 0{,}25\ \text{L}$$
Trouvons le nombre de flacons de 10 mL que nous pouvons fabriquer :
$$N = \frac{V}{10 \times 10^{-3}}$$
$$N = \frac{0{,}25}{10 \times 10^{-3}}$$
$$N = 25\ \text{flacons}$$
3. Suivi cinétique de la décoloration d’une solution de colorant E127 par l’eau de Javel
Le filtre Büchner utilisé lors de la synthèse précédente est coloré par les résidus de colorant E127 rouge. Pour le décolorer, on peut utiliser de l’eau de Javel.

En effet, la forme Ery2– de l’érythrosine réagit avec les ions hypochlorite ClO– contenus dans l’eau de Javel pour former un produit incolore. Cette réaction est supposée totale.
On réalise, à 25 °C, les deux expériences A et B décrites ci-après :
- dans des béchers de 50 mL, deux solutions sont préparées à partir d’une solution commerciale d’eau de Javel de concentration en ions hypochlorite égale à 0,73 mol·L–1 :
| Solution | SA | SB |
| Volume d’eau de Javel (mL) | 5 | 10 |
| Volume d’eau distillée (mL) | 5 | 0 |
- pour l’expérience A :
- à la date t = 0 s, on verse dans le bécher contenant la solution SA un volume de 10,0 mL d’une solution aqueuse de colorant E127 de concentration en soluté apporté égale à 1,7×10–5 mol·L–1 ;
- on remplit rapidement une cuve spectrophotométrique avec le mélange réactionnel, on l’introduit dans un spectrophotomètre réglé à une longueur d’onde appropriée et on relève les valeurs d’absorbance en fonction du temps ;
- pour l’expérience B, on recommence les mêmes opérations avec la solution SB.
Dans chacun des mélanges réactionnels préparés, l’érythrosine est présente sous la seule forme Ery2– et cette forme est la seule espèce qui absorbe à la longueur d’onde choisie.
Les résultats obtenus permettent de tracer la courbe d’évolution de la concentration en quantité de matière de la forme Ery2– de l’érythrosine pour l’expérience A et B (figure 2).
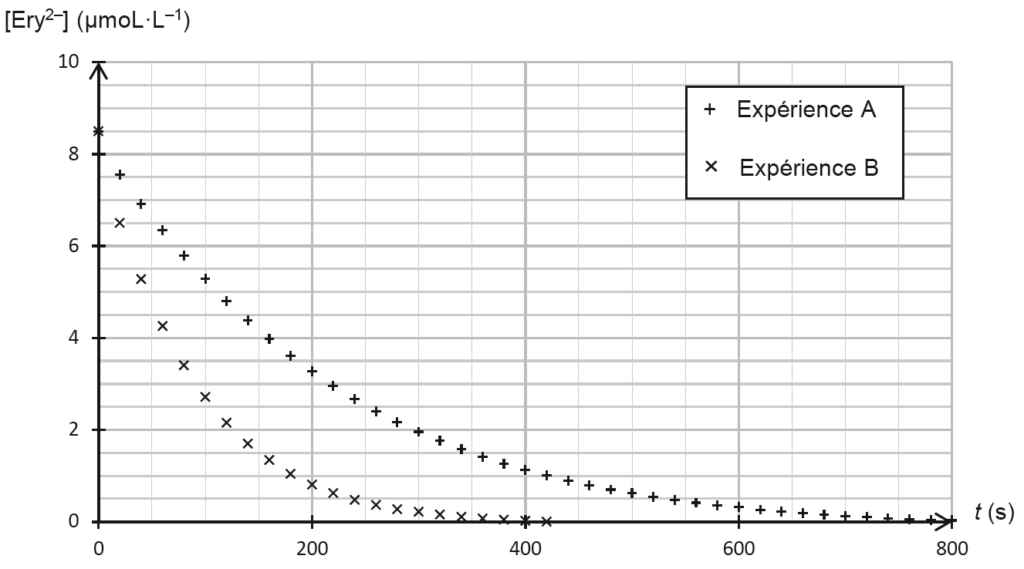
Figure 2. Évolution de la concentration en quantité de matière de la forme Ery2– de l’érythrosine pour l’expérience A et B
Q10. Décrire qualitativement, en exploitant la figure 2, l’évolution de la vitesse volumique de disparition de la forme Ery2–de l’érythrosine au cours du temps pour l’expérience A. Proposer un facteur cinétique à l’origine de cette évolution.
$$v_d = -\frac{d\left[{\rm Ery}^{2-}\right]_{(t)}}{dt}$$
Or, la dérivée se calcule en trouvant le coefficient directeur de la tangente en un point de la courbe.
Graphiquement, la valeur absolue du coefficient directeur de la tangente diminue au cours du temps.
Le facteur cinétique responsable de cette évolution est la concentration : quand la concentration diminue (c’est un réactif), la vitesse diminue.
Q11. Déterminer graphiquement le temps de demi-réaction pour l’expérience A. Commenter.
$t_{1/2}$ est la durée nécessaire pour que la concentration du réactif atteigne la moitié de sa valeur initiale : $x(t_{1/2}) = x_f / 2$.
$$\left[{\rm Ery}^{2-}\right]_{\left(t = t_{1/2}\right)} = \frac{\left[{\rm Ery}^{2-}\right]_i}{2}$$
Graphiquement : $\left[{\rm Ery}^{2-}\right]_i = 8{,}5\ \mu\text{mol·L}^{-1}$
$$\left[{\rm Ery}^{2-}\right]_{\left(t = t*{1/2}\right)} = \frac{8{,}5}{2}$$
$$\left[{\rm Ery}^{2-}\right]_{\left(t = t*{1/2}\right)} = 4{,}3\ \mu\text{mol·L}^{-1}$$
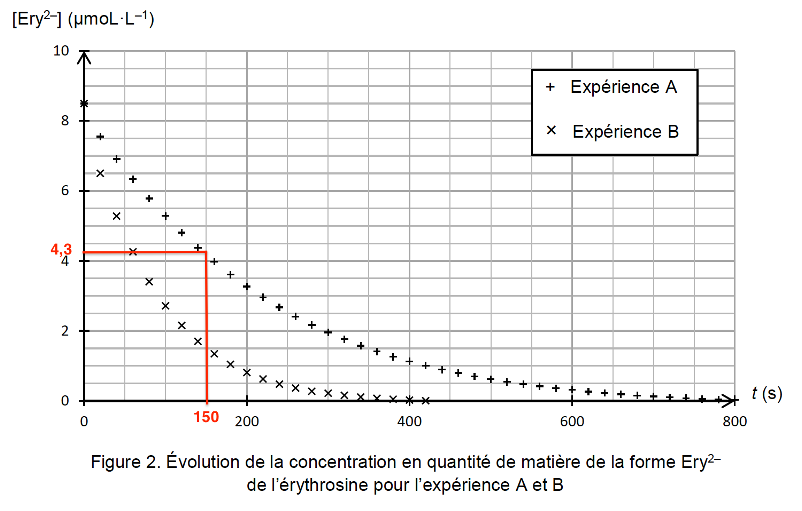
$t_{1/2} = 150\ \text{s}$
Q12. Expliquer comment il est possible d’optimiser la décoloration du filtre Büchner.
Dans l’expérience B, la concentration en eau de Javel est supérieure à celle de l’expérience A.
Graphiquement, $v_B > v_A$.
Pour optimiser la décoloration du filtre Büchner, on augmente la concentration en eau de Javel.
