Bac Métropole Juin 2021 Sujet 1
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1ME2
Sujet et corrigé
Mots-clés : titrage par suivi pH-métrique ; dosage par étalonnage

Le pomelo est un fruit résultant d’un croisement entre un pamplemoussier et un oranger. Cet agrume est connu pour sa teneur élevée en acide ascorbique (vitamine C) par rapport aux autres fruits, ce qui lui confère des propriétés « anti-oxydantes ». Il contient également de l’acide citrique.
L’objectif de cet exercice est d’étudier deux propriétés du jus de pomelo : des propriétés acido-basiques essentiellement dues à l’acide citrique et des propriétés « anti-oxydantes » dues à l’acide ascorbique.
Données :
- masse molaire moléculaire de l’acide citrique : M(C6H8O7) = 192,0 g·mol–1 ;
- masse molaire moléculaire de l’acide ascorbique : M(C6H8O6) = 176,0 g·mol–1 ;
- indicateurs colorés acide-base :
| Nom | Couleur de la forme acide | Zone de virage | Couleur de la forme basique |
| Bleu de bromothymol | Jaune | 6,0 – 7,6 | Bleu |
| Hélianthine | Rouge | 3,1 – 4,4 | Jaune |
| Rouge de crésol | Jaune | 7,2 – 8,8 | Rouge |
1. Acidité titrable d’un jus de pomelo
Le jus du pomelo est acide. Cette acidité est principalement due à trois espèces : l’acide citrique, le plus abondant, l’acide malique et l’acide ascorbique, présents en plus faible quantité.
Afin de comparer plus facilement l’acidité entre les agrumes, on considère que le seul acide présent dans le jus de pomelo est l’acide citrique, un triacide, que l’on note H3A. On définit l’acidité titrable comme la masse, exprimée en grammes, d’acide citrique par litre de jus extrait de l’agrume. L’acidité titrable d’un jus de pomelo est de l’ordre de la dizaine de grammes d’acide citrique pour un litre de jus.
Pour déterminer la valeur de l’acidité titrable d’un jus de pomelo, on réalise un titrage acido-basique de 20,0 mL de jus frais et filtré par une solution aqueuse d’hydroxyde de sodium (Na+(aq) ; HO–(aq)) de concentration égale à 0,50 mol·L–1, et on suit le titrage par pH-métrie. La courbe du titrage est présentée ci-dessous.
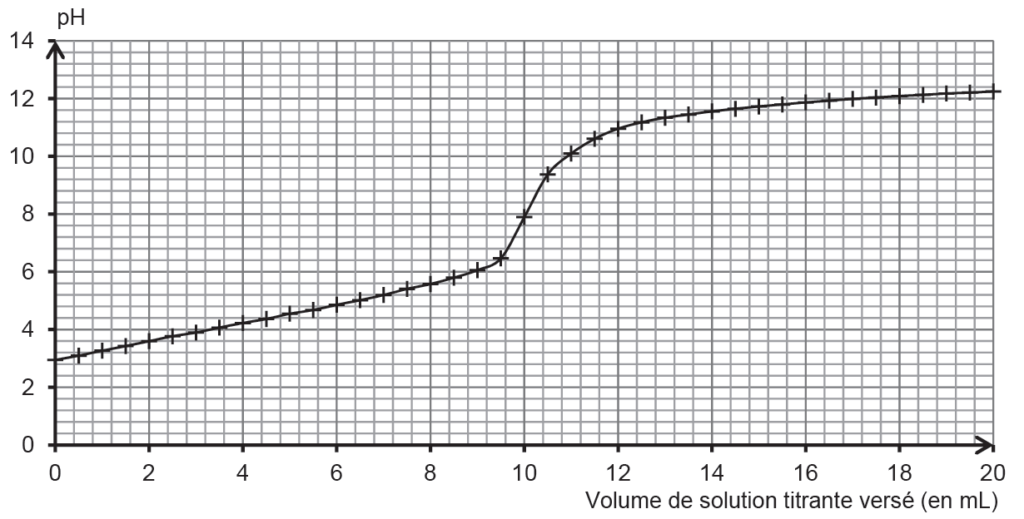
1.1. Déterminer graphiquement la valeur du pH du jus de pomelo frais et filtré. Commenter.
Pour déterminer graphiquement la valeur du pH du jus de pomelo frais et filtré on lit la valeur du pH lorsque la réaction de dosage n’a pas débuté soit lorsque V=0 mL.
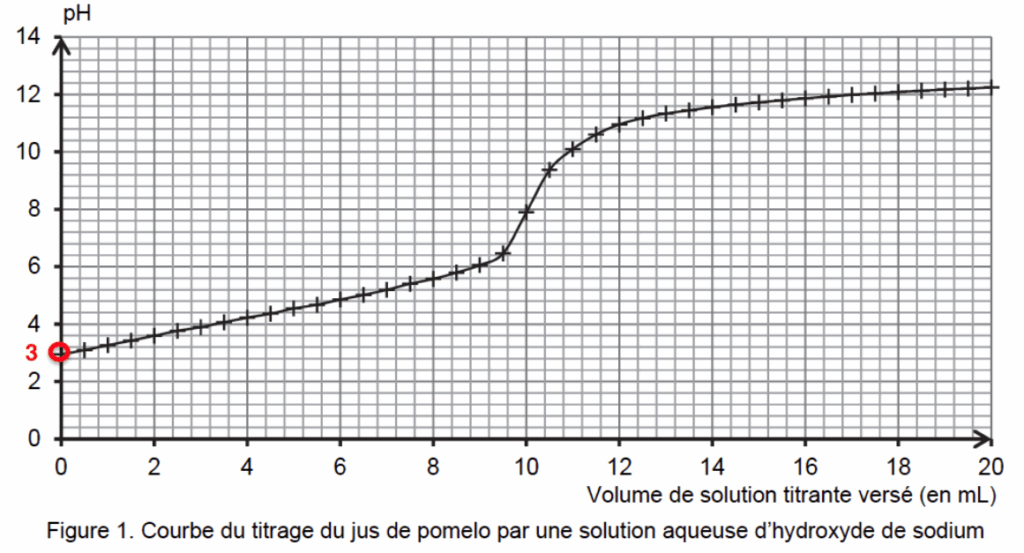
pH=3 , le jus de pomelo frais est acide.
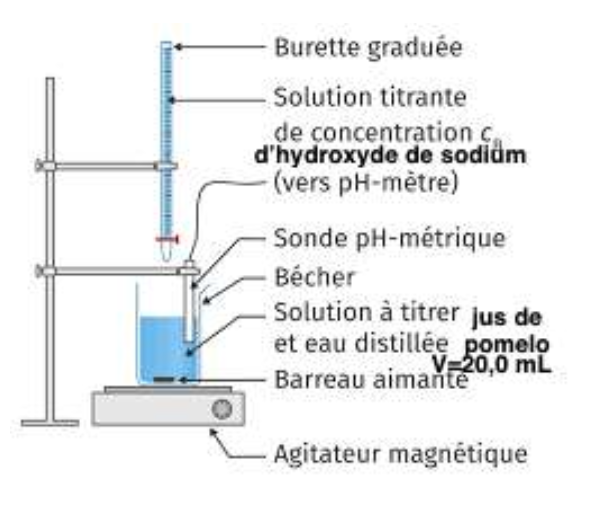
1.2. Schématiser et légender le montage permettant de réaliser ce titrage.
1.3. Titrage suivi par colorimétrie
1.3.1. Choisir, dans la liste des indicateurs colorés acido-basiques, celui qui peut être utilisé pour réaliser le titrage suivi par colorimétrie de l’acidité du jus de pomelo. Justifier.
Pour choisir le bon indicateur coloré on doit trouver le pH à l’équivalence.
On utilise la méthode des tangentes parallèles.
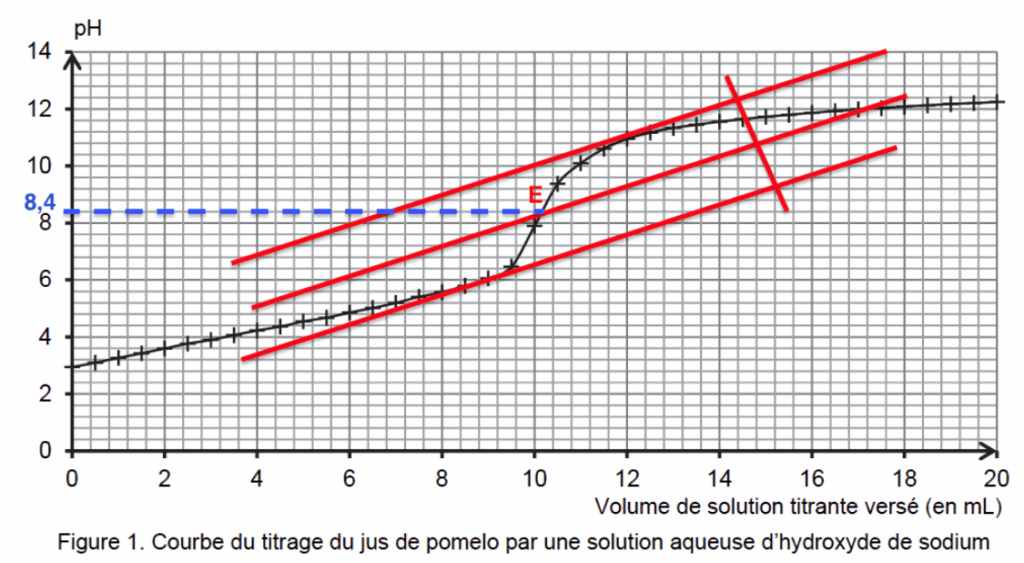
pHeq=8,4.
On choisit l’indicateur coloré qui à pHeq dans sa zone de virage :
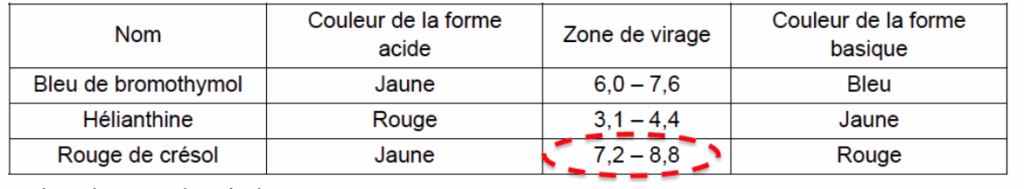
On choisit le rouge de crésol.
1.3.2. Préciser le changement de couleur qui peut être observé lors du titrage. L’équation de la réaction support du titrage est la suivante :
H3A (aq) + 3 HO– (aq) → A3– (aq) + 3 H2O (ℓ)
En début de titrage, le pH est faible (pH<7,2), le rouge de crésol à la couleur de la forme acide : jaune.
En fin de titrage, le pH est élevé (pH>8,8), le rouge de crésol à la couleur de la forme basique : rouge.
Ainsi la couleur passera du jaune au rouge lors du titrage.
1.4. En exploitant la courbe du titrage (figure 1), déterminer l’acidité titrable du jus de pomelo. Commenter.
D’après le texte : « On définit l’acidité titrable comme la masse, exprimée en grammes, d’acide citrique par litre de jus extrait de l’agrume »
On cherche donc la concentration massique
$$H_3A_{(aq)}+3{\rm HO}_{(aq)}^-\rightarrow A_{(aq)}^{3-}+3H_2O_{(l)}$$
A l’équivalence, les réactifs ont été introduits dans les proportions stœchiométrique :
$$\frac{n_{H_3A}^i}{1}=\frac{n_{{\rm HO}^-}^{eq}}{3}$$
$$C_A \times V_A=\frac{C_B \times V_{eq}}{3}$$
$$C_A=\frac{C_B \times V_{eq}}{3 \times V_A}$$
On trouve graphiquement $V_{eq}$ :
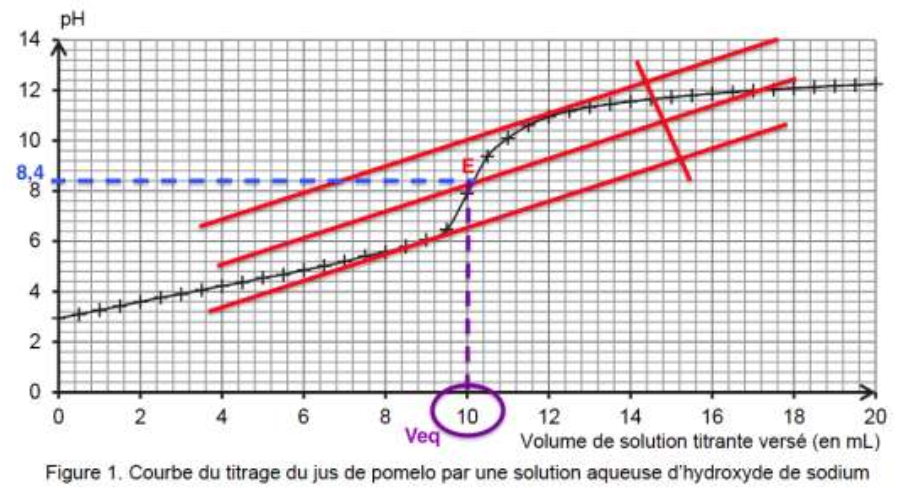
$$V_{eq}=10,0\ mL$$
$$C_A=\frac{0,50 \times 10,0}{3 \times 20,0}$$
$$C_A=8,3.{10}^{-2}mol.L^{-1}$$
Or
$$C_{mA}=C_A \times M_A$$
D’après le texte : « on considère que le seul acide présent dans le jus de pomelo est l’acide citrique »
$$C_{mA}=8,3.{10}^{-3} \times 192,0$$
$$C_{mA}=16\ g.L^{-1}$$
D’après le texte : « L’acidité titrable d’un jus de pomelo est de l’ordre de la dizaine de grammes d’acide citrique pour un litre de jus. »
Les résultats sont donc conformes aux attentes.
2. Détermination de la quantité d’acide ascorbique dans un jus de pomelo
Selon l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), pour couvrir ses besoins journaliers, il est conseillé à un adulte d’ingérer environ 100 mg par jour d’acide ascorbique ou vitamine C.
Afin d’estimer le volume de jus de pomelo nécessaire à un adulte pour couvrir ses besoins journaliers en acide ascorbique, on cherche à évaluer la quantité de cette espèce chimique présente dans un jus. Pour cela, on fait réagir l’acide ascorbique présent dans un jus de pomelo avec un excès de diiode I2 en quantité connue, puis on détermine la quantité de diiode restante. On en déduit alors la quantité d’acide ascorbique présente initialement dans le jus.
Expérimentalement :
- Réaction de l’acide ascorbique et du diiode : on mélange 5,0 mL de jus de pomelo avec 5,0 mL d’une solution aqueuse de diiode de concentration égale à 8,0×10–3 mol·L–1. Après quelques instants, l’intensité de la couleur du mélange ne varie plus. On note F ce mélange final de 10,0 mL.
Cette transformation, lente et totale, peut être modélisée par l’équation de réaction suivante :
C6H8O6 (aq) + I2 (aq) + 2 H2O (ℓ) → C6H6O6(aq) + 2 H3O+ (aq) + 2 I– (aq)
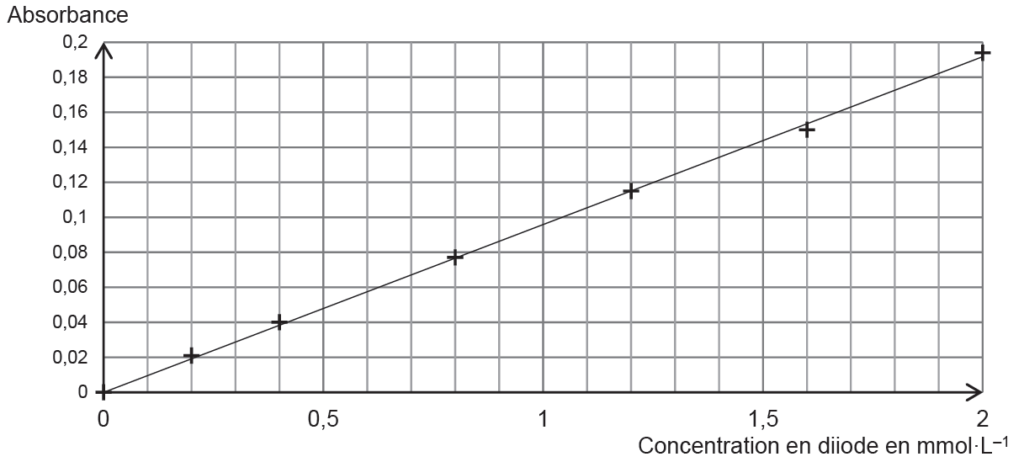
- Dosage du diiode restant : on réalise un dosage par étalonnage à l’aide de mesures spectrophotométriques.
- Une gamme de solutions aqueuses de diiode est réalisée pour obtenir la courbe d’étalonnage de la figure 2 ;
- Un blanc avec un mélange contenant du jus de pomelo dilué avec de l’eau distillée est préparé, puis l’absorbance du mélange final F est mesurée, elle vaut A = 0,11.
2.1. Déterminer la valeur de la concentration en quantité de matière en diiode restant dans le mélange final F et en déduire la quantité de diiode qui a réagi avec l’acide ascorbique du jus de pomelo.
L’absorbance du mélange final F vaut A = 0,11.
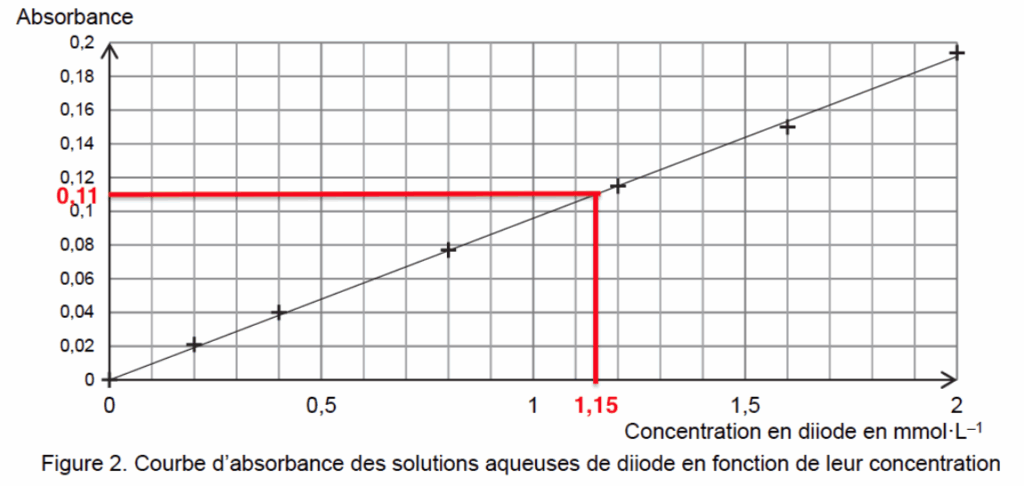
Graphiquement pour A=0,11 : $C=1,15\ mmol.L^{-1}$
La concentration en quantité de matière en diiode restant dans le mélange final F est
$$C_{diode}^{restant}=1,15\ mmol.L^{-1}.$$
Attention, cette concentration est celle de diode restant dans le volume du mélange soit 10 mL.
Quantité de diiode qui a réagi :
$$n_{diode}^{reagit}=n_{diode}^{initial}-n_{diode}^{restant}$$
$$n_{diode}^{reagit}=C_{diode}^{initial} \times V-C_{diode}^{restant} \times V$$
$$n_{diode}^{reagit}=8,0.{10}^{-3} \times 5,0.{10}^{-3}-1,15.{10}^{-3} \times 10,0.{10}^{-3}$$
$$n_{diode}^{reagit}=2,85.{10}^{-5}mol$$
2.2. Montrer que la valeur de la concentration en acide ascorbique du jus frais de pomelo est environ égale à 6×10–3 mol·L–1.
$$C_6H_8O_{6\ (aq)}+I_{2\ (aq)}+2H_2O_{(l)} \rightarrow C_6H_6O_{6\ (aq)}+2H_3O_{(aq)}^++2I_{(aq)}^-$$
A l’équivalence, les réactifs ont été introduits dans les proportions stœchiométrique :
$$\frac{n_{C_6H_8O_6}^i}{1}=\frac{n_{I_2}^{reagit}}{1}$$
$$C_A \times V_A=n_{I_2}^{reagit}$$
$$C_A=\frac{n_{I_2}^{reagit}}{V_A}$$
$$C_A=\frac{2,85.{10}^{-5}}{5,0.{10}^{-3}}$$
$$C_A=5,7.{10}^{-3}\ mol.L^{-1}$$
La valeur de la concentration en acide ascorbique du jus frais de pomelo est environ égale à $6.{10}^{-3}\ mol.L^{-1}$
2.3. Calculer le volume de jus de pomelo nécessaire pour couvrir totalement les besoins journaliers en acide ascorbique d’un adulte. Commenter.
D’après le texte : « il est conseillé à un adulte d’ingérer environ 100 mg par jour d’acide ascorbique ou vitamine C »
Trouvons le volume correspondant à cette masse.
$$n_A=\frac{m_A}{M_A}=C_A \times V$$
$$C_A \times V=\frac{m_A}{M_A}$$
$$V=\frac{m_A}{M_A{ \times C}_A}$$
$$V=\frac{100.{10}^{-3}\ }{176,0 \times 5,7.{10}^{-3}}$$
$$V=0,10\ L=100\ mL$$
Boire 100 mL de jus de pomelo pour couvrir totalement les besoins journaliers en acide ascorbique d’un adulte est réalisable.
