Bac Amérique du nord 2025 Sujet 2
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ2AN1
Sujet et corrigé
Exercice 1 : Le Schweppes® : un bon antipaludique sans risque pour la santé ? (9 POINTS)
La quinine a été extraite pour la première fois des écorces du quinquina jaune le 26 juin 1820 par Pelletier et Caventou.
Elle reste un médicament majeur pour le traitement du paludisme qui touche 249 millions de personnes dans le monde en 2022.
Source : d’après Médiachimie et who.int
Sur le site du Collège National de Pharmacologie Médicale, on peut lire :
« La quinine s’utilise par voie orale pour le traitement du paludisme à raison de 3 prises de 8 mg/kg de masse corporelle, espacées de 8 heures, pendant 7 jours ».
Source : pharmacomedicale.org
Sur l’étiquette d’une canette de Schweppes, on peut lire que cette boisson contient de la quinine :
Composition du Schweppes®
Ingrédients : eau gazéifiée avec du dioxyde de carbone, sucre, acidifiants (E330, E331), arôme, quinine, conservateur (E211).

Dans la première partie de cet exercice, pour savoir si cette boisson peut être utilisée comme antipaludique, on dose par étalonnage la quantité de quinine contenue dans le Schweppes® par fluorescence.
Dans la seconde partie, on titre l’acide citrique contenu dans le Schweppes®.
Données :
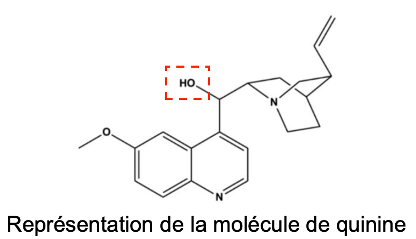
- La quinine est une molécule organique dont le nom officiel est :
6-méthoxyquinolin-4-yl(5-vinylquinuclidin-2-yl)-méthanol

Représentation de la molécule de quinine
- Sa masse molaire est : M(quinine) = 324 g·mol-1.
- Cette molécule est une dibase notée Q dont les pKA valent 4,4 et 9,0 à 25°C. Les formes acides de la quinine peuvent être symbolisées par QH22+ et QH+.
- La fluorescence est l’émission lumineuse provoquée par l’excitation des électrons d’une molécule (ou d’un atome), généralement par absorption d’un photon, immédiatement suivie d’une émission spontanée de lumière.
Source : d’après Wikipédia
Spectre d’émission de fluorescence d’une solution acidifiée de quinine :
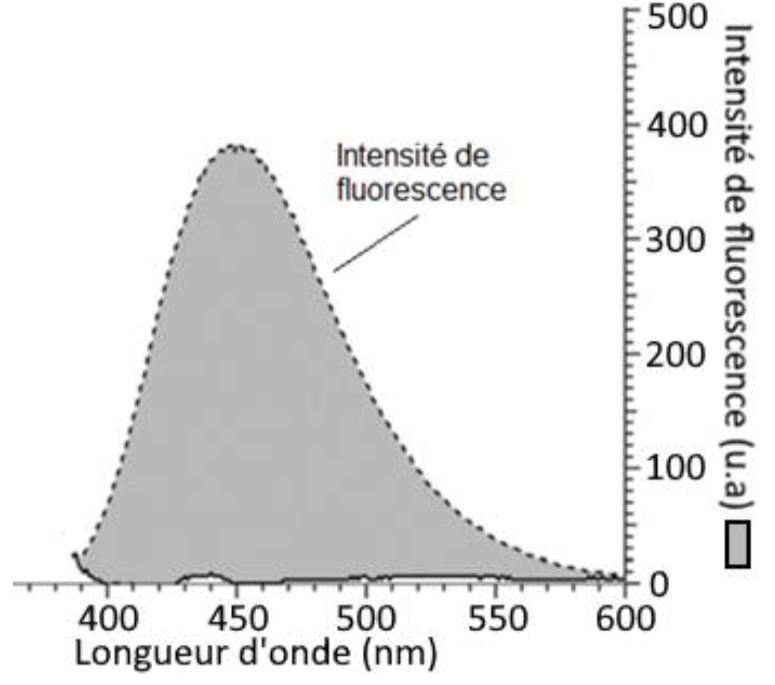
Source : d’après BUP n°944
- Sous irradiation UV, les formes QH22+ et QH+ émettent respectivement une fluorescence bleue et violette alors que la forme Q n’est pas fluorescente.
Partie A : Étude de la molécule de quinine et dosage de la quinine contenue dans le Schweppes®
1. Étude de la molécule de quinine
Q.1. Justifier le suffixe « -ol » dans le nom officiel de la quinine.
La quinine possède une liaison O-H , elle fait partie de la famille des alcools d’où le suffixe « -ol » dans le nom officiel de la quinine.
Q.2. Justifier, à l’aide de son spectre d’émission, la couleur de la lumière émise par fluorescence par une solution acidifiée de quinine.
Le spectre d’émission de quinine montre une émission autour de $\lambda_{max}=450\ \text{nm}$ (couleur bleu), la couleur de la lumière émise par fluorescence par une solution acidifiée de quinine est bleue.
Q.3. Représenter le diagramme de prédominance des différentes formes acido-basiques de la quinine. En déduire les couleurs de fluorescence attendues dans les différents domaines de pH.
Diagramme de prédominance :

D’après le sujet : « Sous irradiation UV, les formes QH22+ et QH+ émettent respectivement une fluorescence bleue et violette alors que la forme Q n’est pas fluorescente. »
Ainsi pour :
- $pH < pKa1 = 4,4$ : {QH}_2^{2+} est prédominant, la solution est bleue
- $pKa1 = 4,4 < pH < pKa2 = 9,0$ : QH+ est prédominant, la solution est violette
- $pH > pKa2 = 9,0$ : Q est prédominant, la solution est incolore
2. Dosage par étalonnage de la quinine contenue dans le Schweppes®
Pour déterminer la teneur en quinine du Schweppes®, il est possible de réaliser un dosage par spectrophotométrie de fluorescence.
Le dosage par fluorescence exploite le fait que l’intensité lumineuse provoquée par fluorescence If est proportionnelle à la concentration de l’espèce chimique fluorescente selon l’expression simplifiée suivante : If = K × I0 × C, avec If l’intensité de fluorescence (en unité arbitraire notée u.a), K une constante (en L·mol-1), I0 l’intensité de la source lumineuse incidente (en u.a), et C la concentration en quantité de matière de l’espèce chimique fluorescente (en mol·L-1).
Protocole expérimental :
Étape 1 : À partir d’une solution mère acidifiée de quinine S0 de concentration C0 = 1,30 × 10-5 mol·L-1, on prépare un volume Vf = 10,0 mL de solutions étalons de différentes concentrations Cf :
| S1 | S2 | S3 | S4 | S5 | |
| Cf (en mol·L-1) | 5,20 × 10-6 | 3,25 × 10-6 | 1,68 × 10-6 | 1,30 × 10-6 | 0,65 × 10-6 |
| If (unité arbitraire, u.a) | 728 | 480 | 253 | 219 | 116 |
Étape 2 : On mesure l’intensité de fluorescence à 450 nm de chaque solution étalon et on trace la courbe donnant l’intensité de fluorescence en fonction de la concentration. La courbe obtenue est la suivante :

Étape 3 : L’intensité de fluorescence mesurée pour une solution de Schweppes® diluée 100 fois est égale à 319 u.a.
Q.4. Calculer la valeur du volume de solution mère S0 à prélever pour préparer la solution S4.
Lors d’une dilution, la quantité de matière se conserve :
$$n_0=n_4$$
$$C_0V_0=C_4V_4$$
$$V_0=\frac{C_4V_4}{C_0}$$
$$V_0=\frac{1,30\times 10^{-6}\times 10,0\times 10^{-3}}{1,30\times 10^{-5}}$$
$$V_0=1,0\times 10^{-3}\ \text{L}$$
$$V_0=1,0\ \text{mL}$$
Q.5. Indiquer le protocole à suivre pour préparer cette solution, en précisant la verrerie utilisée.
Protocole expérimental :
- On prélève le volume $V_0 = 1,0\ \text{mL}$ à l’aide d’une pipette jaugée de 1,0 mL
- On introduit $V_0$ dans une fiole jaugée de volume $V_f = 10,0\ \text{mL}$
- On complète à l’eau distillée jusqu’au trait de jauge et on homogénéise.
Q.6. Justifier l’allure de la courbe obtenue lorsque l’on trace If = f(Cf).
$I_f = K\times I_0\times C$
If est proportionnel à la concentration C.
Ainsi, lorsque l’on trace $I_f = f(C_f)$ on obtient une droite passant par l’origine.
Q.7. Déterminer la valeur de la concentration en quantité de matière en quinine dans le Schweppes®.
L’intensité de fluorescence mesurée pour une solution de Schweppes® diluée 100 fois est égale à 319 u.a.
Graphiquement, pour If = 319 u.a :
$$C_{f,dilué}=2,2\times 10^{-6}\ \text{mol.L}^{-1}$$
Comme la solution a été diluée 100 fois :
$$C_{Schweppes}=100\times C_{f,dilué}$$
$$C_{Schweppes}=100\times 2,2\times 10^{-6}$$
$$C_{Schweppes}=2,2\times 10^{-4}\ \text{mol.L}^{-1}$$

Les boissons « tonic » peuvent contenir jusqu’à 100 mg·L-1 de quinine sans inconvénient pour la santé.
Q.8. Indiquer si le Schweppes® respecte ce critère.
$$C_m=C_{Schweppes}\times M$$
$$C_m=2,2\times 10^{-4}\times 324$$
$$C_m=7,1\times 10^{-2}\ \text{g.L}^{-1}$$
$$C_m=71\ \text{mg.L}^{-1}$$
La concentration est inférieure à 100 mg·L⁻¹ → Schweppes® conforme.
Q.9. Expliquer si une personne de 50 kg peut utiliser le Schweppes® pour le traitement du paludisme.
Le candidat est invité à prendre des initiatives et à présenter sa démarche. Toute démarche pertinente, même non aboutie, sera valorisée.
« … 3 prises de 8 mg/kg … »
Une personne de 50 kg doit consommer par jour :
$$3\times 8\times 10^{-3}\times 50=1,2\ \text{g}$$
Calcul du volume de Schweppes® correspondant :
$$C_m=\frac{m}{V}$$
$$V=\frac{m}{C_m}$$
$$V=\frac{1,2}{71\times 10^{-3}}$$
$$V=17\ \text{L}$$
Impossible d’ingurgiter 17 L donc traitement impossible.
Partie B : Dosage par titrage de l’acide citrique contenu dans le Schweppes®
Déjà critiquées pour leur teneur en sucres, en caféine et autres substances pas toujours identifiées, les sodas et les jus de fruits sont des boissons particulièrement acides. Consommées régulièrement dans la journée, elles attaquent les dents qui perdent de l’émail et deviennent plus sensibles.
Source : d’après Doctissimo
La teneur en acide citrique du Schweppes®, peut être mesurée par titrage pH-métrique.
Protocole expérimental :
20,0 mL de Schweppes® sont placés sous agitation pendant quelques heures dans un bécher pour dégazer la boisson. La boisson est alors titrée par une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)) de concentration CB = 0,100 mol·L-1.
L’acide citrique est un triacide qui réagit avec l’hydroxyde de sodium selon la réaction support du titrage dont l’équation est :
AH3(aq) + 3 HO–(aq) → A3-(aq) + 3 H2O(l)
La courbe du titrage est donnée ci-dessous :
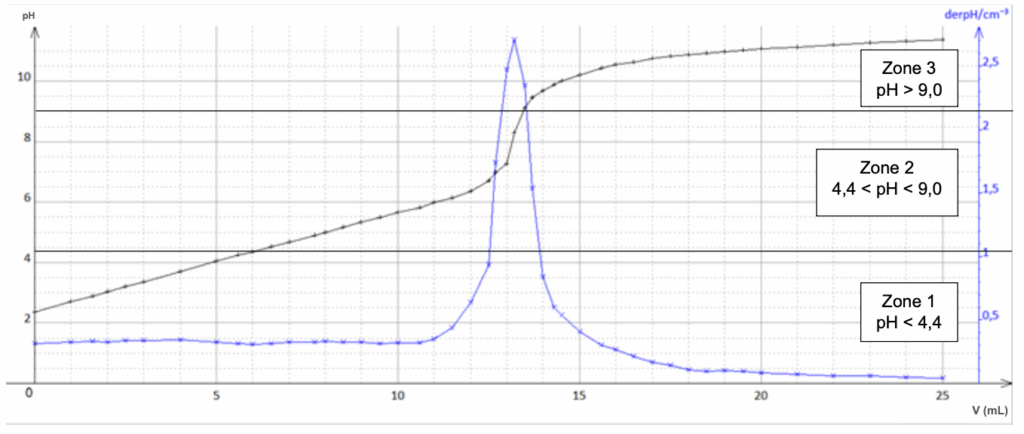
Données :
- les couples acide/base des espèces carbonatées sont :
- CO2, H2O(aq) / HCO3−(aq) ;
- HCO3−(aq) / CO32−(aq).
Q.10. Sélectionner parmi les termes suivants, la ou les qualité(s) que doit posséder la réaction support du titrage : lente, rapide, unique, multiple, totale, non-totale.
Les qualités : réaction rapide, unique et totale.
Q.11. Justifier la nécessité de dégazer par agitation la boisson avant de réaliser le titrage de l’acide citrique.
Le CO₂ est un acide et réagit avec NaOH.
On l’élimine avant titrage pour que NaOH ne réagisse qu’avec l’acide citrique.
Q.12. Déterminer, en détaillant la démarche suivie, la valeur de la concentration CA en acide citrique dans la boisson.
$$AH_{3(aq)}+3\ HO^-{(aq)} \rightleftarrows A^{3-}{(aq)}+3\ H_2O_{(l)}$$
À l’équivalence :
$$\frac{n_{AH_3}^i}{1}=\frac{n_{HO^-}^{eq}}{3}$$
$$C_A V = C_B V_{eq}$$
$$C_A = \frac{C_B V_{eq}}{3V}$$
Graphiquement $V_{eq}=13,2\ \text{mL}$
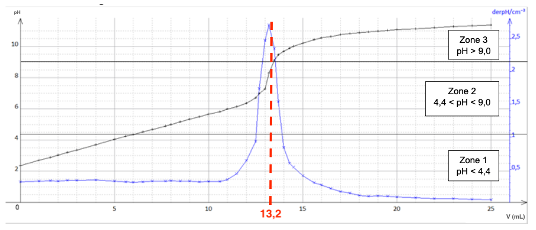
$$C_A=\frac{0,100\times 13,2\times 10^{-3}}{3\times 20,0\times 10^{-3}}$$
$$C_A=2,2\times 10^{-2}\ \text{mol.L}^{-1}$$
Q.13. Comparer cette valeur à la concentration maximale admissible en acide citrique qui est fixée à 7,8 × 10-2 mol·L-1.
$C_A=2,2\times 10^{-2}$ mol·L⁻¹ < $7,8\times 10^{-2}$ mol·L⁻¹ donc conforme.
Q.14. Indiquer, en justifiant la réponse, si on peut utiliser la quinine contenue dans le Schweppes® comme indicateur coloré dans le cas du dosage colorimétrique sous UV de l’acide citrique.
Les formes QH22+ et QH+ émettent respectivement une fluorescence bleue et violette alors que la forme Q n’est pas fluorescente.
En fonction du pH, l’espèce prédominante change (voir question Q3), donc la couleur de la solution change.
Ainsi, on peut utiliser la quinine contenue dans le Schweppes® comme indicateur coloré dans le cas du dosage colorimétrique sous UV de l’acide citrique.
