Asie 2022 Sujet 1
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 22-PYCJ1JA1
Un vin est une solution aqueuse qui contient en proportions diverses : des alcools (éthanol, glycérol…), des acides carboxyliques (acide citrique, acide tartrique, acide malique…), des esters (dont l’éthanoate d’éthyle), du dioxyde de soufre, des tanins, des sucres, des ions fer (II) Fe2+ et fer Fe3+, etc. Ces différents composants contribuent à la saveur du vin.
Dans cet exercice, on s’intéresse à deux de ces composants :
Dans cet exercice, on s’intéresse à deux de ces composants :
- le fer, susceptible de causer la « casse » d’un vin blanc (partie A) ;
- un ester, l’éthanoate d’éthyle, qui contribue à l’arôme du vin (partie B).
Partie A – Dosage spectrophotométrique des ions fer dans un vin
Un vin blanc contient du fer sous forme d’ions fer (II), Fe2+(aq), et fer (III), Fe3+(aq). Ce fer provient en faibles proportions du raisin. Pour la majeure partie, il provient du matériel utilisé lors de la vinification.
Si la teneur en fer dépasse 10 mg·L-1, on peut craindre la formation d’un précipité blanc dans le vin à l’origine d’un trouble appelé casse blanche pour le vin blanc.
L’objectif de cette partie A est de déterminer le risque de casse blanche d’un vin blanc.
Pour cela, on procède à un titrage spectrophotométrique des ions fer après les avoir fait réagir avec des ions thiocyanate pour former une espèce colorée en solution. En pratique, on procède ainsi :
- On oxyde la totalité des ions fer (II) en ions fer (III) par ajout d’eau oxygénée en milieu acide.
- On ajoute une solution de thiocyanate de potassium pour faire réagir les ions fer (III) avec les ions thiocyanate et former des ions thiocyanatofer(III) [Fe(SCN)]2+(aq), selon l’équation de réaction :
Fe3+(aq) + SCN–(aq) → [Fe(SCN)]2+(aq)
- On obtient une solution aqueuse dont la couleur rouge est due aux ions [Fe(SCN)]2+(aq).
- On procède à un titrage par spectrophotométrie après avoir réalisé un étalonnage. On détermine ainsi la concentration en masse en ion fer (III) correspondant à la concentration totale en masse des ions fer (II) et (III).
Données :
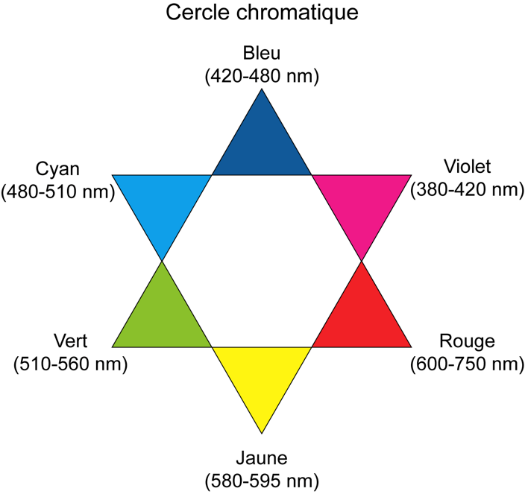
- Cercle chromatique. Dans cette présentation, les couleurs complémentaires sont placées en vis-à-vis sur un même diamètre.
Réglage du spectrophotomètre
On donne ci-dessous le spectre d’absorption de l’ion [Fe(SCN)] 2+ en phase aqueuse.
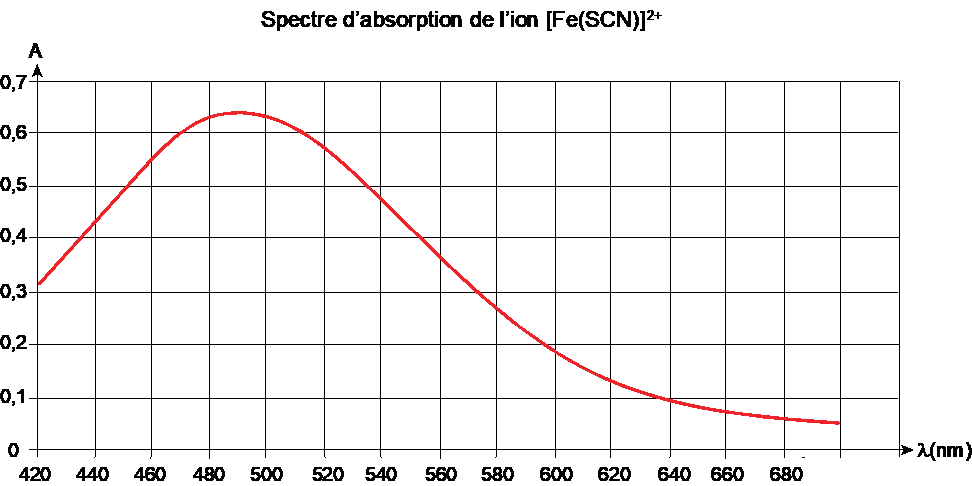
1. Indiquer la couleur correspondant aux radiations les plus absorbées par l’ion [Fe(SCN)] 2+ et justifier ainsi la couleur de la solution.
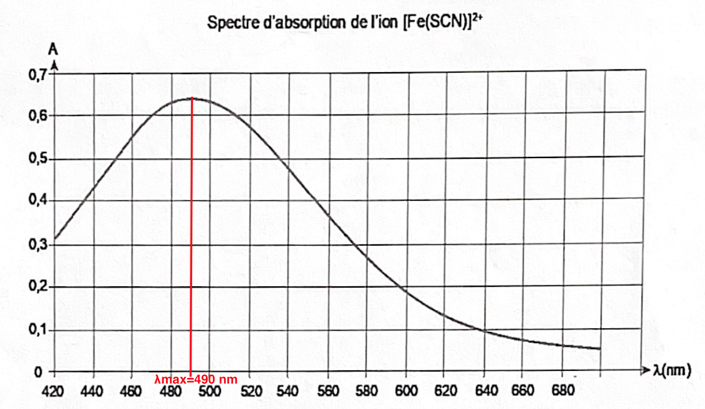
La couleur absorbée correspond à λmax=490 nm couleur cyan.
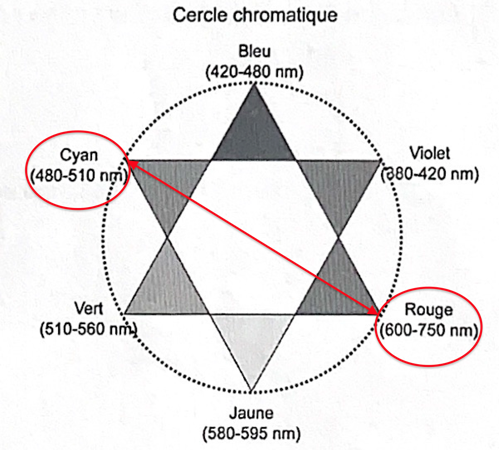
Sa couleur est la couleur complémentaire du cyan (couleur opposée sur la cercle chromatique) : le rouge.
La solution est donc de couleur rouge.
2. Proposer une longueur d’onde à utiliser pour réaliser le titrage.
λmax=490 nm
Préparation des solutions étalons
Pour préparer les solutions étalons, on met en œuvre le protocole suivant :
- Préparer 5 solutions étalons d’ions fer (III) numérotées de 1 à 5 par dilution d’une solution mère S0 d’ions fer (III) de concentration en masse en ions fer (III) égale à 𝑡0 = 100 mg ⋅ L−1.
| Numéro de solution étalon | 1 | 2 | 3 | 4 | 5 |
| 𝑡(Fe3+) en mg ⋅ L−1 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
- Verser 10,0 mL de chaque solution dans un bécher.
- Ajouter 1,0 mL d’acide chlorhydrique concentré et 1,0 mL de solution de thiocyanate de potassium de concentration molaire égale à 1,0 mol·L-1.
Les ions thiocyanate sont alors en excès dans chacune des solutions.
3. Préciser pourquoi il est nécessaire que les ions thiocyanate soient apportés en excès dans chaque solution.
« on ajoute une solution de thiocianate de potassium pour faire réagir les ions fer (III) avec les ions thiocianate et former des ions thiocianatofer(II) [Fe(SCN)] 2+ selon l’équation :
Fe3+(aq) + SCN–(aq) → [Fe(SCN)]2+(aq) »
Pour que tous les ions Fe3+ réagissent il faut qu’ils ne constituent pas le réactif limitant. Ainsi, on apporte les ions thiocianate SCN– en excès.
4. Déterminer le volume V0 de solution mère S0 à prélever pour préparer V2 = 50,0 mL de la solution étalon n° 2.
Lors d’une dilution, la quantité de matière se conserve :
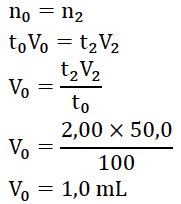
Mesures et analyse
Pour déterminer la teneur en fer du vin blanc étudié, on prépare une solution de vin, notée SV, en mélangeant :
- 10,0 mL de vin blanc,
- 1,0 mL d’acide chlorhydrique concentré et 1,0 mL de solution de thiocyanate de potassium de concentration molaire égale à 1,0 mol·L-1,
- 4 gouttes d’eau oxygénée à 20 volumes (sans incidence sur le volume).
Par la suite :
- On mesure l’absorbance des 5 solutions étalons.
- On trace une courbe d’étalonnage.
- On mesure l’absorbance Av de la solution de vin SV.
On a placé les points des mesures dans un graphique donnant l’absorbance en fonction de la concentration. La droite a été ajoutée pour mettre en évidence une tendance dans la répartition des points de mesure.
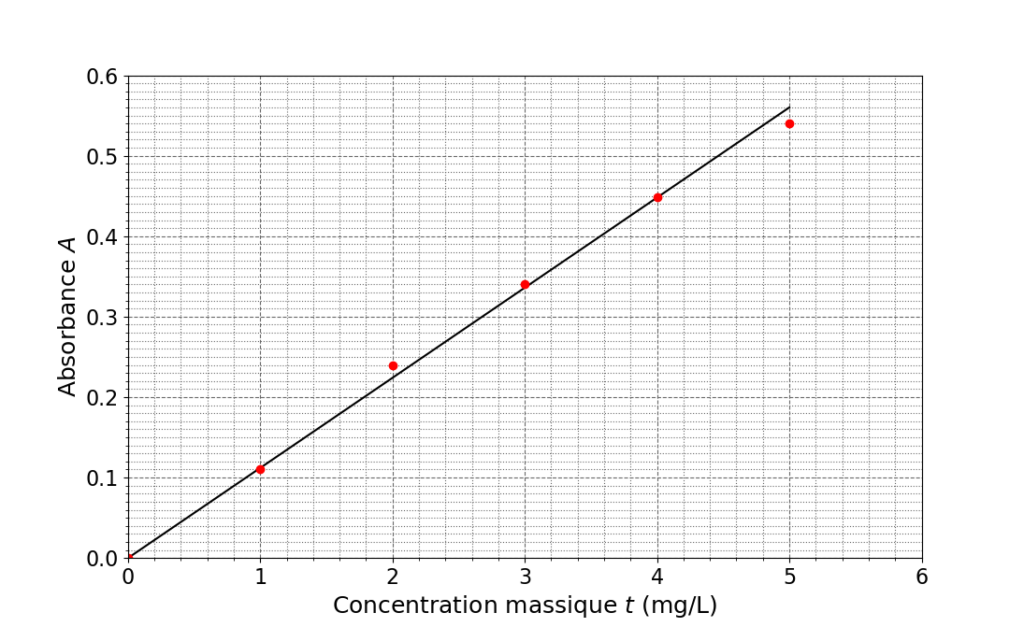
5. Préciser la forme de la relation entre l’absorbance A et la concentration massique t ainsi mise en évidence. Donner le nom de la loi correspondante.
Le graphique est une droite passant par l’origine : A et t sont proportionnel ainsi A=Kt .
C’est la loi de Beer Lambert.
Pour la solution de vin, on trouve : AV = 0,16.
6. Déterminer si le vin étudié présente un risque de casse blanche. Justifier.
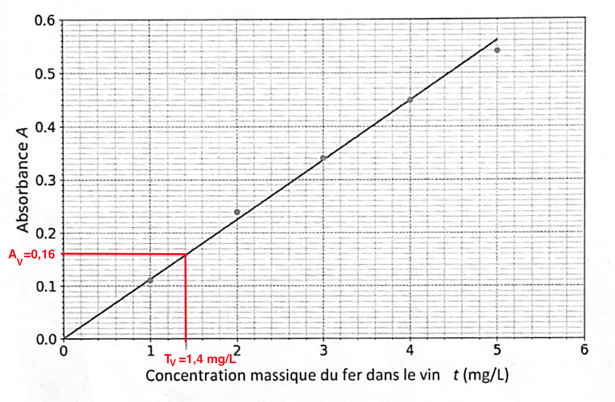
Graphiquement pour AV=0,16 : tV=1,4 mg/L
On à préparé SV en mélangeant 10 mL de vin blanc, 1,0 mL d’acide chlorhydrique et 1,0 mL de solution de thiocianate de potassium soit VV=12 mL. Le vin à subit une dilution. Lors d’une dilution, la quantité de matière se conserve :
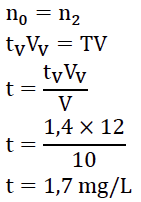
La teneur est inferieure à 10mg/L, il n’y a pas de risque de casse blanche.
Partie B – Synthèse d’un ester du vin en laboratoire
Les esters sont des molécules organiques qui participent à la richesse de l’arôme d’un vin. La synthèse de ces esters lors du processus biologique de vinification est lente et peut durer plusieurs mois.
Dans cette partie, on s’intéresse à cette durée de plusieurs mois mentionnée comme nécessaire à la production des esters en cherchant à la relier aux conditions expérimentales. Pour cela, on étudie la formation de l’un de ces esters au cours du temps, l’éthanoate d’éthyle, suivant un protocole en laboratoire.
L’équation de la réaction de synthèse de l’éthanoate d’éthyle est :
CH3COOH + CH3CH2OH ⇌ CH3COOCH2CH3 + H2O (1)
Données :
- Zone de virage du bleu de thymol : (pH = 8,0 ; pH = 9,6).
- Masses volumiques et masses molaires de quelques espèces chimiques.
| Masse volumique à 25 °C (g·mL-1) | Masse molaire (g·mol-1) | |
| Acide éthanoïque | 1,05 | 60,0 |
| Éthanol | 0,789 | 46,0 |
| Éthanoate d’éthyle | 0,902 | 88,0 |
| Eau | 1,00 | 18,0 |
Pour réaliser l’étude cinétique de cette synthèse, on met en œuvre le protocole suivant.
- Mélanger 115 mL d’acide éthanoïque pur et 117 mL d’éthanol pur. Conserver le mélange dans un bain eau-glace.
- Introduire 2,0 mL du mélange réactionnel dans 7 tubes numérotés de 0 à 6. Les conserver dans un bain eau-glace.
- Préparer une burette graduée contenant une solution d’hydroxyde de sodium (Na+(aq) + HO– (aq)) de concentration 𝐶𝐵 = 1,0 mol ⋅ L−1.
- À la date 𝑡 = 0 :
- Immerger les tubes 1 à 6 dans un bain marie d’eau bouillante.
- Placer le tube 0 à température ambiante.
- Aux dates t1 = 2 min, t2 = 7 min, t3 = 12 min, t4 = 20 min, t5 = 35 min et t6 = 50 min :
- Retirer du bain-marie le tube « 𝑖 » correspondant à la date « 𝑡𝑖 » et le plonger immédiatement dans un bain eau-glace.
- Titrer l’acide éthanoïque du milieu réactionnel du tube « 𝑖 » par une solution d’hydroxyde de sodium.
7. Expliquer pourquoi le mélange réactionnel est placé dans un bain d’eau glacée avant l’instant 𝑡 = 0 et avant titrage.
On place le mélange réactionnel dans un bain d’eau glacée pour stopper la réaction.
Avant l’instant t=0 pour que la réaction ne débute pas.
Avant le titrage pour que la réaction s’arête et doser sans que la quantité restante d’acide éthanoïque ne change.
8. Montrer que le mélange réactionnel préparé est équimolaire.
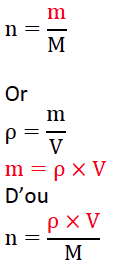

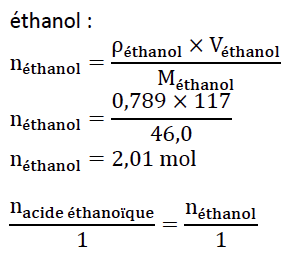
Les réactifs ont été introduits dans les proportions stoechiométrique.
9. Vérifier que la quantité d’acide contenu dans chaque tube à la date 𝑡 = 0 est :
𝑛0 = 17,3 mmol

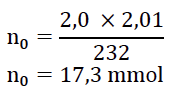
Après avoir refroidi un tube pour stopper la réaction d’estérification, on procède au titrage de l’acide éthanoïque restant dans le tube à l’aide d’une solution d’hydroxyde de sodium de concentration 𝐶𝐵, en présence de bleu de thymol. Pour le tube « 𝑖 », le volume de la solution titrante versée à l’équivalence est noté 𝑉𝐵,𝑖.
La réaction support du titrage a pour équation :
CH3COOH (aq) + HO–(aq) → CH3COO–(aq) + H2O (2)
10. Expliquer le rôle du bleu de thymol.
Le bleu de thymol jour le rôle d’indicateur coloré. Il permet d’identifier l’équivalence lors du titrage.
11. Définir l’équivalence pour la réaction support de titrage (2).
A l’équivalence, les réactifs ont été introduits dans les proportions stoechiométrique :
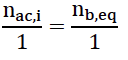
12. En déduire que la quantité d’acide restant n𝑎𝑐,𝑖 à la date t𝑖 dans un tube « 𝑖 » est donnée par :
n𝑎𝑐,𝑖 = 𝐶𝐵 𝑉𝐵,𝑖
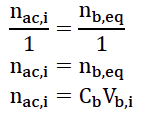
On note n𝑖 la quantité d’éthanoate d’éthyle produite dans le tube « 𝑖 ». On cherche à relier cette quantité 𝑛𝑖 à la quantité d’acide restante n𝑎𝑐,𝑖.
13. Etablir le tableau d’avancement de la transformation chimique modélisée par la réaction (1) faisant apparaitre l’état initial (avancement 𝑥 = 0) et l’état final (avancement 𝑥𝑓).
Construisons un tableau d’avancement :
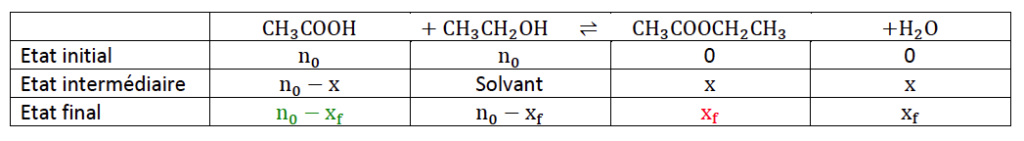
14. Montrer que la quantité 𝑛𝑖 d’éthanoate d’éthyle présente dans un tube « 𝑖 » à la date 𝑡𝑖 est donnée par la relation :
𝑛𝑖 = 𝑛0 − 𝐶𝐵 𝑉𝐵,𝑖
Soit la ni quantité d’éthanoate d’éthyle produite dans le tube « i » :
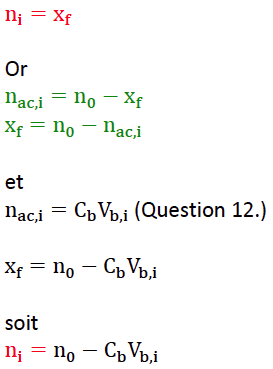
Le tableau ci-dessous regroupe les résultats expérimentaux.
| Tube 𝑖 | 1 | 2 | 3 | 4 | 5 | 6 |
| 𝑉𝐵,𝑖 (mL) | 15,3 | 11,3 | 9,3 | 7,3 | 6,3 | 6,3 |
| Quantité de matière d’ester n𝑖 (mol) | 2,0×10-3 | 8,0×10-3 | 1,0×10-2 | 1,1×10-2 | 1,1×10-2 |
15. Donner la valeur de la quantité de matière 𝑛2 manquante dans le tableau.
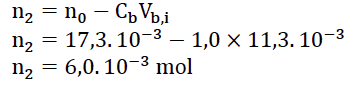
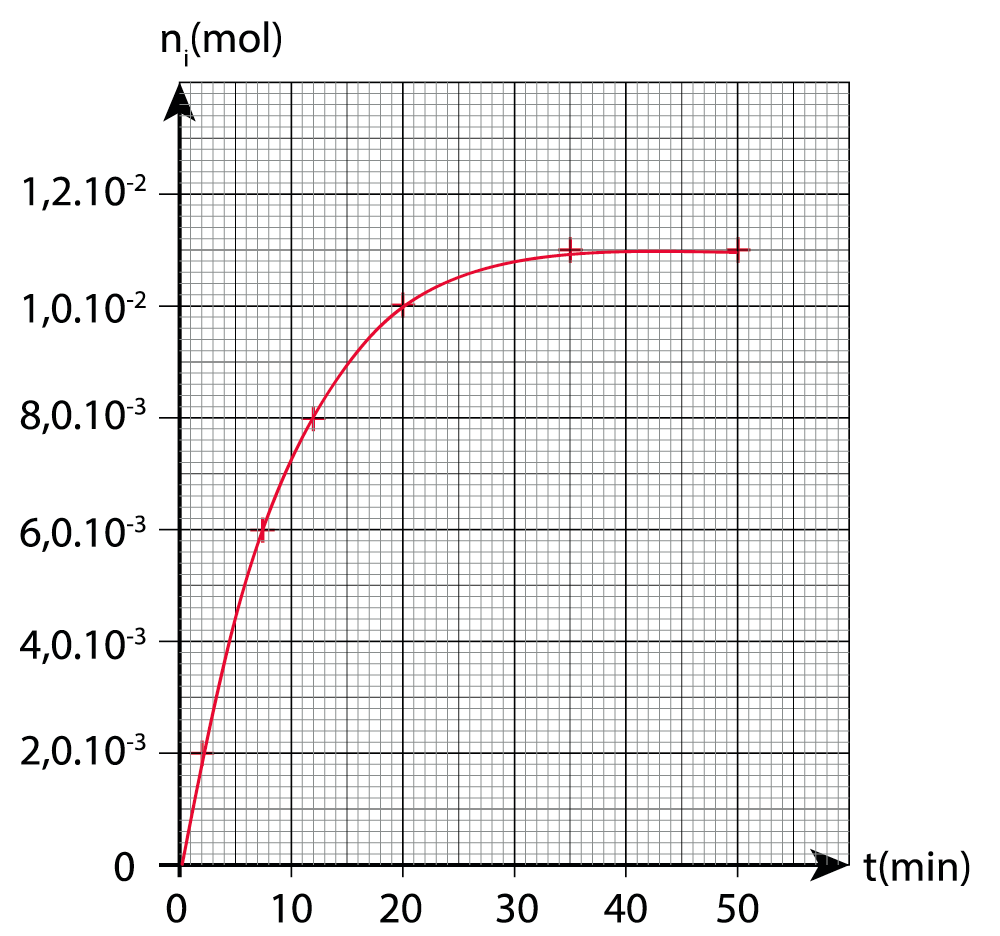
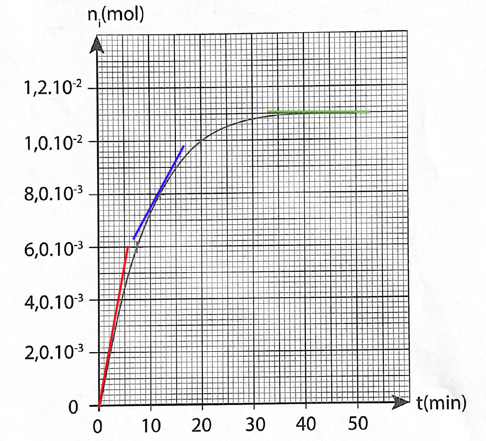
Le graphique représentant la quantité de matière n𝑖 d’ester formé en fonction du temps est disponible en ANNEXE PAGE 15/16 À RENDRE AVEC LA COPIE.
16. Indiquer qualitativement comment évolue la vitesse volumique d’apparition de l’ester au cours du temps.
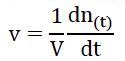
Or la dérivée se calcul en trouvant le coefficient directeur de la tangente en un point de la courbe.
Graphiquement le coefficient directeur de la tangente diminue au cours du temps.
17. Déterminer la valeur de la vitesse volumique d’apparition de l’ester à la date t = 20 min.
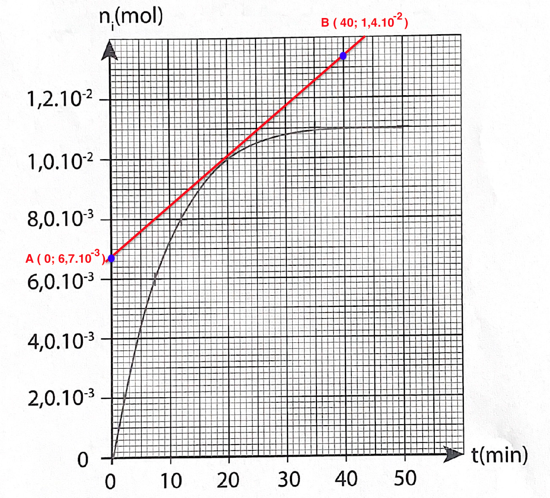
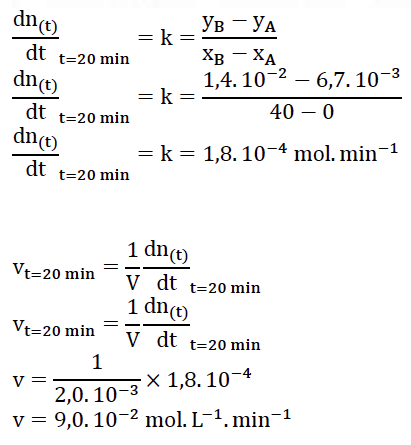
18. Définir le temps de demi-réaction t1/2 et le déterminer par une construction graphique sur la courbe EN ANNEXE PAGE 15/16 À RENDRE AVEC LA COPIE.
t1/2 est la durée nécessaire pour que la concentration du réactif atteigne la moitié de sa valeur initiale : x(t1/2) = xf/2.
n(t=t1/2)=nf/2
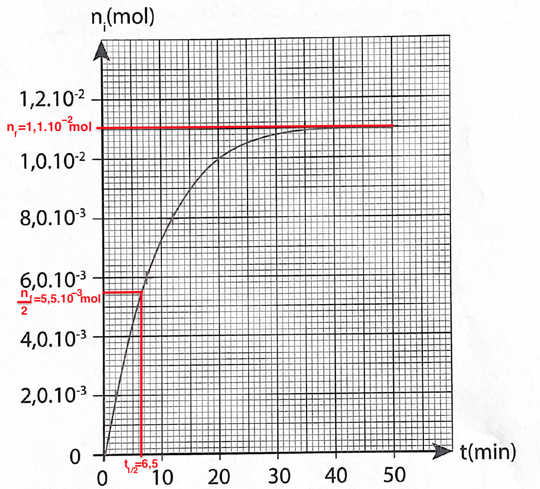
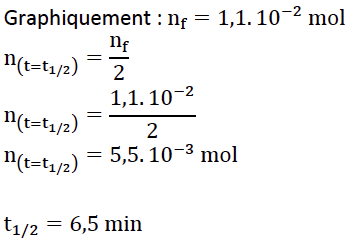
19. Comparer ce temps de demi-réaction à l’échelle de temps évoquée en introduction pour la production des esters dans le vin. Proposer une explication à l’écart en raisonnant sur les paramètres pouvant avoir une incidence sur la valeur de t1/2.
« La synthèse de ces esters lors du processus biologique de vinification est lente et peut durer plusieurs mois. »
Nous avons un t1/2 très inferieur à l’échelle de temps évoque de 1 mois.
Une hypothèse pouvant expliquer l’écart :
Dans notre expérience les réactifs sont purs, ils ne sont pas dilués. La concentration est élevée, ainsi la vitesse de réaction est plus élevée.
ANNEXE PAGE 15/16 À RENDRE AVEC LA COPIE.