Bac Asie 2021 Sujet 1
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1JA1
Mots-clés : réaction d’oxydo-réduction, titrage, évolution temporelle d’un système chimique.
Les solutions hydroalcooliques sont préconisées pour éliminer les bactéries et les virus notamment lors d’épidémies telles que la grippe.
Pour fabriquer une solution hydroalcoolique, il faut de l’alcool, une solution d’eau oxygénée contenant du peroxyde d’hydrogène et du glycérol. L’eau oxygénée doit avoir un pourcentage en masse de peroxyde d’hydrogène au moins égale à 3,0 %.

Toutefois, le peroxyde d’hydrogène H2O2, contenu dans la solution d’eau oxygénée du flacon, est une espèce chimique instable qui se décompose en formant du dioxygène et de l’eau, ce qui entraîne une diminution progressive de la concentration en peroxyde d’hydrogène de la solution d’eau oxygénée.
L’étude porte sur l’analyse de la composition de la solution contenue dans une bouteille d’eau oxygénée stockée dans une armoire à pharmacie depuis une date indéterminée. L’objectif est de déterminer si elle est encore utilisable pour réaliser une solution hydroalcoolique et, si oui, pendant combien de temps encore.
A cette fin :
- On réalise le titrage du peroxyde d’hydrogène contenu dans la bouteille d’eau oxygénée de l’armoire à pharmacie (document 1).
- On analyse l’évolution de la concentration en peroxyde d’hydrogène dans une solution d’eau oxygénée selon les conditions de conservation (document 2).
Document 1. Titrage de l’eau oxygénée de l’armoire à pharmacie
Principe du titrage :
Ce titrage fait intervenir une transformation modélisée par une réaction d’oxydoréduction entre le peroxyde d’hydrogène H2O2 et l’ion permanganate MnO4– . Toutes les espèces sont incolores sauf l’ion permanganate qui est de couleur rose violacée en solution aqueuse.
L’équation de la réaction support du titrage est :
2 MnO4–(aq) + 5 H2O2 (aq) + 6 H+(aq) → 2 Mn2+(aq) + 5 O2(g) + 8 H2O(ℓ)
Protocole du titrage :
(a) Prélever, à l’aide d’une pipette jaugée, un volume 𝑉𝑖 = 5,0 mL de la solution d’eau oxygénée commerciale S et les verser dans une fiole jaugée de volume 𝑉f = 100,0 mL. Compléter avec de l’eau distillée en veillant à homogénéiser. Soit S′ la solution obtenue.
(b) Prélever un volume 𝑉1 = 10,0 mL de la solution S’ et le verser dans un bécher.
(c) Ajouter dans ce bécher quelques gouttes d’acide sulfurique concentré. Mettre en route l’agitation.
(d) Procéder au titrage, avec comme solution titrante une solution de permanganate de potassium de concentration 𝐶2 = 2,0 × 10−2 mol ⋅ L−1.
Résultat du titrage :
Le volume équivalent obtenu est 𝑉𝐸 = 8,9 mL.
Document 2. Evolution de la concentration du peroxyde d’hydrogène dans l’eau oxygénée en fonction des conditions de conservation
Concentration de H2O2 en mol·L-1
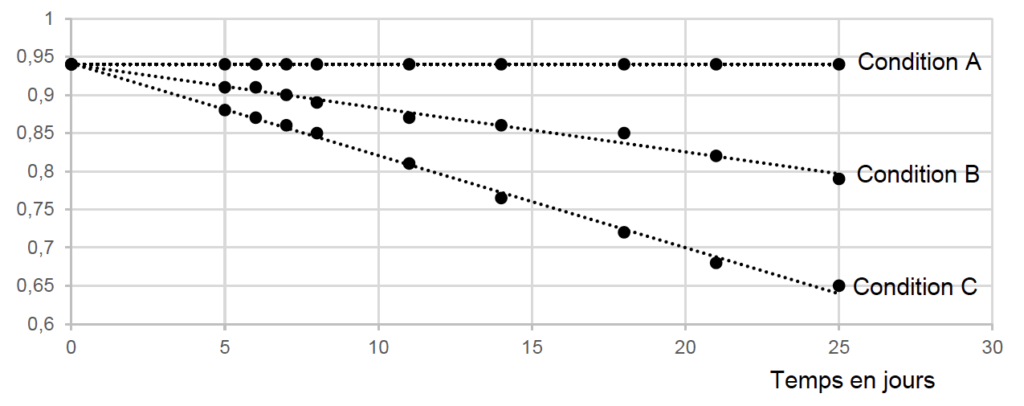
- Condition A : conservation à basse température (5°C) et à l’abri de la lumière.
- Condition B : conservation à température ambiante (25°C) et à l’abri de la lumière.
- Condition C : conservation à température ambiante (25°C) et exposée à la lumière.
Données à 25 °C :
- Une solution de pourcentage massique égal à 𝑥 % signifie que 100 g de cette solution contient 𝑥 g de la substance active.
- Masse volumique d’une solution d’eau oxygénée à 3,0 % : 960 g ⋅ L−1.
- Masse molaire moléculaire du peroxyde d’hydrogène : 𝑀(H2O2) = 34,0 g ⋅ mol−1.
Questions préliminaires
1. En analysant les tracés correspondant aux conditions de conservation A, B et C, préciser les facteurs d’influence de la conservation de l’eau oxygénée et les conditions optimales de conservation.
2. Vérifier que la concentration molaire minimale en peroxyde d’hydrogène dans l’eau oxygénée utilisée pour la préparation d’une solution hydroalcoolique est de 0,85 mol⋅L−1.
3. Déterminer la concentration en peroxyde d’hydrogène dans la solution contenue dans la bouteille de l’armoire à pharmacie.
Réponse à la problématique :
La bouteille d’eau oxygénée de l’armoire à pharmacie est conservée à température ambiante et à l’abri de la lumière.
4. Les conditions restant inchangées, montrer qu’il reste moins de dix jours pour utiliser la solution commerciale d’eau oxygénée de l’armoire à pharmacie pour préparer une solution hydroalcoolique.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
