E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02701 et n°G1SPHCH02740
Télécharger l’exercice en PDF :
Les hydrogels sont des gels qui ont la propriété de gonfler en présence d’eau car ils sont super absorbants. Ils sont constitués de polymères, macromolécules de masses molaires élevées constituées de la répétition d’un grand nombre de sous-unités. Ils présentent de nombreuses applications biomédicales : traitement de brûlures, délivrance de médicaments etc.
On s’intéresse aux hydrogels Haraguchi, hydrogels très élastiques puisqu’ils peuvent s’étirer jusqu’à 25 fois leur longueur et qui possèdent des propriétés cicatrisantes étonnantes. Par exemple, lorsque l’on coupe un hydrogel Haraguchi en deux, puis que l’on appose côte à côte les deux parties, le gel se reforme de lui-même.
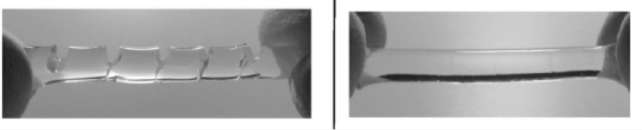
D’après publication de K.Haraguchi https://onlinelibrary.wiley.com/doi/abs/10.1002/marc.201100248
L’objectif de cet exercice est de s’intéresser aux espèces chimiques et solutions mises en jeu dans le protocole expérimental de synthèse d’hydrogels Haraguchi rédigé ci-après :
- dans un ballon de 50 mL, introduire un volume de 5 mL d’eau distillée ;
- introduire un volume de 1,0 mL d’une solution aqueuse de persulfate de potassium de concentration molaire apportée en persulfate de potassium C = 1,85 × 10 -1 mol.L-1 ;
- introduire 24 μL de TEMED (N,N,N’,N’- tétraméthyléthylènediamine), et 3,0 mL d’une solution aqueuse de DMAA (N,N – diméthylacrylamide) ;
- agiter la solution pendant une durée de 15 minutes sous atmosphère de diazote ;
- ajouter une solution de laponite (petites billes d’argile) et garder 2 minutes sous agitation ;
- verser le mélange dans un moule et laisser sécher au moins douze heures.
D’après ESPCI : https://blog.espci.fr/pse1/files/2018/06/materiel-et-methodes-Haraguchi.pdf
Données
- Extrait des trois premières lignes du tableau périodique :
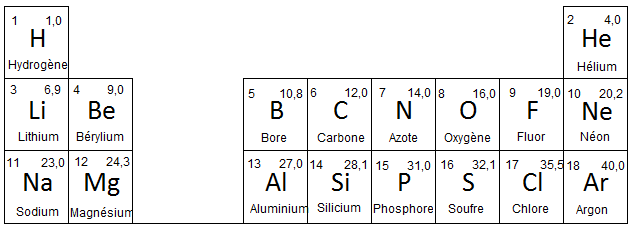
- Les atomes d’oxygène O et d’azote N sont bien plus électronégatifs que les atomes de carbone C et d’hydrogène H.
- On considère, pour simplifier, que les électronégativités du carbone et de l’hydrogène sont semblables.
- Caractéristiques des réactifs utilisés dans la synthèse
| Nom | Formule | Masse molaire | Pictogrammes |
|---|---|---|---|
| Persulfate de potassium | K2S2O8(s) | 270 g.mol-1 |  |
| DMAA | 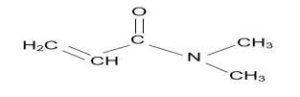 | 99,1 g.mol-1 |  |
| TEMED | 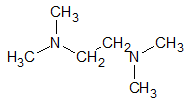 | 116 g.mol-1 |  |
1. Donner les précautions à prendre pour réaliser la synthèse d’hydrogels Haraguchi au laboratoire.
La synthèse d’hydrogels Haraguchi nécessite du persulfate de potassium, du TEMED et du DMAA.
D’après les pictogrammes de sécurité :
- le persulfate de potassium est un comburant, nocif ou irritant et cancérogène
- le TEMED est corrosif, dangereux pour l’environnement et inflammable
- le DMAA est corrosif, dangereux pour l’environnement et inflammable
Voici précautions à prendre lors de cette étape de la synthèse :
- Port de blouse, gants et lunette de protection
- Travail sous hotte aspirante, loin de toute flamme.
- Ne rien déverser à l’évier.
2. La configuration électronique du potassium K est 1s22s22p63s23p64s1. Écrire la formule de l’ion potassium. Justifier. En déduire la charge de l’ion persulfate associé à l’ion potassium dans persulfate de potassium K2S2O8.
La configuration électronique du potassium K est 1s22s22p63s23p64s1, il tend à avoir une couche pleine. Ainsi il va perdre un électron et devenir K+ de configuration électronique 1s22s22p63s23p6.
Le persulfate de potassium K2S2O8 est électriquement neutre, c’est un solide ionique composé de deux ions potassium K+ et de l’ion persulfate. Pour que le solide soit électriquement neutre, la charge de l’ion persulfate doit compenser celle des deux ions K+, ainsi l’ion persulfate s’écrit S2O82-.
3. Citer l’interaction à l’origine de la cohésion du persulfate de potassium solide.
Les ions sont chargés, ainsi l’interaction à l’origine de la cohésion du persulfate de potassium solide est l’interaction électrostatique.
4. Écrire l’équation de la réaction de dissolution du persulfate de potassium solide dans l’eau.
$K_2S_2O_{8(s)}\rightarrow S_2O_{8(aq)}^{2-}+2K_{(aq)}^+$
À partir de persulfate de potassium solide, on souhaite préparer un volume V = 100 mL de solution aqueuse de persulfate de potassium de concentration molaire apportée en persulfate de potassium C = 1,85 × 10 -1 mol.L-1.
5. Rédiger le protocole expérimental permettant de réaliser cette solution en précisant la verrerie, les volumes et masses prélevés.
Calculons la masse à prélever :
$n=\frac{m}{M}$
$m=n\times M$
Or
$c=\frac{n}{V}$
$n=c\times V$
Ainsi
$m=c\times V\times M$
$m=1,85.10^{-1}\times100.10^{-3}\times270=5,00\ g$
Protocole de dissolution :
- Peser précisément la masse 5,00 g de persulfate de potassium solide dans une coupelle.
- Prendre une fiole jaugée de 100 mL et introduire à l’aide d’un entonnoir la masse m pesée
- Remplir la fiole jaugée au ¾ avec de l’eau distillée.
- Boucher la fiole et agiter.
- Remplir la fiole jaugée jusqu’au trait de jauge avec de l’eau distillée.
- Boucher la fiole et agiter pour homogénéiser
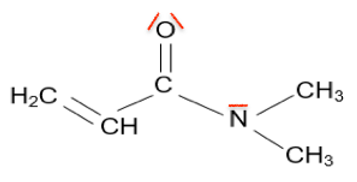
6. Établir la représentation de Lewis de la molécule de DMAA et préciser la géométrie de cette molécule autour de l’atome d’azote. Justifier.
| Atome | Numéro atomique | Configuration électronique | Nombre de doublets liants | Nombre de doublets non liants |
| H | 1 | 1s1 | 1 | 0 |
| C | 6 | 1s2 2s2 2p2 | 4 | 0 |
| N | 7 | 1s2 2s2 2p3 | 3 | 1 |
| O | 8 | 1s2 2s2 2p4 | 2 | 2 |
Représentation de Lewis de la molécule de DMAA
Géométrie de cette molécule autour de l’atome d’azote : pyramidale à base triangulaire.
7. La molécule de DMAA est une molécule polaire. Parmi les liaisons chimiques de cette molécule de DMAA, préciser celles qui sont polarisées.
Les atomes d’oxygène O et d’azote N sont bien plus électronégatifs que les atomes de carbone C et d’hydrogène H.
Ainsi les liaisons C=O et N-C sont polarisées.
8. En détaillant le raisonnement, expliquer pourquoi la molécule d’eau est polaire. Un schéma est attendu. Justifier alors l’emploi de l’eau comme solvant dans cette synthèse.
Les liaisons O-H sont polarisées.
La géométrie de la molécule d’eau est coudée.
Le barycentre des charges positives et le barycentre des charges négatives ne sont pas confondus.
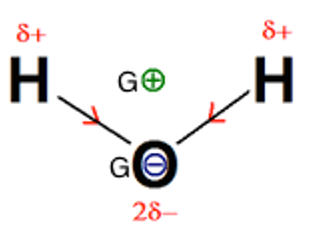
Ainsi la molécule d’eau est polaire.
La DMAA est polaire ainsi elle est soluble dans les solvants polaires comme l’eau.
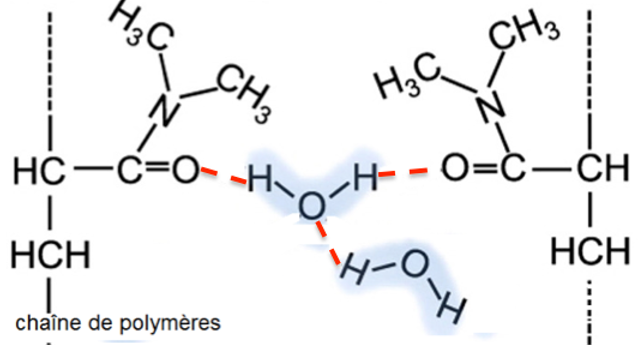
Ci-dessous sont représentées de manière simplifiée des macromolécules d’hydrogels synthétisées avec notamment les substituants aux chaînes de polymères provenant du DMAA :
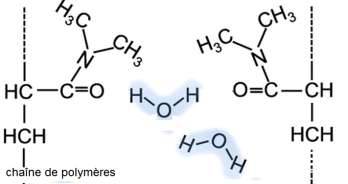
9. Nommer la (les) interaction(s) qui existe(nt) entre l’hydrogel et l’eau et expliquer succinctement pourquoi l’on parle d’hydrogels « superabsorbants ».
Il existe des liaisons hydrogène entre l’hydrogel et l’eau.
Ainsi les molécules d’eau s’insèrent entre les chaines de polymère, c’est pourquoi on parle d’hydrogels « superabsorbants ».
Des histogrammes représentant le pourcentage d’élongation à la rupture* en fonction de la quantité de matière de laponite sont représentés ci-dessous pour des échantillons témoins (échantillons neufs) et des échantillons cicatrisés, c’est-à-dire coupés en deux puis apposés côte à côte pour permettre l’autocicatrisation du gel.
* L’élongation à la rupture est l’élongation maximale supportée par l’échantillon d’hydrogels Haraguchi avant qu’il ne se fracture.
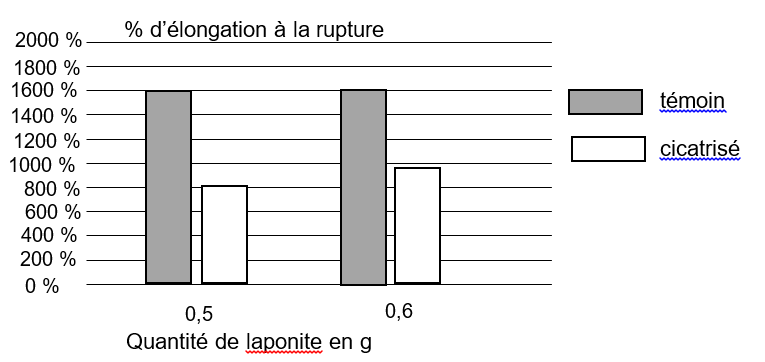
10. Commenter ces histogrammes.
Quelque soit la quantité de laponite, un échantillon témoin à un pourcentage d’élongation identique (1600%).
Un échantillon cicatrisé à un pourcentage d’élongation plus faible qu’un échantillon témoin.
Cependant, quand la quantité de laponite est plus grande, un échantillon cicatrisé à un pourcentage d’élongation qui est plus grand.
