Métropole Septembre 2025 Sujet 2
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ2ME3
Sujet et corrigé
Exercice 1 – Les pluies acides (9 points)
Formées à partir du dioxyde de soufre et des oxydes d’azote liés aux activités humaines et rejetés dans l’atmosphère, les pluies acides engendrent des problèmes de santé. Elles ont aussi des conséquences visibles sur le sol, la flore et la faune, les métaux, etc. Les pierres calcaires de nombreux bâtiments et statues sont également détériorées par ces pluies acides.
D’après https://www.futura-sciences.com

Le but de cet exercice est d’étudier l’origine des pluies acides ainsi que leurs conséquences sur les bâtiments et les statues, et enfin d’analyser un protocole de contrôle de qualité de l’air.
Données :
- masse molaire du carbonate de calcium : M(CaCO3) = 100,1 g·mol–1 ;
- masse molaire du dioxyde de soufre : M(SO2) = 64,1 g·mol–1 ;
- constante des gaz parfaits : R = 8,31 J·K–1·mol–1 ;
- masse volumique de l’eau : ρ(eau) = 1,00×103 g·L–1 ;
- concentration standard : c° = 1 mol·L–1 ;
- espèces chimiques carbonées en solution : CO2(aq), HCO3 –(aq) et CO32–(aq).
1. Origine des pluies acides
L’eau de pluie non polluée est naturellement acide et son pH est d’environ 5,6 à 25 °C. Cette acidité est due à la dissolution dans l’eau du dioxyde de carbone CO2. La concentration à l’équilibre en dioxyde de carbone dissous dans une eau de pluie non polluée à 25 °C est [CO2] = 1,3×10–5 mol·L–1.
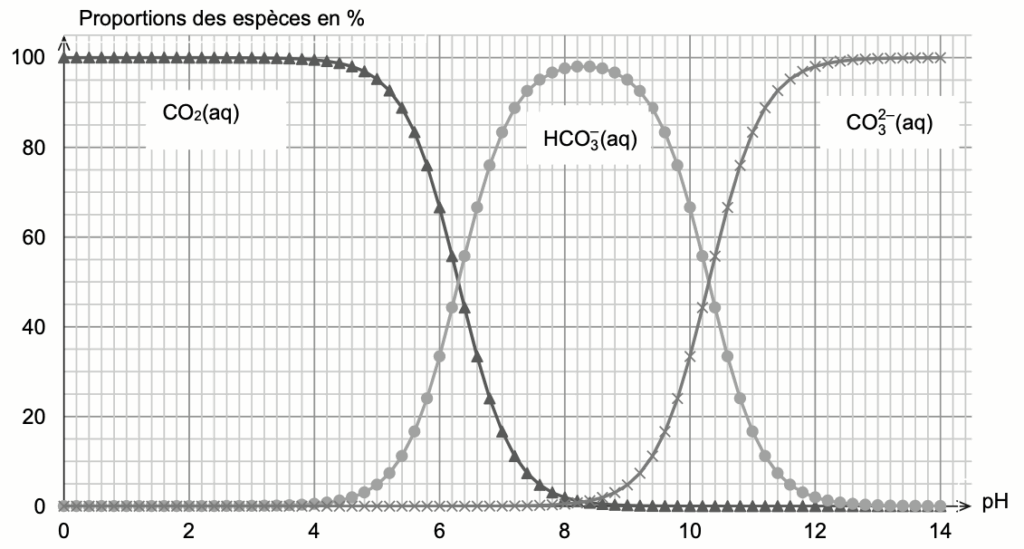
Figure 1. Diagramme de distribution des espèces CO2(aq), HCO3 –(aq) et CO32–(aq) en solution aqueuse à 25 °C
Q1. Écrire l’équation de la réaction acide-base modélisant la transformation chimique entre le dioxyde de carbone dissous et l’eau. Justifier le fait que le dioxyde de carbone puisse rendre acides les pluies.
- Le dioxyde de carbone dissous se combine avec l’eau
$CO_2(aq)+H_2O\left(l\right)\rightarrow H_2CO_3(aq)$
On pourrait également écrire : $CO_2(aq)+H_2O\left(l\right)\rightarrow CO_2,H_2O\left(aq\right)$
Équation de la réaction acide-base modélisant la transformation chimique entre le dioxyde de carbone dissous :
$$H_2CO_3(aq)+H_2O\left(l\right)\rightleftarrows{\rm HCO}_3^-+H_3O^+\left(aq\right)$$
On pourrait également écrire :
$$CO_2,H_2O\left(aq\right)+H_2O\left(l\right)\rightleftarrows{\rm HCO}_3^-+H_3O^+\left(aq\right)$$
Des ions oxonium $H_3O^+$ sont libérés lors de cette réaction.
Or lorsque la concentration des ions oxonium $H_3O^+$ augmente, le pH diminue.
Ainsi, en réagissant avec l’eau de la pluie, le dioxyde de carbone peut rendre acides les pluies.
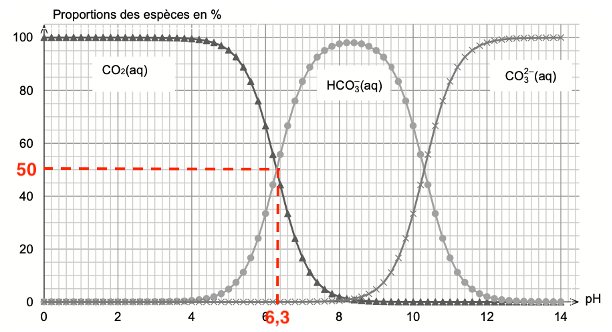
Q2. En utilisant la figure 1, vérifier que la valeur du pKA du couple CO2(aq) /HCO3 –(aq) est voisine de 6,4 à 25 °C.
Remarque : le sujet nous donne le couple acide base ${\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$. Or pour passer de la forme acide à la forme basique on enlève un ion $H^+$ ce qui n’est pas le cas ici.
Le bon couple est $H_2O,{\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$.
Lorsque $\left[{\rm HCO}3^-\right]{eq}=\left[H_2O,{\rm CO}2\right]{eq}$
$pH={\rm pK}_A$
Graphiquement $\left[{\rm HCO}3^-\right]{eq}=\left[H_2O,{\rm CO}2\right]{eq}$ pour $pH=6,3$
On en déduit que ${\rm pK}_A=6,3$.
Ainsi, la valeur du pKA du couple CO2(aq) / HCO3–(aq) est voisine de 6,4 à 25 °C.
On suppose que seule la réaction entre le dioxyde de carbone dissous CO2(aq) et l’eau a lieu et que la concentration en CO2(aq) à l’équilibre, imposée par le dioxyde de carbone présent dans l’atmosphère, est toujours égale à 1,3×10–5 mol·L–1.
Q3. Donner la relation entre les concentrations des espèces HCO3 – et H3O+ à l’équilibre, notées [HCO –] et [H3O+], puis montrer que la constante d’acidité KA a pour expression :
$$ K_A=\frac{[H_3O^+]^2}{[CO_2]\cdot c^\circ} $$
$$CO_2,H_2O\left(aq\right)+H_2O\left(l\right)\rightleftarrows{\rm HCO}3^-+H_3O^+\left(aq\right)$$
$$K_A=\frac{[HCO_3^-]{eq}\times [H_3O^+]{eq}}{[CO_2]{eq}\times c^0}$$
Or pour chaque ion $H_3O^+$ formé un ion $HCO_3^-$ est formé également :
$[HCO_3^-]{eq}=[H_3O^+]{eq}$
D’où
$$K_A=\frac{[H_3O^+]{eq}\times [H_3O^+]{eq}}{[CO_2]{eq}\times c^0}$$
$$K_A=\frac{[H_3O^+]{eq}^2}{[CO_2]_{eq}\times c^0}$$
Q4. Retrouver que la valeur du pH de l’eau de pluie non polluée à 25 °C est de 5,6.
$$pH=-\log\left(\frac{\left[H_3O^+\right]}{c^0}\right)$$
Or
$$[H_3O^+]{eq}^2=K_A\times [CO_2]{eq}\times c^0$$
$$[H_3O^+]{eq}=\sqrt{K_A\times [CO_2]{eq}\times c^0}$$
D’où
$$pH=-\log\left(\frac{\sqrt{K_A\times [CO_2]_{eq}\times c^0}}{c^0}\right)$$
Or
$$K_A={10}^{-pK_A}$$
D’où
$$pH=-\log\left(\frac{\sqrt{{10}^{-6,4}\times 1,3\times {10}^{-5}\times 1}}{1}\right)$$
$$pH=5,6$$
Une eau de pluie est dite acide lorsque son pH est inférieur à 5,6 à 25 °C. L’acidification de l’eau de pluie est due, entre autres, au rejet dans l’atmosphère d’oxydes d’azote NO et NO2 qui conduisent à la formation d’acide nitrique HNO3.
Afin d’étudier les propriétés acido-basiques de l’acide nitrique, on prépare un volume de 2,00 L d’une solution aqueuse S d’acide nitrique diluée 400 fois à partir d’une solution commerciale S0 de concentration c0 = 15,2 mol·L–1.
Q5. Indiquer, en précisant les volumes, la verrerie à utiliser pour préparer 2,00 L de solution aqueuse S d’acide nitrique à partir de la solution commerciale S0.
D’après l’énoncé : « on prépare un volume de 2,00 L d’une solution aqueuse S d’acide nitrique diluée 400 fois à partir d’une solution commerciale S0 »
$$F=\frac{V_1}{V_0}$$
$$F\times V_0=V_1$$
$$V_0=\frac{V_1}{F}$$
$$V_0=\frac{2,00}{400}$$
$$V_0=5,0\times {10}^{-3}\ L$$
$$V_0=5,0\ mL$$
On choisit :
- une fiole jaugée $V_1=2,00\ L$
- une pipette jaugée $V_0=5\ mL$
On plonge une sonde pH-métrique dans la solution S : le pH-mètre affiche une valeur de 1,42 à 25 °C.
Q6. Déterminer, en justifiant, si la mesure du pH est cohérente avec le fait que l’acide nitrique est un acide fort dans l’eau.
Calculons la concentration $c$ de l’acide nitrique dans la solution S :
$$F=\frac{C_0}{C}$$
$$F\times C=C_0$$
$$C=\frac{C_0}{F}$$
$$C=\frac{15,2}{400}$$
$$C=3,8\times {10}^{-2}\ mol.L^{-1}$$
Pour un acide fort $pH=-\log(c)$.
$$-\log(c)=-\log\left(3,8\times {10}^{-2}\right)$$
$$-\log(c)=1,42$$
Or $pH=1,42$.
Donc $pH=-\log(c)$.
L’acide nitrique est donc un acide fort.
La mesure du pH est cohérente avec le fait que l’acide nitrique est un acide fort dans l’eau.
2. Conséquences des pluies acides
Dans cette partie on se propose d’expliquer la dégradation, par les pluies acides, des bâtiments et des statues construits avec des roches calcaires composées principalement de carbonate de calcium CaCO3(s).
Afin de simuler l’effet des pluies acides sur les roches calcaires, on fait réagir du carbonate de calcium avec une solution d’acide chlorhydrique. Le protocole décrit ci-dessous est réalisé à une température de 295 K :
- dans une fiole à vide de volume total 330 mL, on verse 50 mL d’une solution d’acide chlorhydrique.
On considère que le volume restant disponible pour du gaz dans la fiole est ainsi de 280 mL ;
- on relie, par un tuyau, la fiole à vide à un manomètre ;
- à la date t = 0, on introduit rapidement dans la fiole à vide 2,0 g de carbonate de calcium solide, on bouche la fiole à vide puis on relève les valeurs de pression indiquées par le manomètre au cours du temps. On considère que l’introduction du carbonate de calcium ne modifie pas le volume disponible pour le gaz.
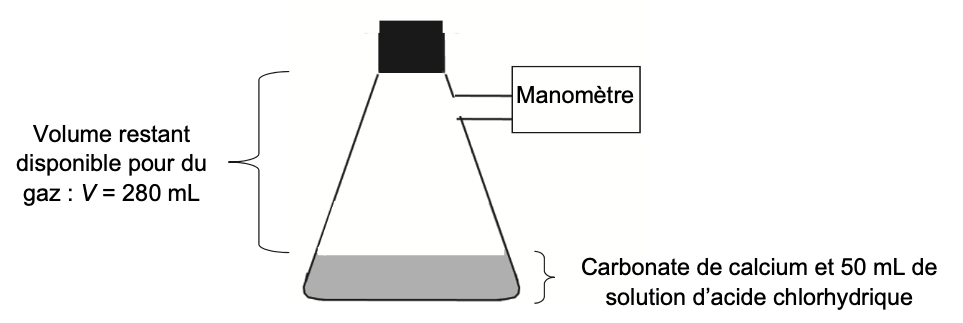
Figure 2. Schéma du montage expérimental
Les résultats ci-dessous sont donnés pour trois conditions expérimentales différentes :
| Concentration de la solution d’acide chlorhydrique utilisée | État de division du carbonate de calcium | Temps de demi – réaction t1/ 2 | |
| Expérience n°1 | 1,0×10–1 mol·L–1 | en poudre | à déterminer |
| Expérience n°2 | 2,0×10–1 mol·L–1 | en poudre | 80 s |
| Expérience n°3 | 2,0×10–1 mol·L–1 | en morceaux | 1,6×103 s |
La transformation chimique ayant lieu lors de chacune des expériences peut être modélisée par la réaction, supposée totale, d’équation :
CaCO3(s) + 2 H3O+(aq) → CO2(g) + Ca2+(aq) + 3 H2O(ℓ)
Les résultats obtenus permettent de tracer la courbe d’évolution de la pression PCO2 de dioxyde de carbone gazeux formé en fonction du temps t pour l’expérience n°1. Les résultats sont présentés sur la figure 3. Cette pression tient compte de l’estimation des pertes liées à la manipulation.
Dans les différentes conditions expérimentales, le dioxyde de carbone gazeux est assimilé à un gaz parfait dont l’expression de la pression s’écrit :
$$ P_{CO_2}=\frac{n_{CO_2} \cdot R \cdot T}{V} $$
où PCO2 s’exprime en Pa, nCO2 s’exprime en mol, T s’exprime en K et V s’exprime en m3.
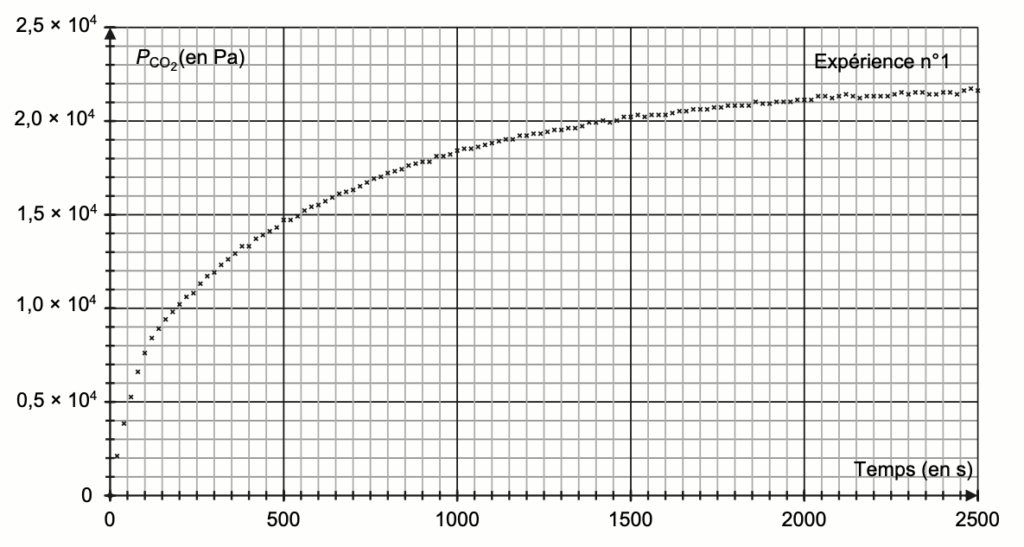
Figure 3. Évolution de la pression PCO2 de dioxyde de carbone gazeux en fonction du temps t pour l’expérience n°1
Q7. Montrer que la quantité de matière théorique maximale de dioxyde de carbone gazeux pouvant être obtenue dans les conditions de l’expérience n°1 est nCO2,max = 2,5×10–3 mol.
| $CaCO_3(s) | $+2H_3O^+\left(aq\right)$ | $\rightarrow CO_2\left(g\right)$ | $+{\rm Ca}^{2+}\left(aq\right)$ | $+3H_2O\left(l\right)$ | |
| État initial | $n_{CaCO_3}^i$ | $n_{H_3O^+}^i$ | 0 | 0 | Solvant |
| État intermédiaire | $n_{CaCO_3}^i-x$ | $n_{H_3O^+}^i-x$ | x | x | Solvant |
| État final | $n_{CaCO_3}^i-x_f$ | $n_{H_3O^+}^i-x_f$ | $x_f$ | $x_f$ | Solvant |
$$n_{CaCO_3}^i=\frac{m_{CaCO_3}}{M_{CaCO_3}}$$
$$n_{CaCO_3}^i=\frac{2,0}{100,1}$$
$$n_{CaCO_3}^i=2,0\times {10}^{-2}\ mol$$
$$n_{H_3O^+}^i=\left[H_3O^+\right]\times V$$
$$n_{H_3O^+}^i=1,0\times {10}^{-1}\times 50\times {10}^{-3}$$
$$n_{H_3O^+}^i=5,0\times {10}^{-3}\ mol$$
$$x_{max\ 1}=n_{CaCO_3}^i=2,0\times {10}^{-2}\ mol$$
$$x_{max\ 2}=\frac{n_{H_3O^+}^i}{2}=2,5\times {10}^{-3}\ mol$$
$$x_{max}=x_{max\ 2}=2,5\times {10}^{-3}\ mol$$
$$n_{CO_2,max}=x_{max}=2,5\times {10}^{-3}\ mol$$
Q8. Estimer la quantité de matière de dioxyde de carbone gazeux réellement présente dans la fiole à vide dans l’état final lors de l’expérience n°1. Commenter le résultat obtenu.
$$P_{CO_2}=\frac{n_{CO_2}\times R\times T}{V}$$
$$n_{CO_2}=\frac{P_{CO_2}\times V}{R\times T}$$
$$n_{CO_2,reel}=2,49\times {10}^{-3}\ mol$$
$$n_{CO_2,reel}=n_{CO_2,max}$$
La réaction est totale.
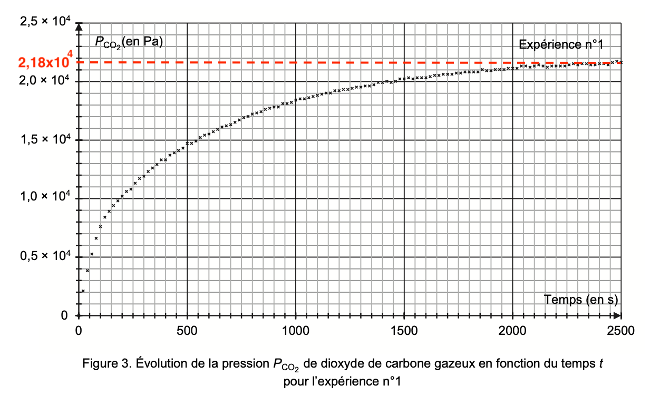
Q9. Estimer, en expliquant la démarche, le temps de demi-réaction de la transformation chimique mise en œuvre dans l’expérience n°1.
$t_{1/2}$ est la durée nécessaire pour que l’avancement atteigne la moitié de sa valeur finale :
$x(t_{1/2})=\frac{x_f}{2}$
$$P_{CO_2}\left(t_{1/2}\right)=\frac{P_{CO_2}\left(f\right)}{2}$$
$$P_{CO_2}\left(t_{1/2}\right)=1,09\times {10}^4\ Pa$$
Graphiquement : $t_{1/2}=250\ s$
Q10. En exploitant les résultats des trois expériences réalisées, indiquer un facteur qui influence la cinétique de la détérioration des bâtiments et des statues.
Comparons les expériences 1 et 2 :
L’état de division du carbonate de calcium est identique.
La concentration de la solution d’acide chlorhydrique utilisée dans l’expérience 2 est supérieure à celle de l’expérience 1.
On observe que le temps de demi réaction dans l’expérience 2 est inférieur à celui de l’expérience 1.
Ainsi, la concentration est un facteur cinétique. (Lorsque la concentration de la solution d’acide chlorhydrique augmente la réaction est plus rapide).
On nous demande qu’un facteur qui influence la cinétique.
Comparons les expériences 2 et 3 :
La concentration de la solution d’acide chlorhydrique utilisée dans l’expérience 2 est identique à celle de l’expérience 1.
L’état de division du carbonate de calcium est différent : en poudre dans l’expérience 2 et en morceaux dans l’expérience 3.
On observe que le temps de demi réaction dans l’expérience 2 est inférieur à celui de l’expérience 3.
Ainsi, l’état de division est un facteur cinétique. (Lorsque le carbonate de calcium est en poudre la réaction est plus rapide).
3. Prévention des pluies acides : contrôle de la qualité de l’air
Afin de réduire les émissions d’oxydes d’azote et de dioxyde de soufre SO2, espèces également responsables de l’acidité des pluies, plusieurs dispositions règlementaires ont été prises dans de nombreux pays. Des normes de qualité de l’air ont été fixées pour le dioxyde de soufre SO2, et un contrôle régulier de sa concentration dans l’air est réalisé.
On donne ci-après les normes de qualité de l’air liées à la concentration en masse de dioxyde de soufre SO2 dans l’air en France.
| Objectif de qualité | 50 µg·m–3 | en moyenne annuelle |
| Valeur limite | 125 µg·m–3 | en moyenne journalière à ne pas dépasser plus de 3 jours par an |
| Seuil d’information et de recommandation | 300 µg·m–3 | en moyenne horaire |
D’après https://www.ecologique-solidaire.gouv.fr/pollution-lair-origines-situation-et-impacts
Afin de déterminer la concentration du dioxyde de soufre SO2 dans l’air, on réalise l’expérience suivante :
- étape 1 : avec une pompe, on fait barboter de l’air, en continu pendant 7 jours, dans une solution aqueuse de peroxyde d’hydrogène H2O2(aq). Le volume total d’air ainsi utilisé est de 18,5 m3. On obtient une solution aqueuse notée Sa ; on suppose que toute la quantité de dioxyde de soufre apporté par l’air au cours de son barbotage se dissout dans la solution de peroxyde d’hydrogène et que c’est la seule espèce acide ;
- étape 2 : on titre les ions oxonium H3O+ de la solution Sa par une solution aqueuse Sb d’hydroxyde de sodium de concentration égale à cb = 1,0×10–2 mol·L–1. Le volume de solution Sb versé à l’équivalence du titrage est VE = 4,0 mL.
Q11. La transformation chimique ayant lieu lors de l’étape 1 est totale et peut être modélisée par la réaction d’équation :
H2O2(aq) + SO2(aq) + 2 H2O(ℓ) → 2 H3O+(aq) + SO42–(aq)
Sachant que le peroxyde d’hydrogène a été introduit en excès, déterminer la relation entre la quantité de matière n(SO2) de dioxyde de soufre présent dans l’air analysé et la quantité de matière n(H3O+) d’ions oxonium contenus dans la solution Sa.
H2O2(aq) + SO2(aq) + 2 H2O(ℓ) → 2 H3O+(aq) + SO42–(aq)
Le peroxyde d’hydrogène a ete introduit en excès, l’eau est le solvant et la reaction est totale.
$$\frac{n_{SO_2}^{initial}}{1}=\frac{n_{H_3O^+}^{forme}}{2}$$
$$n_{SO_2}^{initial}=\frac{n_{H_3O^+}^{forme}}{2}$$
Q12. En considérant que la concentration en masse du dioxyde du soufre dans l’air n’a pas varié pendant toute la durée de l’étape 1, déterminer si les 18,5 m3 d’air analysé respectent les normes de qualité concernant le dioxyde de soufre. Commenter le protocole et les hypothèses du raisonnement.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Déterminons la quantité en ions oxonium H3O+ de la solution Sa :
On titre les ions oxonium H3O+ de la solution Sa par une solution aqueuse Sb d’hydroxyde de sodium
$$H_3O^+\left(aq\right)+HO^-\left(aq\right)\rightarrow H_2O\left(l\right)+H_2O\left(l\right)$$
A l’equivalence :
$$\frac{n_{H_3O^+}^i}{1}=\frac{n_{{\rm HO}^-}^{eq}}{1}$$
$$n_{H_3O^+}^i=C_B\times V_{eq}$$
$$n_{H_3O^+}^i=1,0\times {10}^{-2}\times 4,0\times {10}^{-3}$$
$$n_{H_3O^+}^i=4,0\times {10}^{-5}\ mol$$
Déterminons la quantité de matière de dioxyde de soufre présent dans l’air analysé :
D’après la question Q11 :
$$n_{SO_2}^{initial}=\frac{n_{H_3O^+}^{forme}}{2}$$
$$n_{SO_2}^{initial}=\frac{4,0\times {10}^{-5}}{2}$$
$$n_{SO_2}^{initial}=2,0\times {10}^{-5}\ mol$$
Calculons la concentration en masse de dioxyde de soufre SO2 dans l’air
$$C_m=\frac{m_{SO_2}}{V_{air}}$$
Or
$$n_{SO_2}=\frac{m_{SO_2}}{M_{SO_2}}$$
$$\frac{m_{SO_2}}{M_{SO_2}}=n_{SO_2}$$
$$m_{SO_2}=n_{SO_2}\times M_{SO_2}$$
D’où
$$C_m=\frac{n_{SO_2}\times M_{SO_2}}{V_{air}}$$
$$C_m=\frac{2,0\times {10}^{-5}\times 64,1}{18,5}$$
$$C_m=6,9\times {10}^{-5}\ g\cdot m^{-3}$$
$$C_m=69\ \mu g\cdot m^{-3}$$
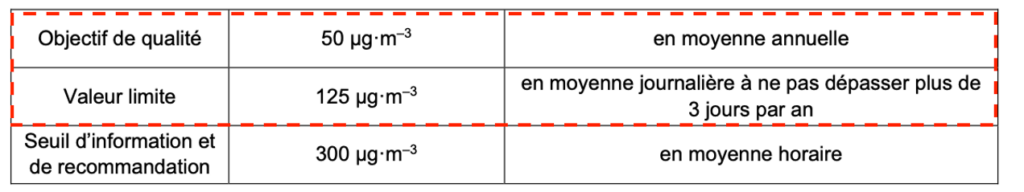
La concentration en masse de dioxyde de soufre SO2 dans l’air est supérieure à l’objectif de qualité et inférieure à la valeur limite.
Le protocole suppose que tout le SO₂ présent dans l’air barboté est totalement dissous et réagit avec l’eau oxygénée.
En réalité, une partie du SO₂ peut rester dans l’air. L’expérience donne donc une valeur qui peut sous-estimer la concentration réelle en SO₂.
De plus, la mesure repose sur un titrage unique, il faudrait répéter le protocole pour une mesure plus précise.
