ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH101 et n°SPEPHCH111
Télécharger l’exercice en PDF :
L’objectif de cet exercice est d’étudier la fabrication du vinaigre.
Le vinaigre est le produit de la fermentation acétique du vin ou de produits très variés (cidre, certains fruits, miel). L’alcool présent dans le vin sous forme d’éthanol C2H6O s’oxyde, sous l’action de l’oxygène de l’air et se transforme en acide acétique C2H4O2. Cette transformation chimique est possible grâce à la présence de bactéries présentent naturellement dans l’air appelée Acetobacter aceti. L’Acetobacter aceti joue le rôle d’enzyme lors de cette transformation chimique.
Ainsi, du vin de table, exposé à l’air, se recouvre d’un voile et acquiert une saveur aigre et une odeur piquante. Ce voile, formé de bactéries, se multiplient très rapidement en formant une pellicule épaisse et blanchâtre appelée la « mère » du vinaigre. Ces bactéries sont qualifiées d’aérobie, c’est à dire qu’elles ne peuvent vivre qu’en présence d’oxygène. Si la mère de vinaigre est immergée, les bactéries, isolées de l’air, ne peuvent subsister longtemps.
D’après Bulletin de l’Union des Physiciens n°773
Les enzymes sont des molécules biologiques agissant comme des catalyseurs. Lorsqu’une réaction est catalysée par une enzyme, on parle de catalyse enzymatique.
D’après https://www.cnrs.fr/
Données :
- Le degré d’acidité d’un vinaigre est égal à la masse d’acide acétique contenue dans 100 g de vinaigre. S’exprime en degré (°) ou en pourcentage (%).
- Le titre en alcool ou teneur en alcool (% en volume) correspond au volume d’éthanol (en mL) contenu dans 100 mL de liquide alcoolique.
- Masse volumique de l’éthanol à 25 °C : 𝜌 = 0,79 g∙mL−1
- Masse molaire moléculaire de l’éthanol : M(éthanol) = 46 g·mol-1
- Masse molaire moléculaire de l’acide acétique : M(acide acétique) = 60 g·mol-1
La fermentation acétique
On veut créer du vinaigre à partir d’un vin.
1. Écrire les deux demi-équations électroniques associées aux couples oxydant/réducteur suivants: C2H4O2(aq)/C2H6O(aq) et O2(g)/H2O(l).
Demi-équation électronique associée au couple : C2H4O2 (aq) / C2H6O(aq).
\[ \mathrm{ \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} + 4\text{H}^+ \, \text{(aq)} + 4e^- \longrightarrow \text{C}_2\text{H}_6\text{O} \, \text{(aq)} + \text{H}_2\text{O} \, \text{(l)} }\]
Demi-équation électronique associée au couple : O2(g) / H2O(l).
\[ \mathrm{ \text{O}_2 \, \text{(g)} + 4\text{H}^+ \, \text{(aq)} + 4e^- \longrightarrow 2\text{H}_2\text{O} \, \text{(l)} }\]
2. Nommer les réactifs de la réaction modélisant l’oxydation du vin dans l’air.
L’alcool présent dans le vin sous forme d’éthanol C2H6O s’oxyde, sous l’action de l’oxygène de l’air O2(g).
Les réactifs de la réaction modélisant l’oxydation du vin dans l’air sont l’éthanol C2H6O et l’oxygène de l’air O2(g).
3. Montrer que l’équation de la réaction modélisant l’oxydation du vin dans l’air est :
C2H6O(aq) + O2(g) → C2H4O2(aq) + H2O(l)
Les réactifs de la réaction modélisant l’oxydation du vin dans l’air sont l’éthanol C2H6O et l’oxygène de l’air O2(g).
\[ \mathrm{ \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} / \text{C}_2\text{H}_6\text{O} \, \text{(aq)} \quad : \quad \text{C}_2\text{H}_6\text{O} \, \text{(aq)} + \text{H}_2\text{O} \, \text{(l)} = \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} + 4\text{H}^+ \, \text{(aq)} + 4e^-}\]
\[ \mathrm{ \text{O}_2 \, \text{(g)} / \text{H}_2\text{O} \, \text{(l)} \quad : \quad \text{O}_2 \, \text{(g)} + 4\text{H}^+ \, \text{(aq)} + 4e^- = 2\text{H}_2\text{O} \, \text{(l)}}\]
\[ \mathrm{ \text{C}_2\text{H}_6\text{O} \, \text{(aq)} + \text{H}_2\text{O} \, \text{(l)} + \text{O}_2 \, \text{(g)} + 4\text{H}^+ \, \text{(aq)} = \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} + 4\text{H}^+ \, \text{(aq)} + 2\text{H}_2\text{O} \, \text{(l)}}\]
On simplifie de part et d’autre les ions \(\text{H}^+\) et les molécules d’eau \(\text{H}_2\text{O}\) :
\[ \mathrm{ \text{C}_2\text{H}_6\text{O} \, \text{(aq)} + \text{O}_2 \, \text{(g)} = \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} + \text{H}_2\text{O} \, \text{(l)}}\]
L’équation de la réaction modélisant l’oxydation du vin dans l’air s’écrit :
\[ \mathrm{ \text{C}_2\text{H}_6\text{O} \, \text{(aq)} + \text{O}_2 \, \text{(g)} = \text{C}_2\text{H}_4\text{O}_2 \, \text{(aq)} + \text{H}_2\text{O} \, \text{(l)}}\]
4. Expliquer pourquoi l’Acétobacter aceti n’apparaît pas dans l’équation de cette réaction.
D’après l’énoncé : « L’Acetobacter aceti joue le rôle d’enzyme lors de cette transformation chimique. »
L’Acétobacter aceti n’est ni un réactif ni un produit. C’est pourquoi l’Acétobacter aceti n’apparaît pas dans l’équation de cette réaction.
5. Expliquer pourquoi il est préférable que les bactéries soient en surface du liquide et non au fond du récipient contenant le vin qui s’oxyde.
D’après l’énoncé : « Ces bactéries (l’Acetobacter aceti) sont qualifiées d’aérobie, c’est à dire qu’elles ne peuvent vivre qu’en présence d’oxygène. Si la mère de vinaigre est immergée, les bactéries, isolées de l’air, ne peuvent subsister longtemps. »
En surface du liquide, il y a de l’oxygène qui permet à ces bactéries de vivre contrairement au fond du récipient ou il n’y a pas d’oxygène.
C’est pourquoi il est préférable que les bactéries soient en surface du liquide et non au fond du récipient contenant le vin qui s’oxyde.
La fabrication artisanale de vinaigre
Un élève décide de fabriquer du « vinaigre de vin » en utilisant du vin bio ayant une teneur en alcool de 12,5 % en volume d’alcool. Il en verse 500 mL dans un bocal en verre qu’il ferme d’un fin tissu, pour laisser passer l’air et retenir les impuretés.
6. Vérifier que la quantité de matière d’éthanol présent dans le bocal initialement a une valeur de nalcool = 1,07 mol.
\[ \mathrm{ n_{\text{alcool}} = \frac{m_{\text{éthanol}}}{M_{\text{éthanol}}}}\]
Or,
\[ \mathrm{ \rho_{\text{éthanol}} = \frac{m_{\text{éthanol}}}{V_{\text{éthanol}}}}\]
\[ \mathrm{ \frac{m_{\text{éthanol}}}{V_{\text{éthanol}}} = \rho_{\text{éthanol}}}\]
\[ \mathrm{ m_{\text{éthanol}} = \rho_{\text{éthanol}} \times V_{\text{éthanol}}}\]
D’où,
\[ \mathrm{ n_{\text{alcool}} = \frac{\rho_{\text{éthanol}} \times V_{\text{éthanol}}}{M_{\text{éthanol}}}}\]
Or,
\[ \mathrm{ P_{\text{éthanol}} = \frac{V_{\text{éthanol}}}{V_{\text{total}}}}\]
\[ \mathrm{ \frac{V_{\text{éthanol}}}{V_{\text{total}}} = P_{\text{éthanol}}}\]
\[ \mathrm{ V_{\text{éthanol}} = P_{\text{éthanol}} \times V_{\text{total}}}\]
D’où,
\[ \mathrm{ n_{\text{alcool}} = \frac{\rho_{\text{éthanol}} \times P_{\text{éthanol}} \times V_{\text{total}}}{M_{\text{éthanol}}}}\]
\[ \mathrm{ n_{\text{alcool}} = \frac{0{,}79 \times 12{,}5 / 100 \times 500}{46}}\]
\[ \mathrm{ n_{\text{alcool}} = 1{,}07 \, \text{mol}}\]
L’équation de la réaction modélisant l’oxydation de l’éthanol dans l’air est la suivante :
C2H6O(aq) + O2(g) → C2H4O2(aq) + H2O(l)
7. Déterminer l’avancement maximal, xmax, de cette réaction pour une transformation considérée comme totale (l’eau et le dioxygène sont considérés en excès).
| Équation | C2H6O(aq) + O2(g) → C2H4O2(aq) + H2O(l) | ||||
| État | Avancement | ||||
| État initial | 0 | 1,07 | Excès | 0 | Excès |
| État intermédiaire | x | 1,07-x | Excès | x | Excès |
| État final | xf | 1,07-xf | Excès | xf=nacide | Excès |
\[ \mathrm{ 1{,}07 – x_{\text{max}} = 0 }\]
\[ \mathrm{ -x_{\text{max}} = -1{,}07 }\]
\[ \mathrm{ x_{\text{max}} = 1{,}07 \, \text{mol} }\]
L’avancement maximal, xmax, à pour valeur 1,07 mol.
L’élève décide d’étudier l’évolution du degré d’acidité du vinaigre formé. Pour cela, il prélève délicatement tous les 5 jours une petite quantité de la solution du bocal qu’il dose par une solution de soude afin de calculer le degré d’acidité. On fera l’approximation que le volume de la solution restera constant tout au long de l’expérience.
Les résultats obtenus sont indiqués dans le graphique suivant :
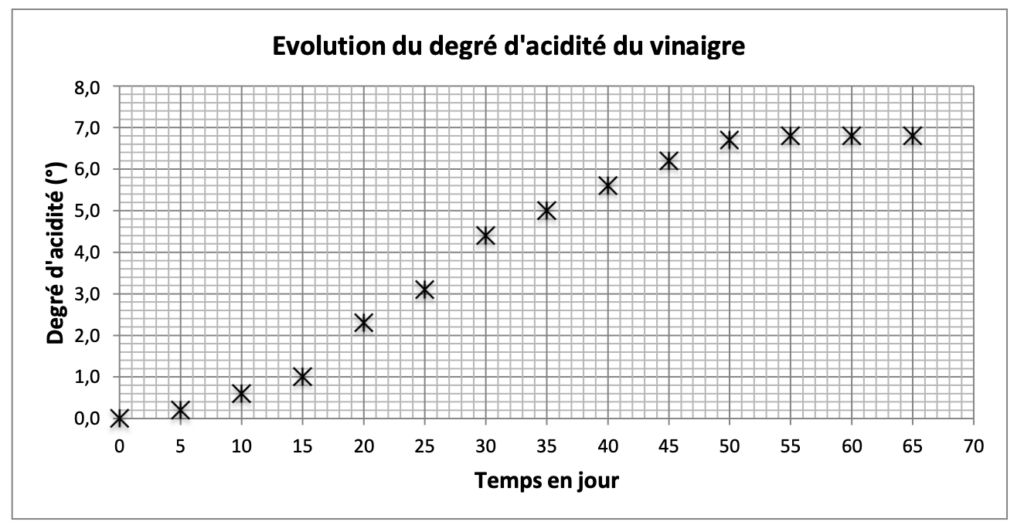
On se propose d’étudier la solution obtenue le 25ème jour de repos.
8. Déterminer la valeur du degré d’acidité du vinaigre au bout de 25 jours de repos.
D’après les données : « Le degré d’acidité d’un vinaigre est égal à la masse d’acide acétique contenue dans 100 g de vinaigre. S’exprime en degré (°) ou en pourcentage (%). »
Graphiquement, le degré d’acidité du vinaigre au bout de 25 jours de repos à pour valeur 3,1°.
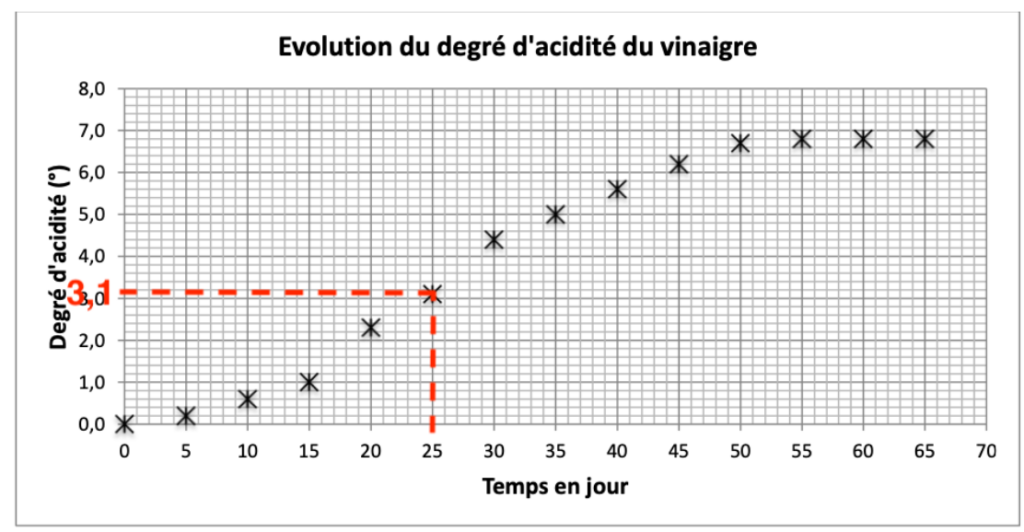
9. Montrer que la quantité de matière nacide en acide acétique présente dans le bocal au bout de 25 jours a pour valeur nacide = 0,25 mol, sachant que la masse volumique du mélange obtenue est de 1,0 g·mL-1.
\[ \mathrm{n_{\text{acide}} = \frac{m_{\text{acide}}}{M_{\text{acide}}}}\]
Or,
\[ \mathrm{P_{\text{acide}} = \frac{m_{\text{acide}}}{m_{\text{total}}}}\]
\[ \mathrm{\frac{m_{\text{acide}}}{m_{\text{total}}} = P_{\text{acide}}}\]
\[ \mathrm{m_{\text{acide}} = P_{\text{acide}} \times m_{\text{total}}}\]
D’où,
\[ \mathrm{n_{\text{acide}} = \frac{P_{\text{acide}} \times m_{\text{total}}}{M_{\text{acide}}}}\]
Or,
\[ \mathrm{\rho_{\text{solution}} = \frac{m_{\text{solution}}}{V_{\text{solution}}}}\]
\[ \mathrm{\frac{m_{\text{solution}}}{V_{\text{solution}}} = \rho_{\text{solution}}}\]
\[ \mathrm{m_{\text{solution}} = \rho_{\text{solution}} \times V_{\text{solution}}}\]
D’où,
\[ \mathrm{n_{\text{acide}} = \frac{P_{\text{acide}} \times \rho_{\text{solution}} \times V_{\text{solution}}}{M_{\text{acide}}}}\]
\[ \mathrm{n_{\text{acide}} = \frac{3{,}1 / 100 \times 1{,}0 \times 500}{60}}\]
\[ \mathrm{n_{\text{acide}} = 0{,}26 \, \text{mol}}\]
Remarque : avec un degré d’acidité de 3°, on obtient 0,25 mol.
10. Déterminer l’avancement final xf de cette réaction. Comparer à l’avancement maximal. Conclure.
D’après le tableau d’avancement (question 7) :
\[ \mathrm{x_f = n_{\text{acide}}}\]
\[ \mathrm{x_f = 0{,}25 \, \text{mol} \quad (\text{J’utilise le résultat donné dans la question précédente})}\]
Or,
\[ \mathrm{x_{\text{max}} = 1{,}07 \, \text{mol}}\]
\[ \mathrm{x_f < x_{\text{max}} : \text{la réaction n’est pas terminée à 25 jours.}}\]
La réglementation française limite la teneur en alcool résiduel (restant) dans le vinaigre à 1,5 % en volume.
11. Montrer que la quantité de matière nf d’alcool restant dans la solution de vinaigre à l’état final a pour valeur nf = 0,5 mol.
Graphiquement, le degré d’acidité du vinaigre à la fin de la réaction de repos à pour valeur 6,8°.
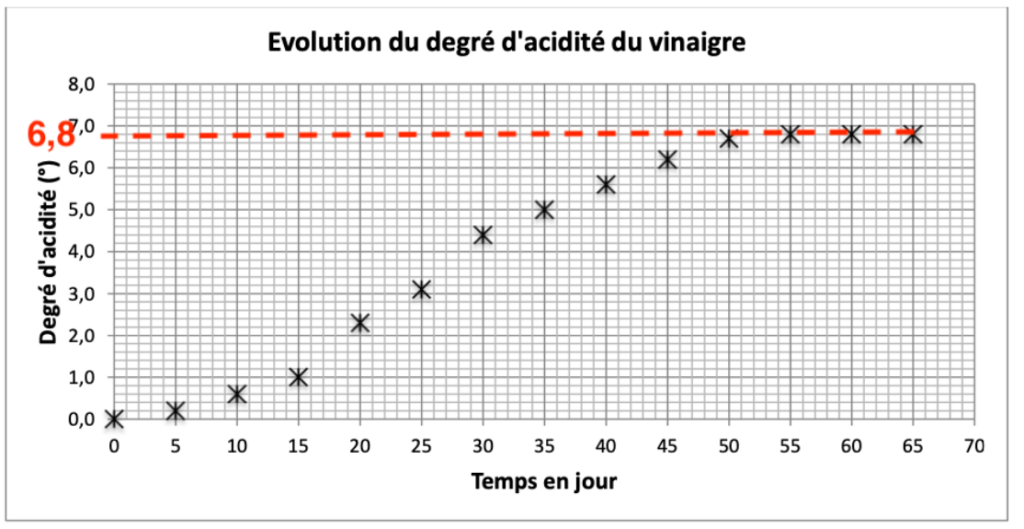
Calculons la quantité d’acide présent à la fin de la réaction (avec la formule de la question 9) :
\[ \mathrm{ n_{\text{acide}} = \frac{P_{\text{acide}} \times \rho_{\text{solution}} \times V_{\text{solution}}}{M_{\text{acide}}}}\]
\[ \mathrm{ n_{\text{acide}} = \frac{6{,}8 / 100 \times 1{,}0 \times 500}{60}}\]
\[ \mathrm{ n_{\text{acide}} = 0{,}57 \, \text{mol}}\]
Or, d’après le tableau d’avancement (question 7) :
\[ \mathrm{ x_f = n_{\text{acide}}}\]
\[ \mathrm{ x_f = 0{,}57 \, \text{mol} \quad (\text{J’utilise le résultat donné dans la question précédente})}\]
Calculons la quantité d’alcool restant à la fin de la réaction (avec le tableau d’avancement question 7) :
\[ \mathrm{ 1{,}07 – x_f = n_{\text{alcool}}^{\text{restant}}}\]
\[ \mathrm{ n_{\text{alcool}}^{\text{restant}} = 1{,}07 – 0{,}57}\]
\[ \mathrm{ n_{\text{alcool}}^{\text{restant}} = 0{,}5 \, \text{mol}}\]
12. Conclure sur le respect ou non de la réglementation.
La réglementation française limite la teneur en alcool résiduel (restant) dans le vinaigre à 1,5 % en volume.
Calculons la quantité d’alcool maximale correspondante (à l’aide de la formule question 6) :
\[ \mathrm{ n_{\text{alcool}}^{\text{maximale}} = \frac{\rho_{\text{éthanol}} \times P_{\text{éthanol}} \times V_{\text{total}}}{M_{\text{éthanol}}}}\]
\[ \mathrm{ n_{\text{alcool}}^{\text{maximale}} = \frac{0{,}79 \times \frac{1{,}5}{100} \times 500}{46}}\]
\[ \mathrm{ n_{\text{alcool}}^{\text{maximale}} = 0{,}13 \, \text{mol}}\]
\[ \mathrm{ n_{\text{alcool}}^{\text{restant}} > n_{\text{alcool}}^{\text{maximale}}}\]
: la teneur en alcool résiduel (restant) dans le vinaigre est supérieure à la valeur maximale imposée par la règlementation.
Ce vinaigre ne respecte pas la règlementation.
