Bac Asie 2021 Sujet 2
Exercice 1– (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 21-PYCJ2JA1
Sujet et corrigé
L’urée est un solide blanc, soluble dans l’eau, qui se forme dans le foie par dégradation des acides aminés. L’urée est filtrée par les reins et éliminée de l’organisme par l’urine.
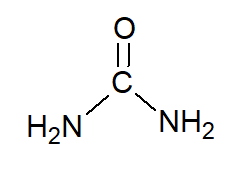
urée
L’urée peut servir à la synthèse de l’acide barbiturique nécessaire à l’élaboration des médicaments barbituriques. La partie 1 est consacrée à l’étude de cette synthèse.
Par ailleurs, la connaissance du taux d’urée présente dans l’urine est une donnée importante pour suivre l’évolution de certaines pathologies. Dans la partie 2 les caractéristiques cinétiques d’une étape-clé du dosage de l’urée sont étudiées.
Les deux parties sont indépendantes.
Partie 1 – Synthèse de l’acide barbiturique à partir de l’urée
L’acide barbiturique et plus généralement les barbituriques constituent un groupe de médicaments qui agissent sur le système nerveux.
De nos jours, l’acide barbiturique est synthétisé à partir d’urée et de malonate de diéthyle.
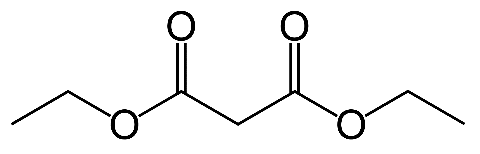
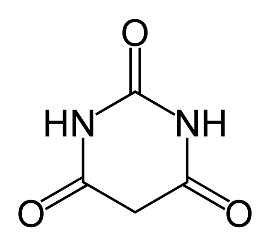
La synthèse de l’acide barbiturique est modélisée par la réaction (1) d’équation :
CH4N2O + C7H12O4 → C4H4N2O3 + 2 C2H6O (réaction 1)
urée malonate de diéthyle acide barbiturique éthanol
Données à 25°C
| Urée | Malonate de diéthyle | Acide barbiturique | Ethanol | |
| Aspect | Solide blanc | Liquide incolore | Solide blanc | Liquide incolore |
| Solubilité | Très soluble à chaud et à froid dans l’eau distillée | Très soluble à chaud et à froid dans l’eau distillée | Très soluble à chaud dans l’eau distillée et beaucoup moins à froid. Légèrement soluble dans l’éthanol. | Très soluble à chaud et à froid dans l’eau distillée |
| Masse molaire (en g ⋅ mol−1) | 60,0 | 160,0 | 128,0 | 46,1 |
| Masse volumique (en g ⋅ mL−1) | – | 1,05 | – | 0,789 |
On note l’acide barbiturique HA et sa base conjuguée A−. En tant qu’espèce ionique, cette base conjuguée est soluble dans l’eau.
Le 𝑝KA du couple acide/base de l’acide barbiturique a pour valeur 4,08.
1. Écrire la formule semi-développée du malonate de diéthyle.
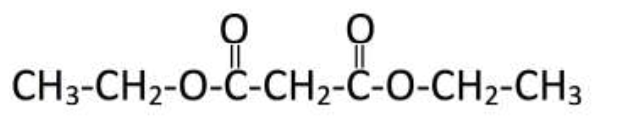
2. Sur la formule précédente, entourer le(s) groupe(s) caractéristique(s) du malonate de diéthyle et citer la (ou les) famille(s) fonctionnelle(s) correspondante(s).
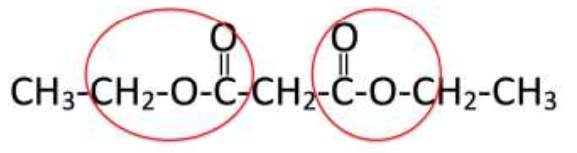
Famille ester
Synthèse de l’acide balbiturique
L’acide barbiturique peut être synthétisé à partir de l’urée, en milieu fortement basique, selon le protocole suivant :
(a) Dans un ballon très sec, dissoudre à chaud 1,5 g d’urée (0,025 mol) et 0,5 g de sodium dans 10 mL d’éthanol, puis ajouter 6,5 mL de malonate de diéthyle.
(b) Réaliser un chauffage à reflux du mélange.
(c) Après chauffage et refroidissement, ajouter 10 mL d’acide chlorhydrique (H3O+(aq), Cl−(aq)) concentré. Laisser refroidir en plongeant le ballon dans un cristallisoir contenant de l’eau à 5°C : des cristaux blancs (légèrement jaunâtres) d’acide barbiturique apparaissent lentement.
Réaliser une filtration sous vide puis rincer les cristaux avec de l’eau glacée.
(d) Réaliser une purification par recristallisation ; pour cela, récupérer les cristaux dans un erlenmeyer, les dissoudre dans un minimum d’eau distillée bouillante et laisser refroidir lentement d’abord à l’air puis dans un bain eau-glace. Filtrer à nouveau, rincer à l’eau glacée, sécher les cristaux et les mettre à l’étuve sur un verre de montre taré.
(e) Peser les cristaux secs.
Après la mise en œuvre de ce protocole, la masse de produit recristallisé sec obtenu vaut mb = 2,6 g.
3. Indiquer les deux intérêts du chauffage à reflux dans cette synthèse.
Les deux intérêts du chauffage à reflux sont d’accélérer la réaction sans perte de matière.
4. Justifier l’apparition de cristaux d’acide barbiturique lors de l’étape (c).
Étape (c) Après chauffage et refroidissement, ajouter 10 mL d’acide chlorhydrique (H3O+(aq), Cl−(aq)) concentré. Laisser refroidir en plongeant le ballon dans un cristallisoir contenant de l’eau à 5°C : des cristaux blancs (légèrement jaunâtres) d’acide barbiturique apparaissent lentement.
D’après les données : L’acide barbiturique est très soluble à chaud dans l’eau distillée et beaucoup moins à froid.
En refroidissant, l’acide barbiturique est moins soluble : il cristallise
5. Montrer que l’urée est le réactif limitant de la synthèse.
Quantités de matière des réactifs :
$$n_1=0,025\ mol$$
$$n_1=2,5{ \times 10}^{-2}\ mol$$
$$n_2=\frac{m_2}{M_2}$$
Or $$\rho_2=\frac{m_2}{V_2} donc m_2=\rho_2 \times V_2$$
$$n_2=\frac{\rho_2 \times V_2}{M_2}$$
$$n_2=\frac{1,05 \times 6,5}{160}=4,3{ \times 10}^{-2}\ mol$$
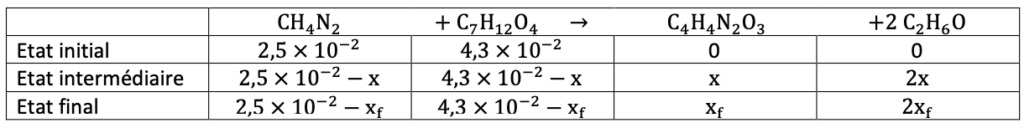
Calculons l’avancement maximal :
$$2,5{ \times 10}^{-2}-x_{max1}=0$$
$$x_{max1}=2,5{ \times 10}^{-2}mol$$
$$4,3{ \times 10}^{-2}-x_{max2}=0$$
$$x_{max2}=4,3{ \times 10}^{-2}\ mol$$
$$x_{max1}<x_{max2}$$
Donc $x_{max}=x_{max1}$ , l’urée est le réactif limitant
6. Déterminer la masse théorique mbth d’acide barbiturique que l’on pourrait obtenir si la synthèse était totale.
Calculons la masse théorique d’acide barbiturique que l’on pourrait obtenir si la synthèse était totale :
$$m_{bth}=n_{bth} \times M_{C_4H_4{N_2O}_3}$$
$$m_{bth}=x_{max1} \times M_{C_4H_4{N_2O}_3}$$
$$m_{bth}=2,5{ \times 10}^{-2} \times 128,0$$
$$m_{bth}=3,2\ g$$
7. Exprimer puis calculer le rendement η de cette synthèse.
$$\eta=\frac{m_{exp}}{m_{bth}}$$
$$\eta=\frac{2,6}{3,2}$$
$$\eta=0,81=81%$$
Proposer des explications pour rendre compte du fait que le rendement est inférieur à 100 % :
- La réaction n’est pas totale
- L’acide barbiturique n’a pas été totalement extrait
Proposer une stratégie pour l’augmenter :
- Séparer les produits au fur et à mesure de la réaction
Proposer des explications pour rendre compte du fait que le rendement est inférieur à 100 %. Proposer une stratégie pour l’augmenter.
Contrôle de la pureté en acide barbiturique du produit recristallisé
Afin de déterminer le degré de pureté du produit obtenu, on prépare une solution de volume V = 100,0 mL de solution d’acide barbiturique par dissolution de 1,00 g de produit recristallisé obtenu à l’aide de la synthèse précédente.
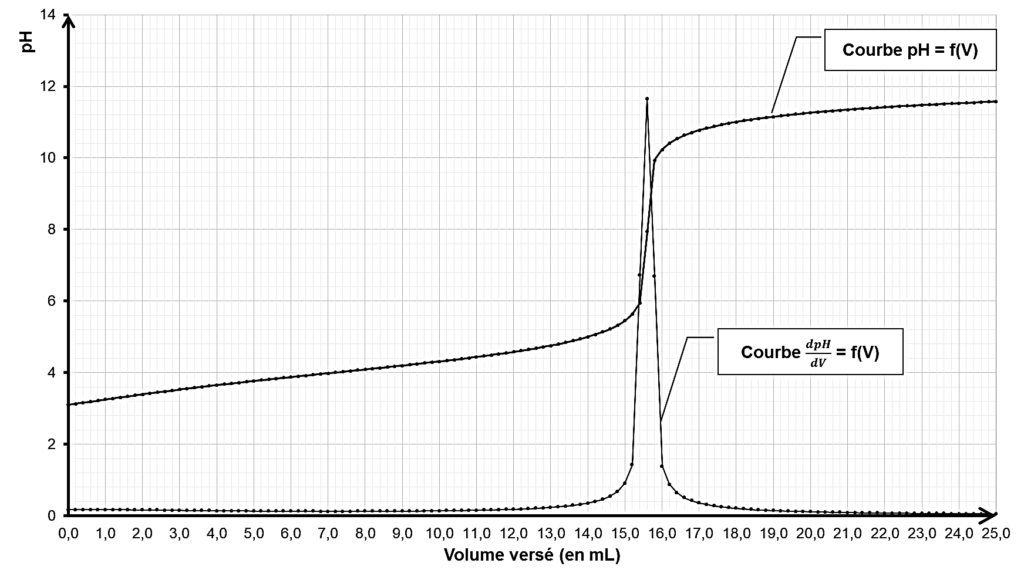
On procède ensuite au titrage de 100,0 mL de solution d’acide barbiturique préparée par une solution d’hydroxyde de sodium (Na+(aq), HO−(aq)) de concentration CB = 5,00 × 10−1 mol⋅L−1. On suit le titrage par pH-mètrie. On obtient la représentation graphique reproduite sur la figure 1 (page 4/16).
8. En utilisant la notation HA(aq) pour l’acide barbiturique en solution aqueuse et les résultats expérimentaux, écrire l’équation de la réaction support du titrage.
$${\rm AH}_{(aq)}+{\rm HO}_{(aq)}^-\rightarrowA_{(aq)}^-+{H_2O}_{(l)}$$
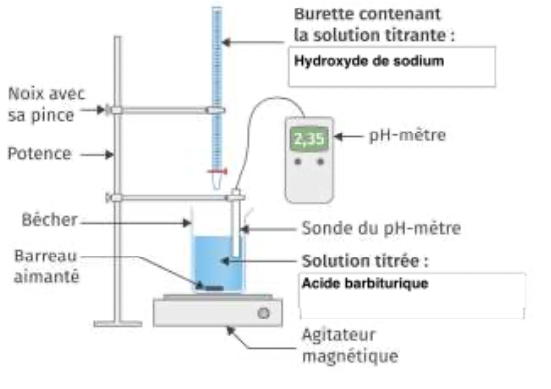
9. Schématiser et légender le montage permettant de réaliser le titrage de l’acide barbiturique par la solution d’hydroxyde de sodium.
10. Rappeler la définition de l’équivalence d’un titrage.
A l’équivalence, les réactifs sont introduits dans des proportions stœchiométriques.
11. À partir des résultats du titrage, déterminer la masse en acide barbiturique présente dans 1,00 g de solide recristallisé.
A l’équivalence, les réactifs sont introduits dans des proportions stœchiométriques :
$$\frac{n_{AH}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$$
$$\frac{m_{AH}}{M_{AH}}=C_b \times V_{eq}$$
$$m_{AH}=C_b \times V_{eq} \times M_{AH}$$
$V_{beq}$ est obtenu par lecture graphique : $V_{eq}=15,6\ mL$
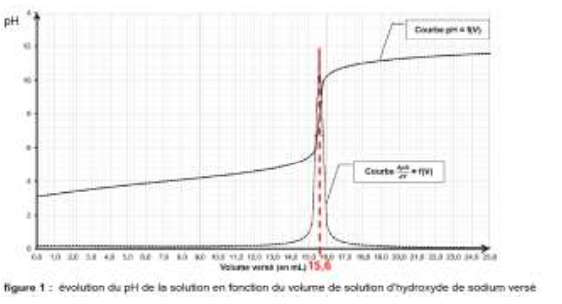
$$m_{AH}=5,00{ \times 10}^{-1} \times 15,6{ \times 10}^{-3} \times 128,0$$
$$m_{AH}=0,998\ g$$
12. Préciser si la recristallisation a été satisfaisante. Justifier.
$$Degre\ de\ purete=\frac{m_{AH}}{m_{solide}}=\frac{0,998}{1,00}=0,998=99,8%$$
La recristallisation a été satisfaisante.
Partie 2 – Étude de la cinétique de l’hydrolyse de l’urée
Dans le cadre d’un suivi médical, il peut être nécessaire de contrôler la teneur en urée dans les urines. Une méthode pour réaliser ce dosage consiste à procéder, dans un premier temps, à l’hydrolyse de l’urée en ions ammonium et carbonate. Ce sont les ions ammonium formés qui, par la suite, font l’objet d’une analyse en vue de remonter à la concentration initiale en urée.
Dans ce processus de dosage, l’hydrolyse de l’urée est une transformation lente. Une étude expérimentale est conduite pour établir les caractéristiques cinétiques de cette transformation et la manière de l’optimiser.
Pour simplifier l’étude, l’hydrolyse de l’urée est modélisée par la réaction (2) d’équation :
CH4N2O(aq) + 2 H2O(l) → 2 NH4+ (aq) + CO32-(aq) (réaction 2)
L’eau est en large excès.
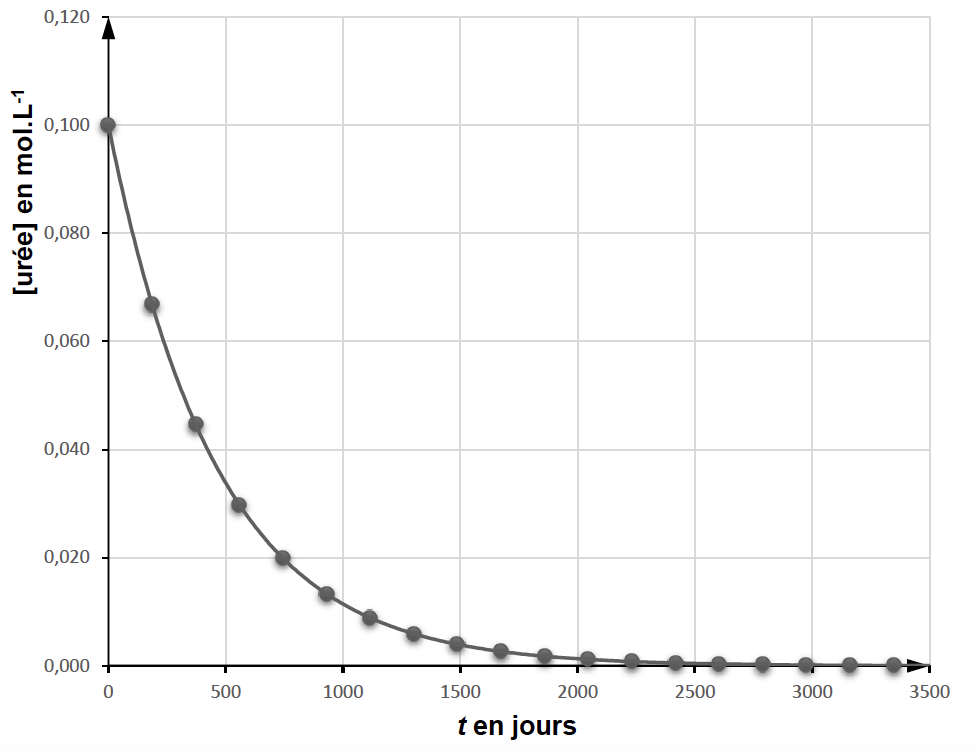
On suit l’évolution, au cours du temps, de la concentration en quantité de matière de l’urée, [urée]𝑡, dans une solution aqueuse diluée et maintenue à la température constante de 37 °C.
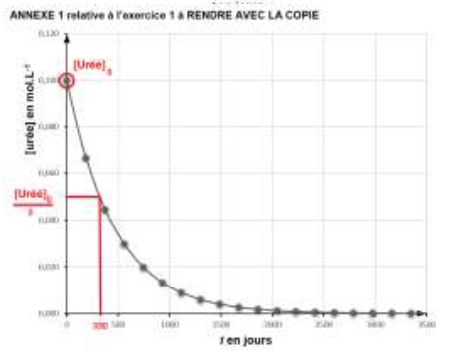
Les mesures et leurs exploitations ont permis de tracer les représentations en figures 2 et 3 en annexe page 15/16 à RENDRE AVEC LA COPIE.
13. D’après les résultats expérimentaux, indiquer si l’hydrolyse de l’urée est une transformation totale ou non. Justifier.
D’après l’annexe 1, [Uréé]=0 après un temps long (vers 2500 jours).
Comme il ne reste plus d’urée à la fin, la réaction est totale.
14. Indiquer de même si cette transformation est rapide ou lente.
D’après l’annexe 1, [Uréé]=0 après un temps long (vers 2500 jours).
Comme la réaction dure 2500 jours, la réaction est lente.
15. Déterminer la concentration initiale en urée [urée]0 et estimer la valeur du temps de demi-réaction 𝑡1/2. Expliquer la démarche.
$\left[Uree\right]_0=0,100\ mol{.L}^{-1}$ t1/2 est la durée nécessaire pour que l’avancement atteigne la moitié de sa valeur finale : $$\left[Uree\right]_{t_{1/2}}=\frac{\left[Uree\right]_0}{2}$$
Graphiquement : t1/2 =330 jours
16. Discuter la possibilité de mettre en œuvre le dosage de l’urée décrit en introduction de la partie 2 compte tenu des caractéristiques d’évolution temporelle de l’hydrolyse de l’urée.
« Une méthode pour réaliser ce dosage consiste à procéder, dans un premier temps, à l’hydrolyse de l’urée en ions ammonium et carbonate. Ce sont les ions ammonium formés qui, par la suite, font l’objet d’une analyse en vue de remonter à la concentration initiale en urée. »
Or il faut 2500 jours pour que l’hydrolyse soit terminée.
Le patient ne peut attendre la fin de l‘hydrolyse.
Il est donc impossible de mettre en œuvre le dosage de l’urée décrit en introduction de la partie 2 compte tenu des caractéristiques d’évolution temporelle de l’hydrolyse de l’urée.
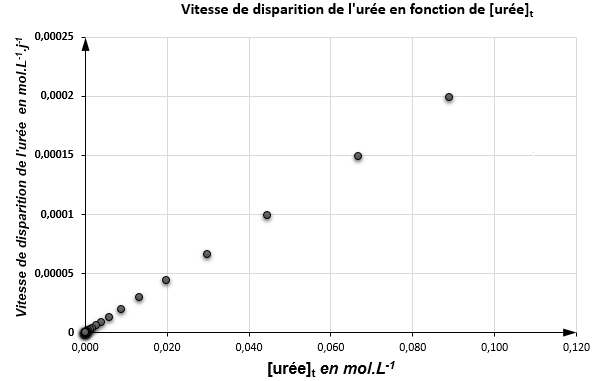
Pour affiner la caractérisation de la cinétique de cette transformation, on cherche à identifier sa loi de vitesse.
17. Définir la vitesse volumique de disparition de l’urée en fonction de la concentration en urée, [urée]𝑡.
$$v_d=-\frac{d\left[Uree\right]_{(t)}}{dt}$$
18. Montrer que les résultats expérimentaux sont compatibles avec une loi de vitesse d’ordre 1 pour l’évolution de la vitesse volumique de disparition de l’urée. Justifier.
Dans le cas d’une loi de vitesse d’ordre 1, la relation existante entre la vitesse volumique de disparition 𝑣 du saccharose, la concentration en saccharose [S] et une constante de vitesse notée 𝑘 est :
$$v_d=k \times \left[Uree\right]_{(t)}$$
Nous avons une droite qui passe par l’origine donc $v_d$ est proportionnel à $\left[Uree\right]_{(t)}$ : $$\ v_d=k \times \left[Uree\right]_{(t)}$$
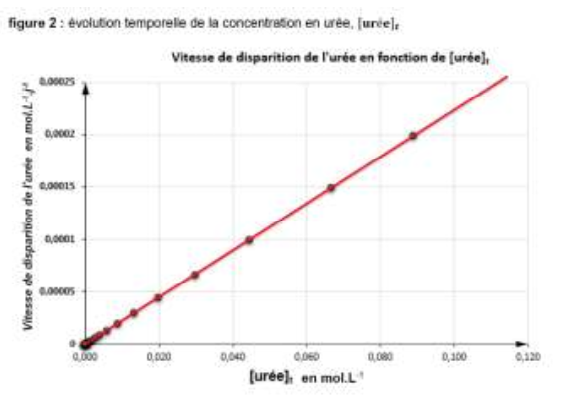
C’est bien en accord avec une loi de vitesse d’ordre 1.
19. On note k la constante de vitesse de cette loi. Déterminer la valeur de k. L’hydrolyse peut être réalisée en présence d’une enzyme : l’uréase.
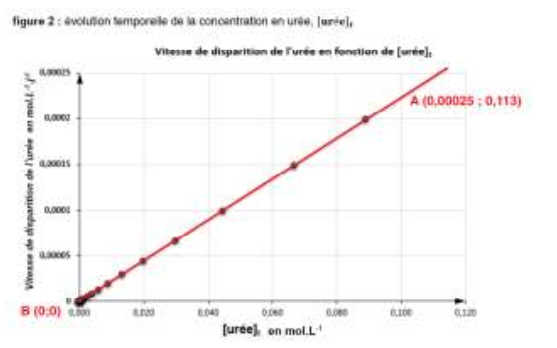
K est le coefficient directeur de la droite :
$$k=\frac{y_B-y_A}{x_B-x_A}$$
$$k=\frac{0,00025-0}{0,113-0}=2,2.{10}^{-3}j^{-1}$$
Les résultats de deux expériences d’hydrolyse de l’urée sont regroupés dans le tableau suivant.
| Expérience | Température en K | Constante de vitesse k en j−1 (avec j = jour) |
| Sans l’enzyme uréase | 310 | 2,2 × 10−3 |
| Avec l’enzyme uréase | 310 | 8,0 × 109 |
Lorsque l’évolution temporelle de la concentration suit une loi cinétique d’ordre 1, 𝑡1/2 et k sont reliés par la relation :
$t_{1/2}= \frac{ln 2}{k} $
20. Sachant que l’on récupère la totalité de l’uréase à la fin de l’hydrolyse, indiquer son rôle lors de cette hydrolyse.
On récupère la totalité de l’uréase à la fin de l’hydrolyse. De plus en présence d’uréase, la constante de vitesse k est plus grande.
Ainsi l’uréase augmente la vitesse de la réaction sans être consommé : c’est un catalyseur.
21. Comparer les échelles de temps relatives à l’hydrolyse de l’urée avec et sans uréase. Conclure quant à l’optimisation recherchée pour l’hydrolyse de l’urée.
$$t_{1/2}=\frac{\ln{\left(2\right)}}{k}$$
Comparons les temps de demi réaction avec et sans uréase :
$$\frac{t_{1/2\ avec\ urease}}{t_{1/2\ sans\ urease}}=\frac{\ln{\left(2\right)}}{k_{avec\ urease}} \times \frac{k_{sans\ urease}}{\ln{\left(2\right)}}=\frac{k_{sans\ urease}}{k_{avec\ urease}}$$
$$\frac{t_{1/2\ avec\ urease}}{t_{1/2\ sans\ urease}}=\frac{2,2.{10}^{-3}}{8,0.{10}^9}=2,8.{10}^{-13}$$
$$t_{1/2\ avec\ urease}=2,8.{10}^{-13} \times t_{1/2\ sans\ urease}$$
$$t_{1/2\ avec\ urease}=2,8.{10}^{-13} \times 330 \times 24 \times 3600$$
$$t_{1/2\ avec\ urease}=8,0.{10}^{-6}s$$
Le temps de demi réaction avec uréase est très petit. La réaction est instantanée.
Il devient possible de mettre en œuvre le dosage de l’urée décrit en introduction de la partie 2.
ANNEXE 1 relative à l’exercice 1 à RENDRE AVEC LA COPIE