Bac Asie 2024 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°24-PYCJ1JA1
Sujet et corrigé
Exercice 1 – Ne jamais mélanger eau de Javel et acide (9 points)
Dans un article en date du 25 avril 2023, l’agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) alerte sur la recrudescence d’accidents de particuliers ayant réalisé des mélanges à base d’eau de Javel et d’acides pour fabriquer des produits de désherbage « faits maison ». Or, ces mélanges peuvent provoquer des intoxications pouvant conduire à l’hospitalisation.
En mélangeant de l’eau de Javel et de l’acide chlorhydrique ménager, un étudiant a été victime d’une telle intoxication. Heureusement, le dégagement gazeux a été nettement moins important qu’il n’aurait dû l’être, ce qui a limité les effets de l’intoxication à de la toux et de violents maux de tête.
La transformation chimique qui rend ce mélange si dangereux est étudiée dans la première partie de l’exercice. Les deux parties suivantes visent à comprendre ce qui a diminué le dégagement gazeux et ainsi limité la gravité de l’intoxication.
Partie A – Étude du dégagement de dichlore
L’acide chlorhydrique et l’eau de Javel sont deux produits couramment utilisés dans un contexte ménager pour leurs propriétés complémentaires – détartrant pour l’un, antiseptique pour l’autre. Il est donc tentant de vouloir les mélanger pour combiner ces propriétés. Toutefois, cela est excessivement dangereux du fait d’un dégagement très rapide de gaz dichlore (Cl2), un gaz vert, dense et très toxique. Par ailleurs, la transformation chimique responsable de ce dégagement gazeux consomme les principes actifs de l’eau de Javel (ions hypochlorite, ClO−) et de l’acide chlorhydrique (ions oxonium, H3O+), neutralisant les propriétés antiseptiques et détartrantes.
L’eau de Javel est une solution basique contenant des ions hypochlorite (ClO−), chlorure (Cl−), hydroxyde (HO−) et sodium (Na+). L’ion hypochlorite est la base conjuguée de l’acide hypochloreux (HClO).
Données :
- Le pH d’une eau de Javel est compris entre 11,5 et 12,5.
- La valeur du p𝐾𝐴 du couple acide-base HClO/ClO− est 7,5.
Q1- Représenter le diagramme de prédominance du couple HClO/ClO−.
Diagramme de prédominance :
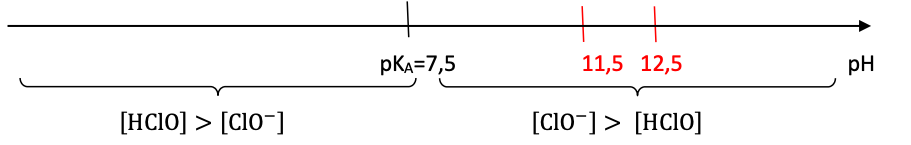
Q2- Indiquer l’espèce du couple HClO/ClO− prédominante dans l’eau de Javel.
Le pH est compris entre 11,5 et 12,5 , d’après le diagramme de prédominance ClO− est l’espèce prédominante dans l’eau de Javel.
L’étudiant mentionné dans l’introduction a mélangé un litre d’eau de Javel avec un volume identique d’acide chlorhydrique ménager (H3O+ ; Cl−). Avant le mélange, l’eau de Javel a une concentration en ions hypochlorite 𝐶0 de 0,40 mol ⋅ L−1. Après le mélange, la solution obtenue, que l’on note 𝑆m, a un pH voisin de 0.
Q3- Justifier que, dans la solution 𝑆m, les ions hypochlorite ont presque tous été transformés en acide hypochloreux.
La transformation entre l’acide chlorhydrique et l’eau de javel est :
$$ClO^-(aq)+H_3O^+(aq)\rightarrow HClO(aq)+H_2O(l)$$
Le pH est proche de 0, d’après le diagramme de prédominance HClO prédomine.
Ainsi, dans la solution 𝑆m, les ions hypochlorite ClO− ont presque tous été transformés en acide hypochloreux HClO.
En plus de ces propriétés acido-basiques, l’acide hypochloreux HClO et l’ion chlorure Cl− forment également des couples oxydant-réducteur avec le dichlore Cl2 :
- L’acide hypochloreux est l’oxydant du couple HClO/Cl2.
- L’ion chlorure est le réducteur du couple Cl2/Cl−.
Ces propriétés d’oxydo-réduction sont responsables de la formation de dichlore en milieu acide.
Q4- Écrire les demi-équations redox des couples Cl2/Cl−et HClO/Cl2 (en milieu acide).
$${\rm Cl}_2(g)+2e^-=2{\rm Cl}^-(aq)$$
$$2HClO(aq)+2H^+(aq)+2e^-={\rm Cl}_2(g)+2H_2O(l)$$
Q5- En déduire que l’équation globale de réaction des ions chlorure avec l’acide hypochloreux est :
Cl−(aq) + HClO(aq) + H3O+(aq) ⇄ Cl2(g) + 2 H2O(𝓁)
Réaction des ions chlorure avec l’acide hypochloreux :
$$2{\rm Cl}^-(aq)={\rm Cl}_2(g)+2e^-$$
$$2HClO(aq)+2H^+(aq)+2e^-={\rm Cl}_2(g)+2H_2O(l)$$
$$2{\rm Cl}^-(aq)+2HClO(aq)+2H^+(aq)={\rm Cl}_2(g)+{\rm Cl}_2(g)+2H_2O(l)$$
$$2{\rm Cl}^-(aq)+2HClO(aq)+2H^+(aq)=2{\rm Cl}_2(g)+2H_2O(l)$$
On divise tout par 2 :
$$ {\rm Cl}^-(aq)+HClO(aq)+H^+(aq)={\rm Cl}_2(g)+H_2O(l)$$
Pour passer de $H^+$ à ${H_3O}^+$ on ajoute $H_2O$ :
$$ {\rm Cl}^-(aq)+HClO(aq)+{H_3O}^+(aq)={\rm Cl}_2(g)+H_2O(l)+H_2O(l)$$
Ainsi, l’équation globale de réaction des ions chlorure avec l’acide hypochloreux est :
$${\rm Cl}^-(aq)+HClO(aq)+{H_3O}^+(aq)\rightleftarrows{\rm Cl}_2(g)+2H_2O(l)$$
Cette transformation d’oxydo-réduction n’est possible que dans un milieu fortement acide (pH < 2), ce qui est le cas dans la solution 𝑆m obtenue par l’étudiant après avoir mélangé l’eau de Javel et l’acide chlorhydrique ménager.
On considère que, juste après le mélange, les deux litres de la solution 𝑆m contiennent la quantité de matière 𝑛HClO = 0,40 mol d’acide hypochloreux et que la transformation de formation du dichlore débute : la solution commence donc à dégager du gaz dichlore très toxique.
On souhaite évaluer le volume de dichlore théoriquement produit lors de ce mélange. Pour cela, on admet que, dans les conditions décrites :
- La transformation de formation du dichlore est totale.
- L’acide hypochloreux est le réactif limitant.
Q6- Montrer que la valeur de la quantité de matière de dichlore 𝑛Cl2 théoriquement produite par la transformation est 0,40 mol.
On considère que la réaction est totale. De plus, l’acide hypochloreux est le réactif limitant.
$${\rm Cl}^-(aq)+HClO(aq)+{H_3O}^+(aq)\rightleftarrows{\rm Cl}2(g)+2H_2O(l)$$
D’après l’équation :
$$n_{{\rm Cl}_2}^{théorique}=n{HClO}^i$$
$$n_{{\rm Cl}_2}^{théorique}=0,40\ mol$$
Q7- En utilisant le volume molaire du dichlore gazeux, en déduire la valeur du volume 𝑉Cl2 occupé par le gaz dichlore théoriquement produit par la transformation.
Donnée :
Volume molaire du dichlore gazeux sous une pression d’une atmosphère à une température de 20 °C :
𝑉𝑚(Cl2(g)) = 24 L ⋅ mol−1
$$n_{{\rm Cl}2}^{théorique}=\frac{V_{{\rm Cl}_2}}{V_m}$$
$$V_{{\rm Cl}_2}=n_{{\rm Cl}2}^{théorique}\times V_m$$
$$V_{{\rm Cl}_2}=0,40\times 24$$
$$V_{{\rm Cl}_2}=9,6\ L$$
Le volume 𝑉Cl2 occupé par le gaz dichlore théoriquement produit par la transformation est de 9,6 L.
Même en extérieur, une telle quantité de gaz aurait pu avoir des conséquences dramatiques. La quantité de gaz produite a néanmoins été beaucoup plus faible, limitant la gravité de l’accident. Dans la suite, on recherche la cause de cette anomalie bienvenue.
Partie B – État de conservation de l’acide chlorhydrique
La première piste est celle de la bouteille d’acide chlorhydrique utilisée. En effet, si sa concentration est significativement inférieure à celle prévue, la consommation des ions oxonium au cours de la production du dichlore est susceptible d’élever rapidement le pH jusqu’à stopper la réaction redox.
L’acide chlorhydrique est une solution aqueuse obtenue par dissolution de chlorure d’hydrogène gazeux HCl(g) dans l’eau. Le chlorure d’hydrogène étant un acide fort dans l’eau, il se dissocie totalement pour former des ions oxonium H3O+(aq) et des ions chlorure Cl−(aq). Le document 1 rassemble quelques informations sur la bouteille utilisée.
Document 1 – Informations sur la bouteille d’acide chlorhydrique utilisée
Masse molaire du chlorure d’hydrogène :
$M(HCl)=36,5\ g \cdot mol^{-1}$
Titre massique en acide chlorhydrique de la solution :
$$w=\frac{masse\ HCl}{masse\ solution}=23\ %$$
Masse volumique de la solution commerciale :
$$\rho=1120,0\ g \cdot L^{-1}$$

Q8- Montrer que, d’après l’étiquette, la concentration en quantité de matière 𝐶a en ions oxonium dans la solution commerciale devrait être d’environ 7 mol⋅L−1.
$$C_a=\frac{n_a}{V_{sol}}$$
Or
$$n_a=\frac{m_a}{M_a}$$
D’où
$$C_a=\frac{m_a}{M_a\times V_{sol}}$$
Or
$$w=\frac{m_a}{m_{sol}}$$
$$m_a=w\times m_{sol}$$
D’où
$$C_a=\frac{w\times m_{sol}}{M_a\times V_{sol}}$$
Or
$$\rho=\frac{m_{sol}}{V_{sol}}$$
D’où
$$C_a=\frac{w\times \rho}{M_a}$$
$$C_a=\frac{\frac{23}{100}\times 1120,0}{36,5}$$
$$C_a=7,1\ mol.L^{-1}$$
Ainsi, la concentration en quantité de matière 𝐶a en ions oxonium dans la solution commerciale devrait être d’environ 7 mol⋅L-1 .
Pour vérifier expérimentalement la valeur de cette concentration, on réalise un titrage de l’acide chlorhydrique par une solution de soude (Na+(aq) + HO−(aq)) avec suivi pH- métrique.
Q9- Écrire l’équation support du titrage entre l’ion oxonium et l’ion hydroxyde.
$${H_3O}^+(aq)+{\rm HO}^-(aq)\rightarrow H_2O(l)+H_2O(l)$$
$${H_3O}^+(aq)+{\rm HO}^-(aq)\rightarrow 2H_2O(l)$$
Pour réaliser le titrage, on utilise une solution de soude fraichement préparée de concentration 𝐶b = 2,0 × 10−2 mol ⋅ L−1. Par ailleurs, on ne titre pas directement la solution commerciale d’acide chlorhydrique. On prépare une solution S par dilution d’un facteur 500 de la solution commerciale et on titre un volume 𝑉S = 20,0 mL de la solution S.
On note 𝐶S la concentration en ions oxonium de la solution S.
Q10- Calculer le volume de solution commerciale à prélever pour préparer 1,0 L de solution S.
Le facteur de dilution est défini par :
$$F=\frac{V_{fille}}{V_{mère}}$$
$$V_{mère}=\frac{V_{fille}}{F}$$
$$V_{mère}=2,0\times 10^{-3}\ L$$
$$V_{mère}=2,0\ mL$$
Pour préparer 1,0 L de solution commerciale, il faut prélever de 2,0 mL de solution S.
Q11- Proposer un protocole pour préparer 1 L de solution S en précisant la verrerie utilisée (nature et volume).
Protocole pour préparer 1 L de solution S :
- Prélever 2,0 mL de la solution commerciale avec une pipette jaugée de 2,0 mL
- Verser ce volume dans une fiole jaugée de 1,0 L
- Ajouter de l’eau au 3/4 et homogénéiser
- Compléter avec de l’eau jusqu’au trait de jauge et homogénéiser
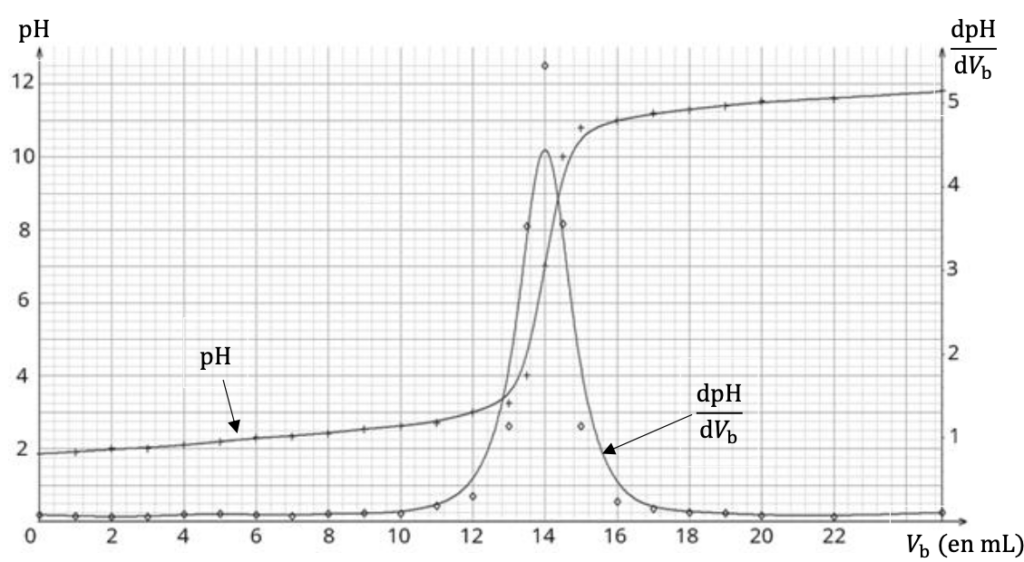
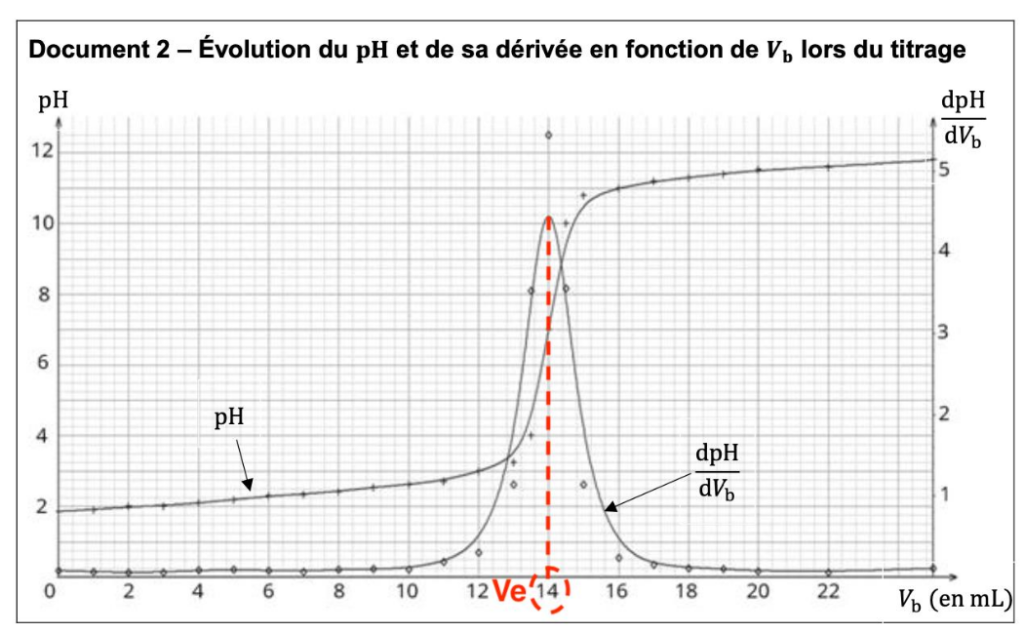
On prélève à la pipette jaugée le volume 𝑉S = 20,0 mL de la solution S et on réalise un titrage avec suivi pH-métrique. Le document 2, page 5, rassemble les mesures de pH représentées en fonction du volume 𝑉b de soude versée ; la dérivée dpH/d𝑉b est également représentée.
Q12- Vérifier que la concentration en ions oxonium de la solution commerciale d’acide chlorhydrique est bien celle estimée à la question Q8.
Pour répondre à cette question, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Document 2 – Évolution du 𝐩𝐇 et de sa dérivée en fonction de 𝑽𝐛 lors du titrage
$${H_3O}^+(aq)+{\rm HO}^-(aq)\rightarrow 2H_2O(l)$$
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques :
$$\frac{n\left({H_3O}^+\right)}{1}=\frac{n_{eq}\left({\rm HO}^-\right)}{1}$$
$$C_S\times V_S=C_b\times V_e$$
$$C_S=\frac{C_b\times V_e}{V_S}$$
Par lecture graphique (au max de la dérivée de pH), on lit $V_e=14,0\ mL$
$$C_S=\frac{2,0\times 10^{-2}\times 14,0}{20,0}$$
$$C_S=1,4\times 10^{-2}\ mol.L^{-1}$$
Or, la solution S est préparée par dilution d’un facteur 500 de la solution commerciale.
Ainsi :
$$C_a=500\times C_S$$
$$C_a=7,0\ mol.L^{-1}$$
Ainsi, la concentration en ions oxonium de la solution commerciale d’acide chlorhydrique est bien celle estimée à la question Q8.
Partie C – Conservation de l’eau de Javel
L’acide chlorhydrique ayant la concentration attendue, une autre origine possible de la faible quantité de dichlore produite lors de l’accident est une dégradation de l’eau de Javel. En effet, l’ion hypochlorite ClO− est fortement oxydant : cela lui confère ses propriétés antiseptiques mais lui permet également de réagir avec l’eau. Cette réaction, très lente, conduit à la dégradation progressive de l’eau de Javel.
L’action des ions hypochlorite sur l’eau est décrite par l’équation de réaction ci-dessous :
2 ClO−(aq) + 2 H2O(𝓁) → 2 Cl−(aq) + O2(g) + 2 H2O(𝓁)
La bouteille d’eau de Javel utilisée par l’étudiant est une solution commerciale à 2,6 % en chlore actif, ce qui correspond à une concentration en ions hypochlorite de valeur attendue 𝐶0 = 0,40 mol ⋅ L−1. La bouteille porte la mention « à conserver au frais ».
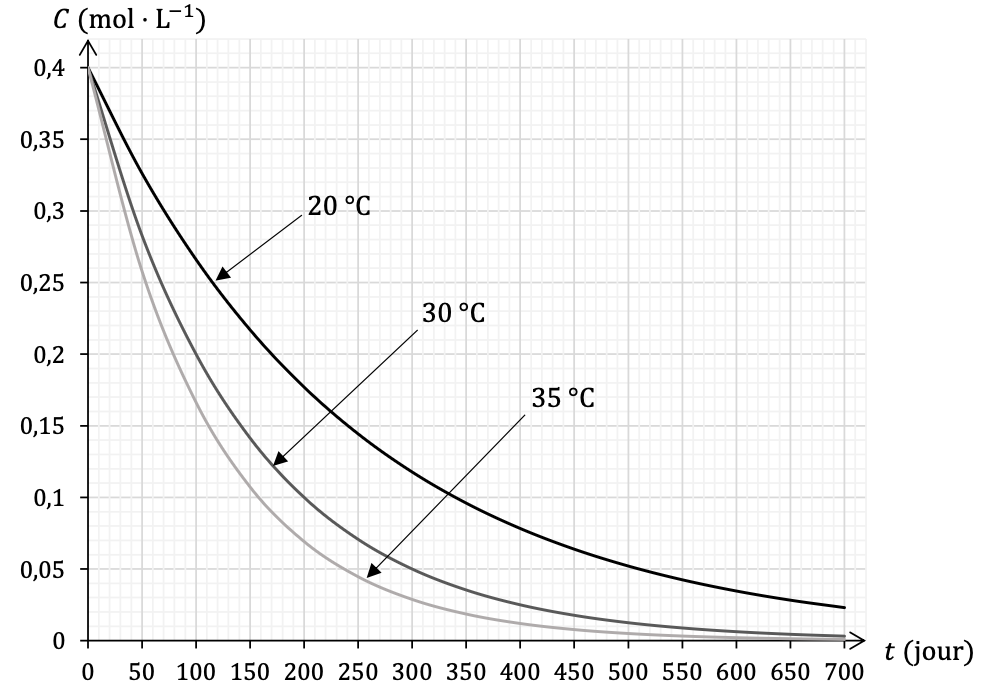
Le document 3, page 6, montre l’évolution au cours du temps de la concentration 𝐶 en ions hypochlorite de trois solutions identiques à celle de l’étudiant, conservées dans des conditions de températures différentes.
Q13- Définir le temps de demi-réaction et expliquer comment le mesurer dans le cas particulier de la courbe « 30 °C » du document 3, page 6.
$t_{1/2}$ est la durée nécessaire pour que l’avancement atteigne la moitié de sa valeur finale : $x(t_{1/2})=\frac{x_f}{2}$.
C’est également le temps pour que la concentration initiale soit divisée par 2.
Pour trouver le temps de demi-réaction, on lit graphiquement le temps pour lequel la concentration initiale a été divisée par 2.
Par lecture graphique, à $30\ ^\circ{\rm C}$, $t_{1/2}=100\ jours$
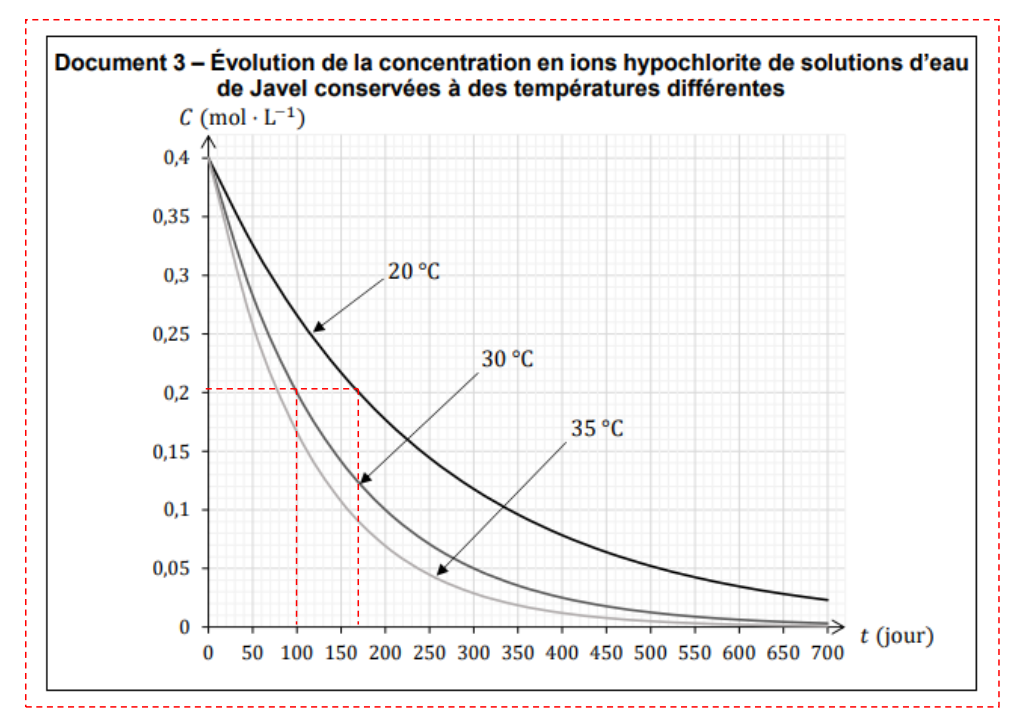
Q14- En utilisant le temps de demi-réaction, caractériser l’influence de la température sur la cinétique de la transformation étudiée en exploitant le document 3.
Déterminons $t_{1/2}$ à $20\ ^\circ{\rm C}$ et $35\ ^\circ{\rm C}$
à $35\ ^\circ{\rm C}$ $t_{1/2}=80\ jours$
à $30\ ^\circ{\rm C}$ $t_{1/2}=100\ jours$
à $20\ ^\circ{\rm C}$ $t_{1/2}=180\ jours$
Lorsque la température augmente, le temps de demi réaction diminue.
Ainsi, lorsque la température augmente, la vitesse de réaction augmente.
Q15- Justifier la recommandation « à conserver au frais ».
Lorsque la température augmente, la vitesse de réaction augmente.
Lorsque la température diminue, la vitesse de réaction diminue.
Ainsi, la recommandation « à conserver au frais » permet de diminuer la vitesse de réaction et donc de prolonger sa « durée de vie ».
La bouteille d’eau de Javel utilisée par l’étudiant était ouverte depuis 18 mois et a été conservée à une température de 20 °C.
Q16- Justifier que cela peut expliquer la faible quantité de gaz produite lors de l’accident.
$$18\ mois=18\times 30=540\ jours$$
Par lecture graphique, la concentration de l’eau de javel est moins de environ $0,045\ mol.L^{-1}$ soit près de 10% de la concentration initiale : la réaction avec l’acide chlorhydrique produira moins de dichlore.
Ainsi, cela peut expliquer la faible quantité de gaz produite lors de l’accident.
Document 3 – Évolution de la concentration en ions hypochlorite de solutions d’eau de Javel conservées à des températures différentes