Métropole Septembre 2022 Sujet 2
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2ME3
Mots-clés : réaction acide-base, titrage, cinétique chimique
Pour nettoyer une plaque de cuisson électrique encrassée, une méthode consiste à déposer, avant de frotter, de l’hydrogénocarbonate de sodium solide (vendu sous le nom de bicarbonate de soude) tout autour des plaques électriques puis à verser du vinaigre ménager.

D’après www.delcourt.fr
Dans cet exercice, on étudie la composition d’un vinaigre ménager, puis la cinétique de sa transformation chimique avec de l’hydrogénocarbonate de sodium.
| Nom du produit | Vinaigre ménager 14° |
| Masse volumique ρ | 1,0 g·mL–1 |
| pH | 2,2 |
D’après http://langle.fr/fiches-securites/6427-test
Figure 1. Fiche sécurité du vinaigre ménager 14°
Données :
- numéros atomiques : Z(H) = 1 ; Z(C) = 6 ; Z(O) = 8 ;
- masses molaires atomiques en g·mol–1 : M(H) = 1,00 ; M(C) = 12,0 ; M(O) = 16,0 ;
- pKA du couple acide éthanoïque / ion éthanoate : pKA = 4,76.
1. Étude des quelques propriétés acido-basiques de l’acide éthanoïque
Le vinaigre ménager est une solution aqueuse d’acide éthanoïque de formule CH3COOH. Dans cette partie on souhaite vérifier que l’acide éthanoïque est bien un acide faible dans l’eau.
Q1. Représenter le schéma de Lewis de la base conjuguée de l’acide éthanoïque.
Q2. Indiquer l’espèce majoritaire du couple de l’acide éthanoïque présente dans un vinaigre ménager 14°. Justifier.
Le pH d’une solution aqueuse d’acide éthanoïque de concentration 5,0×10–3 mol·L–1 est de 3,5.
Q3. Écrire l’équation de la réaction modélisant la transformation chimique entre l’acide éthanoïque et l’eau.
Q4. En utilisant la valeur du pH de la solution, montrer que le taux d’avancement final t de cette réaction est de l’ordre de 6 %. Commenter ce résultat quant à la force de l’acide éthanoïque dans l’eau.
2. Dosage par titrage du vinaigre ménager 14°
Le degré d’acidité d’un vinaigre ménager est égal au titre massique, exprimé en pourcentage, en acide éthanoïque de ce vinaigre.
On réalise le titrage d’un volume de 10,0 mL d’une solution de vinaigre ménager 14° dilué 100 fois par une solution aqueuse titrante d’hydroxyde de sodium de concentration 2,00×10–2 mol·L–1. Le suivi est effectué à l’aide d’un pH-mètre et permet de tracer la courbe représentant le pH en fonction du volume V de solution titrante versée. Cette courbe figure sur l’ANNEXE 1 À RENDRE AVEC LA COPIE.
| Indicateur coloré | Teinte de la forme acide | Zone de virage | Teinte de la forme basique |
| Hélianthine | Rouge | 3,1 – 4,4 | Jaune |
| Vert de bromocrésol | Jaune | 3,8 – 5,4 | Bleu |
| Rouge de crésol | Jaune | 7,8 – 8,8 | Rouge |
| Rouge d’alizarine | Violet | 10,0 – 12,0 | Jaune |
| Carmin d’indigo | Bleu | 11,6 – 14,0 | Jaune |
Figure 2. Indicateurs colorés acido-basiques
Q5. Écrire l’équation de réaction support du titrage de l’acide éthanoïque par l’hydroxyde de sodium.
Q6. Déterminer, en réalisant une construction sur l’ANNEXE 1 À RENDRE AVEC LA COPIE, le volume VE de solution aqueuse titrante d’hydroxyde de sodium versé à l’équivalence du titrage.
Q7. Expliquer quel aurait été l’indicateur coloré le plus adapté, parmi ceux fournis sur la figure 2, pour réaliser ce titrage par colorimétrie.
Q8. Après avoir exploité le titrage pour déterminer la valeur de la concentration en quantité de matière de la solution diluée 100 fois, calculer le titre massique du vinaigre ménager étudié. Commenter le résultat.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
3. Étude cinétique de la transformation chimique entre le vinaigre et l’hydrogénocarbonate de sodium
Lorsque le vinaigre ménager entre en contact avec l’hydrogénocarbonate de sodium solide NaHCO3(s), une transformation chimique totale et lente a lieu. Elle entraîne la formation de dioxyde de carbone gazeux CO2(g) détectable par l’apparition de bulles, qui contribuent à l’action mécanique nettoyante des plaques de cuisson, action d’autant plus efficace que la formation des bulles a lieu dans un temps assez court de l’ordre de quelques minutes. L’équation de la réaction modélisant la transformation chimique entre l’acide éthanoïque et l’hydrogénocarbonate de sodium est :
CH3COOH(aq) + NaHCO3(s) → Na+(aq) + CH3COO–(aq) + CO2(g) + H2O(l)
En laboratoire il est possible de suivre cette transformation chimique au cours du temps en recueillant le gaz formé dans une éprouvette graduée retournée initialement remplie d’eau. Pour cela, on réalise l’expérience schématisée ci-dessous à partir d’une masse d’environ 1 g d’hydrogénocarbonate de sodium solide NaHCO3(s), ce dernier est versé à la date t = 0 s dans une centaine de millilitres de vinaigre ménager 14° en excès devant l’hydrogénocarbonate de sodium.
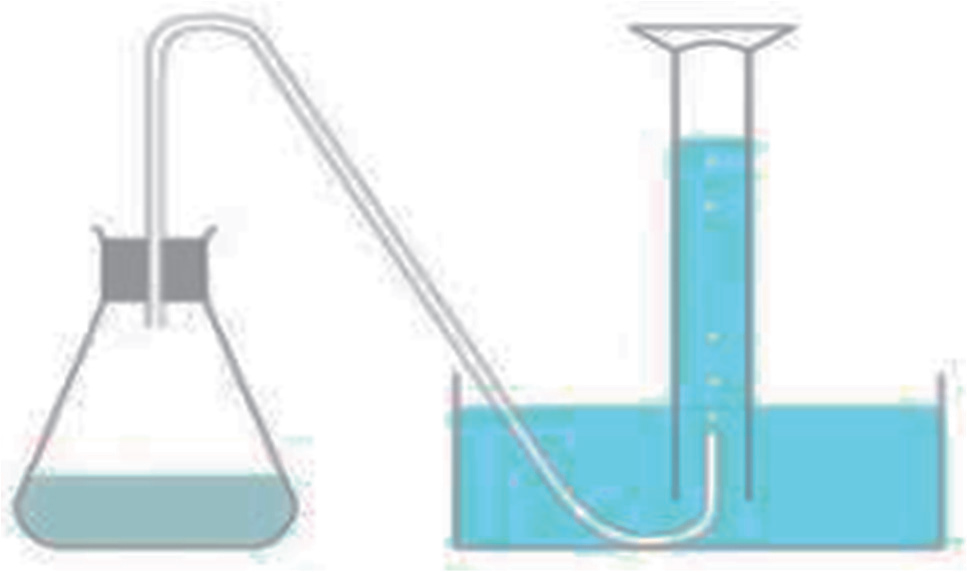
Figure 3. Montage permettant de mesurer le volume de dioxyde de carbone recueilli lors de la réaction entre l’acide éthanoïque et l’hydrogénocarbonate de sodium
Les résultats obtenus sont consignés sur le tableau ci-dessous.
| Temps t (s) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 70 | 80 | 90 |
| V(CO2) (mL) | 0 | 30 | 60 | 84 | 108 | 124 | 138 | 148 | 152 | 156 | 158 | 160 | 160 | 160 | 160 | 160 |
Figure 4. Tableau de mesures du volume de dioxyde de carbone recueilli au cours du temps
Donnée :
- volume molaire d’un gaz, dans les conditions de l’expérience : Vm = 24,2 L·mol–1.
Q9. Calculer la valeur de la quantité de matière de dioxyde de carbone formé à 30 s puis placer le point correspondant sur l’ANNEXE 2 À RENDRE AVEC LA COPIE.
Q10. Déterminer, en réalisant une construction sur l’ANNEXE 2 À RENDRE AVEC LA COPIE, le temps de demi-réaction. Commenter ce résultat au regard de l’utilisation qui est faite ici de cette transformation chimique.
ANNEXE 1 À RENDRE AVEC LA COPIE
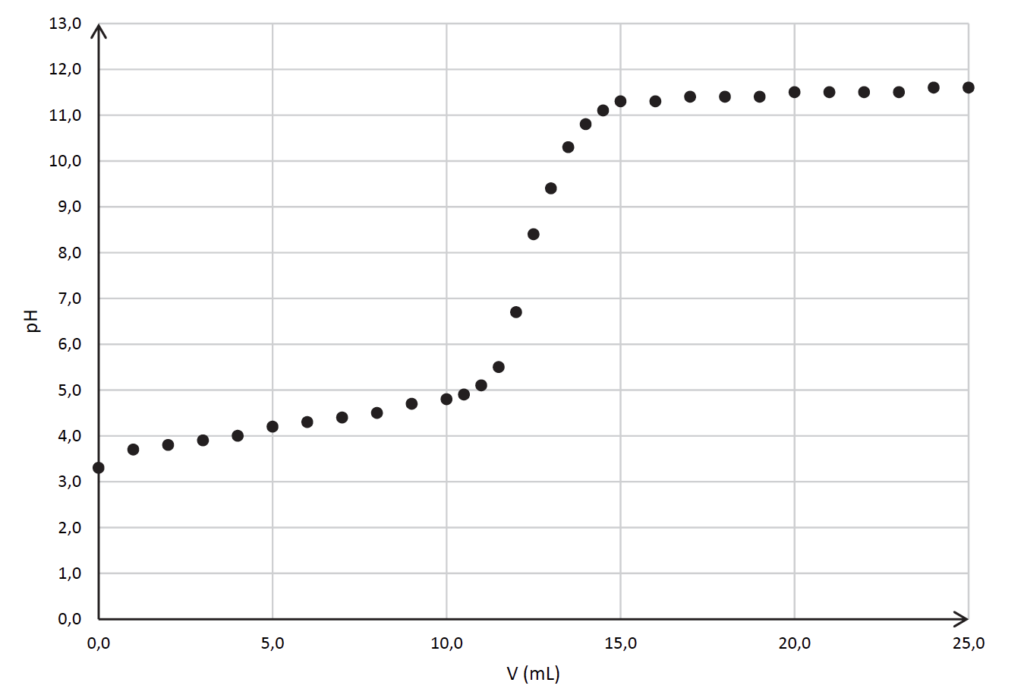
Annexe 1. Évolution du pH de la solution titrée en fonction du volume d’hydroxyde de sodium
versé
ANNEXE 2 À RENDRE AVEC LA COPIE
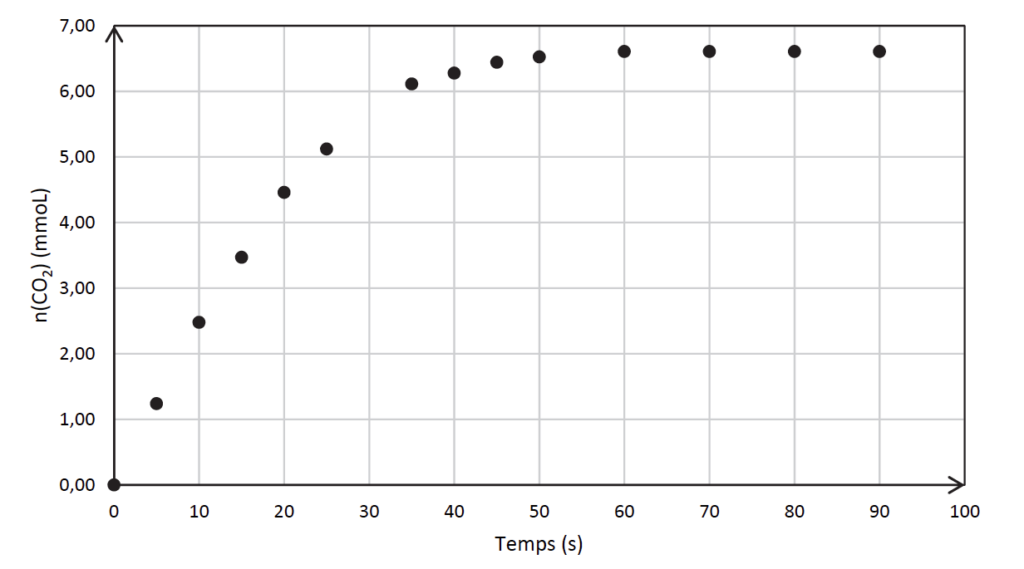
Annexe 2. Évolution de la quantité de matière de dioxyde de carbone recueilli au cours du temps
