Bac Amérique du nord 2023 Sujet 2
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°23-PYCJ2AN1
Sujet et corrigé
EXERCICE 2 : OPTIMISATION DE LA SYNTHÈSE DE L’ÉTHANOATE DE BENZYLE (5 POINTS)
L’éthanoate de benzyle est un ester qu’on trouve à l’état naturel dans beaucoup de fleurs, comme le jasmin. Son utilisation en quantité importante dans de nombreux domaines nécessite de recourir à sa synthèse industrielle.
A. Formation de l’ester
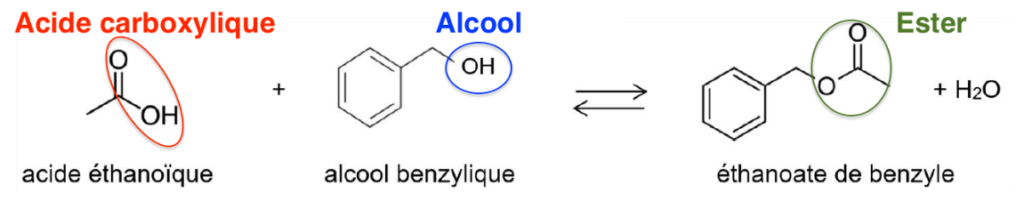
L’équation de la réaction modélisant la synthèse de l’éthanoate de benzyle est la suivante :
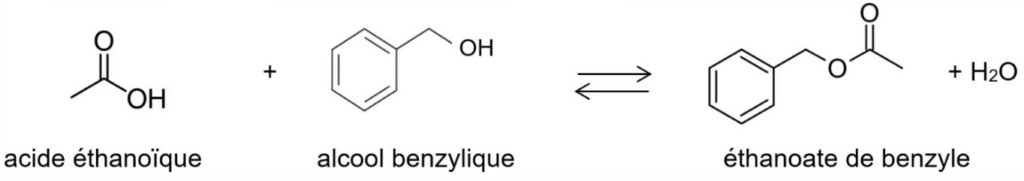
Q.1. Donner la formule brute de l’alcool benzylique.
Formule brute de l’alcool benzylique : C7H8O
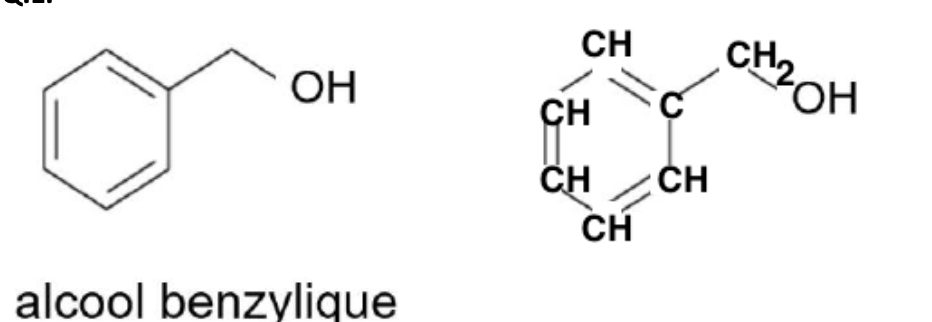
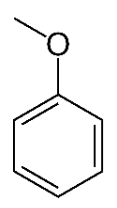
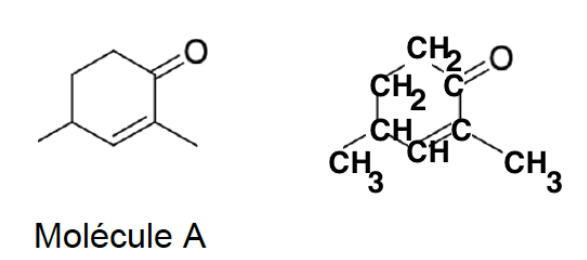
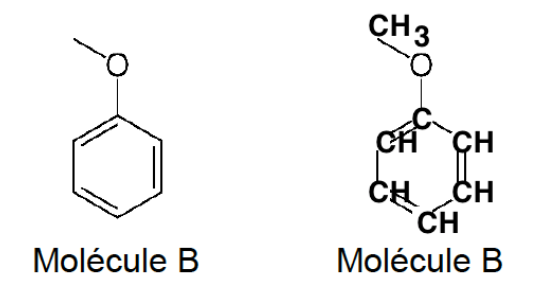
Q.2. Recopier les trois formules topologiques ci-dessus, entourer les groupes caractéristiques en précisant pour chacun d’eux la famille fonctionnelle correspondante.
Les formules topologiques de deux molécules A et B sont données ci-dessous :
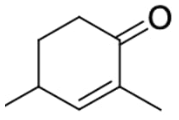
Molécule A
Molécule B
Q.3. Préciser laquelle de ces deux molécules est un isomère de l’alcool benzylique. Justifier.
Formule brute de la molécule A : C8H12O
Formule brute de la molécule B : C7H8O
Formule brute de l’alcool benzylique : C7H8O
La molécule B et l’alcool benzylique ont la même formule brute et une formule développée différente : la molécule B et l’alcool benzylique sont isomères.
Q.4. La synthèse de l’éthanoate de benzyle est une transformation lente, citer deux conditions expérimentales qui peuvent la rendre plus rapide.
Deux conditions expérimentales qui peuvent rendre une transformation plus rapide :
- Augmenter la température
- Ajouter un catalyseur.
B. Optimisation du rendement de la synthèse
De nombreuses synthèses ont un rendement faible, en particulier parce que les transformations associées ne sont pas totales.
Afin de déterminer le rendement, on met en œuvre le protocole 1 suivant associant la synthèse puis le titrage du réactif restant :
- dans un ballon sec, introduire un volume V1 = 2,7 mL d’acide éthanoïque et un volume V2 = 4,9 mL d’alcool benzylique ;
- adapter le réfrigérant à eau au ballon, puis chauffer le mélange à ébullition pendant 25 min ;
- quand le reflux a cessé, ajouter dans le ballon 100 mL d’eau glacée ;
- verser la totalité du mélange réactionnel dans une bécher de 250 mL et procéder alors au titrage de l’acide éthanoïque restant comme schématisé ci-après.
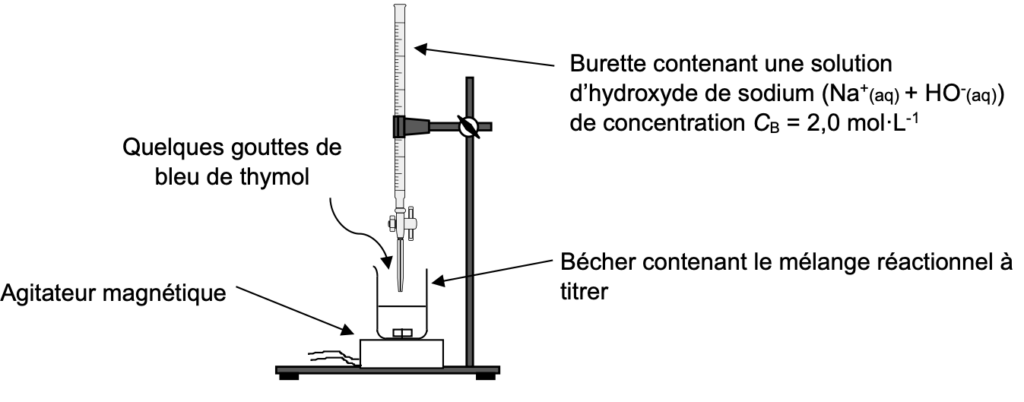
Schéma du dispositif expérimental du titrage
Données :
| Espèce | Acide éthanoïque | Alcool benzylique | Éthanoate de benzyle |
| Masse molaire moléculaire M (en g·mol-1) | 60,0 | 108,0 | 150,0 |
| Masse volumique ρ (en g·mL-1) à T = 20 °C | 1,05 | 1,04 | 1,05 |
Q.5. Déterminer les quantités de matière initiales ni1 d’acide éthanoïque et ni2 d’alcool benzylique introduites dans le ballon.
$$n=\frac{m}{M}$$
Or
$$\rho=\frac{m}{V}$$
$$m=\rho\times V$$
$$n=\frac{\rho\times V}{M}$$
$$n_{i1}=\frac{\rho_1\times V_1}{M_1}$$
$$n_{i1}=\frac{1,05\times 2,7}{60,0}$$
$$n_{i1}=4,7\times {10}^{-2}mol$$
$$n_{i2}=\frac{\rho_2\times V_2}{M_2}$$
$$n_{i2}=\frac{1,04\times 4,9}{108,0}$$
$$n_{i2}=4,7\times {10}^{-2}mol$$
Q.6. Établir la relation entre la quantité de matière d’acide éthanoïque consommée nacide cons. et la quantité de matière d’ester formé nester à partir de l’équation de la réaction modélisant la synthèse.
L’équation de la réaction modélisant la synthèse de l’éthanoate de benzyle est la suivante :
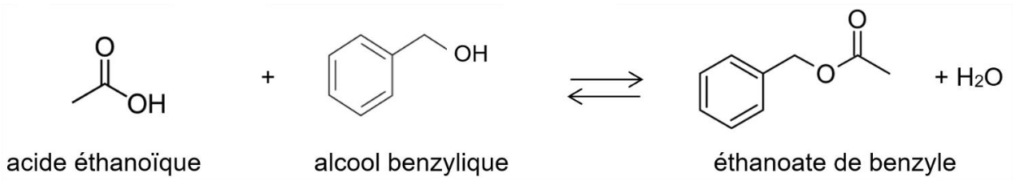
Les coefficients stœchiométriques valent 1 : pour une molécule d’acide éthanoïque consommée, une molécule d’éthanoate de benzyle est produite.
Ainsi nacide cons = nester
L’équation de la réaction support du titrage est :
CH3COOH(aq) + HO–(aq) → CH3COO–(aq) + H2O(ℓ).
On observe un changement de couleur du mélange réactionnel pour un volume d’hydroxyde de sodium versé de VE = 8,5 mL.
Q.7. Déterminer la quantité de matière de l’acide éthanoïque restant dans le mélange réactionnel nacide rest.
L’équation de la réaction support du titrage est : CH3COOH(aq) + HO–(aq) → CH3COO–(aq) + H2O(ℓ).
A l’équivalence :
$$\frac{n_{acide\ rest.}}{1}=\frac{n_{H0^-}^{eq}}{1}$$
$$n_{acide\ rest.}=n_{H0^-}^{eq}$$
$$n_{acide\ rest.}=C_B\times V_{eq}$$
$$n_{acide\ rest.}=2,0\times 8,5\times {10}^{-3}$$
$$n_{acide\ rest.}=2,0\times 8,5\times {10}^{-3}$$
$$n_{acide\ rest.}=1,7\times {10}^{-2}\ mol$$
Q.8. Définir et calculer le rendement r de la synthèse. Conclure.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Rendement r de la synthèse :
$$r=\frac{n_{ester\ exp}}{n_{ester\ \ theorique}}$$
Or
$$n_{ester\ \ theorique}=n_{i1}$$
$$n_{ester\ exp}=n_{i1}-n_{acide\ rest.}$$
$$r=\frac{n_{i1}-n_{acide\ rest.}}{n_{i1}}$$
$$r=\frac{4,7\times {10}^{-2}-1,7\times {10}^{-2}}{4,7\times {10}^{-2}}$$
$$r=0,64=64%$$
Le rendement n’est pas de 100% : la réaction est limitée.
Dans les mêmes conditions expérimentales que le protocole 1 mais en modifiant le volume d’acide éthanoïque introduit dans le ballon on réalise le protocole 2.
Le tableau ci-dessous récapitule les valeurs du rendement selon les conditions initiales pour les deux protocoles :
| Protocole | 1 | 2 |
| Volume d’acide éthanoïque V1 (en mL) | 2,7 | 4 |
| Volume d’alcool benzylique V2 (en mL) | 4,9 | 4,9 |
| Rendement r de la synthèse | 0,71 |
Q.9. Justifier l’évolution du rendement de la réaction de synthèse.
Si on modifie la quantité de matière de l’une des espèces chimiques présentes dans un système chimique en équilibre, l’évolution de ce système s’oppose à cette modification :
En augmentant le volume et donc la quantité de matière d’un réactif, le quotient de réaction diminue et ainsi $$Q_r<K$$ , le système chimique évolue spontanément dans le sens « direct ».
Lorsqu’une espèce chimique est apportée, l’évolution du système se fait dans le sens de sa consommation.
