Bac Amérique du nord 2021 Sujet 2
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ2AN1
Sujet et corrigé
Mots-clés : quotient de réaction ; réaction d’oxydo-réduction ; fonctionnement d’une pile.
Un projet de parc éolien en mer, celui des îles d’Yeu et de Noirmoutier, prévoit l’installation de soixante-deux éoliennes.
La méthode de protection contre la corrosion des structures immergées de ces éoliennes a été débattue. La « protection cathodique » envisagée initialement consistait à placer des anodes dites
« sacrificielles », composées essentiellement d’aluminium, sur les fondations en acier (95 % de fer) des éoliennes. En effet, la réaction des anodes sacrificielles avec le dioxygène dissous dans l’eau permet par transformation électrochimique de protéger le fer de la corrosion.
Finalement, après concertation, le constructeur du parc lui a préféré un système de protection dit « par courant imposé » qui permet d’éviter le rejet de métaux dans l’environnement.
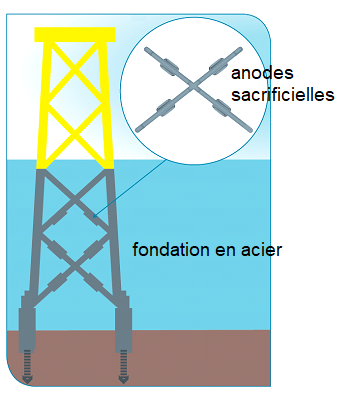
Dans cet exercice, on s’intéresse seulement au processus de protection cathodique.
A. Protection du fer par l’aluminium
On souhaite vérifier qu’en milieu oxydant on peut protéger le fer de l’oxydation en le mettant en contact électrique avec de l’aluminium qui joue alors le rôle d’anode sacrificielle. Par oxydation, le fer métallique donne des ions Fe II (Fe2+) et l’aluminium métallique donne des ions Aℓ3+.
On réalise la pile suivante :
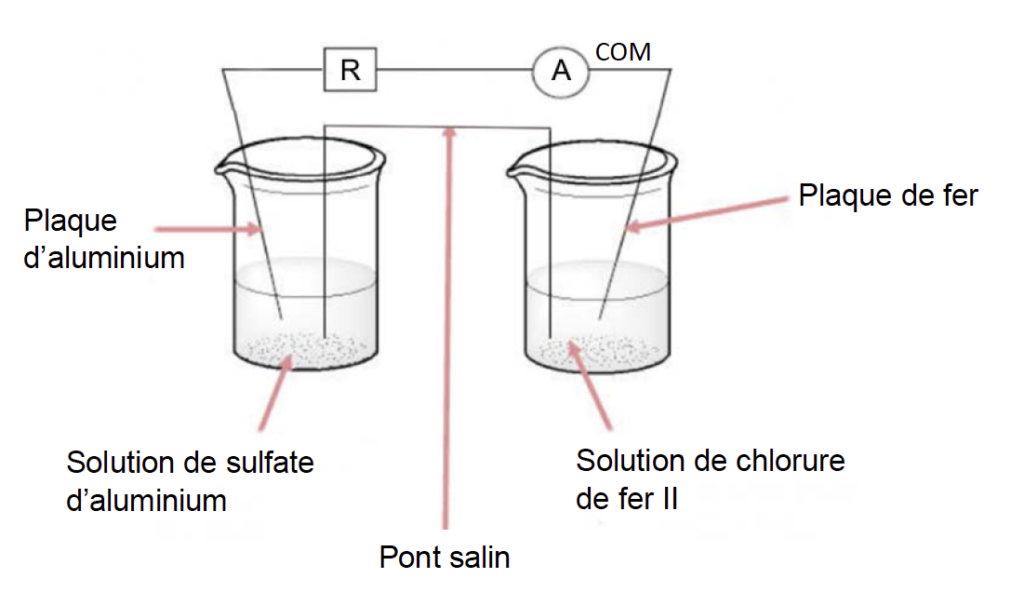
Dans un bécher, on verse un volume V1 = 50,0 mL de solution aqueuse de chlorure de fer II (Fe2+(aq) + 2 Cℓ–(aq)) de concentration apportée en quantité de matière C1 = 1,0 × 10-1 mol·L-1, puis on y plonge une plaque de fer.
Dans un second bécher, on verse un volume V2 = 50,0 mL d’une solution de sulfate d’aluminium (2 Aℓ3+(aq) + 3 SO42- (aq)) de concentration apportée en quantité de matière C2 = 5,0 × 10-2 mol.L-1, puis on y plonge une plaque d’aluminium.
Les deux béchers sont reliés par un pont salin et les deux plaques métalliques sont reliées par un ampèremètre et une résistance montés en série.
L’équation de la réaction qui modélise la transformation susceptible de se produire s’écrit :
2 Aℓ(s) + 3 Fe2+(aq) ⇄ 2 Aℓ3+(aq) + 3 Fe(s)
La constante d’équilibre K associée à cette réaction à 25 °C est égale à 10166.
A.1. Exprimer le quotient de réaction initial Qr,i.
Réponse :
$Q_{r,i}=\frac{\left[ Al^{3+} \right]_i^2}{\left[ Fe^{2+} \right]_i^3}$
A.2. Calculer, à l’état initial, la valeur de la concentration en quantité de matière des ions Aℓ3+(aq) et celle des ions Fe2+(aq).
Réponse :
Pour la solution de chlorure de fer (Fe2+(aq) + 2 Cℓ–(aq)) : [ Fe2+] = C1 = 1,0 × 10-1 mol·L-1
Pour la solution de sulfate d’aluminium (2 Aℓ3+(aq) + 3 SO42- (aq)) : [Aℓ3+] = 2 C2 = 1,0 × 10-1 mol.L-1
A.3. Calculer la valeur du quotient de réaction initial Qr,i puis en déduire le sens d’évolution spontanée de la transformation.
Réponse :
$Q_{r,i}=\frac{\left( 1,0.10^{-1} \right)^2}{\left( 1,0.10^{-1} \right)^3}=10$
Qr,i <K le sens d’évolution spontanée de la transformation est le sens direct.
A.4. En déduire la réaction se produisant à l’électrode d’aluminium.
Réponse :
L’équation de réaction est 2 Aℓ(s) + 3 Fe2+(aq) ⇄ 2 Aℓ3+(aq) + 3 Fe(s)
Les atomes d’aluminium se transforment donc en ion aluminium : Aℓ(s) = Aℓ3+(aq) + 3 e–
L’ampèremètre figurant sur le schéma indique une valeur d’intensité électrique négative.
A.5. Montrer que cette valeur négative est cohérente avec la réponse à la question précédente.
Réponse :
L’ampèremètre fournit une valeur positive lorsque la borne « com » est reliée à la borne négative de la pile.
Ici l’ampèremètre donne une valeur négative, la borne « com » est donc reliée à la borne positive de la pile.
Ainsi la borne positive est l’électrode de fer et la borne négative est l’électrode d’aluminium.
C’est cohérent avec la réponse de la question précédente car selon l’équation : Aℓ(s) = Aℓ3+(aq) + 3 e–
L’électrode Aluminium est donc le pole négatif de la pile (elle fournit des électrons).
L’anode est l’électrode siège d’une oxydation. La cathode est l’électrode siège d’une réduction.
A.6. Identifier l’électrode qui joue le rôle d’anode dans la pile.
Réponse :
L’anode est le siège d’une oxydation (perte d’électrons), ainsi l’anode est l’électrode d’aluminium.
B. Masse d’aluminium nécessaire à la protection de la structure métallique d’une éolienne
Le dioxygène dissous dans l’eau réagit préférentiellement avec l’aluminium de l’anode sacrificielle plutôt qu’avec le fer de la structure immergée de l’éolienne.
On souhaite évaluer la masse d’aluminium nécessaire à la protection de la structure d’une éolienne, c’est-à-dire à la protection cathodique.
Données :
- Couples oxydant/réducteur mis en jeu : Aℓ3+(aq) / Aℓ (s) ; O2(aq) / HO–(aq)
- Demi-équation du couple O2(aq) / HO–(aq) : O2(aq) + 2 H2O + 4 e– = 4 HO–(aq)
- Constante de Faraday F = 96,5 × 103 C·mol-1
- Constante d’Avogadro NA = 6,02 × 1023 mol-1
- Charge élémentaire e = 1,602 × 10-19 C
- Masse molaire de l’aluminium MAℓ = 27,0 g·mol-1
- La capacité électrique Q d’une pile est reliée à l’intensité I du courant électrique débité et à la durée de fonctionnement ∆t par la relation : Q = I·∆t
B.1. Écrire l’équation de la réaction modélisant la transformation chimique de corrosion de l’aluminium par le dioxygène dissous.
Réponse :
Aℓ3+(aq) / Aℓ (s) : 4x Aℓ(s) = Aℓ3+(aq) + 3 e–
O2(aq) / HO–(aq) : 3x O2(aq) + 2 H2O + 4 e– = 4 HO–(aq)
4 Aℓ(s) + 3 O2(aq) + 6 H2O = 4 Aℓ3+(aq) + 12 HO–(aq)
L’étude théorique des transferts d’électrons entre l’anode en aluminium et la structure d’une éolienne montre qu’une protection efficace correspond à un courant électrique d’intensité I de l’ordre de 400 A.
B.2. En explicitant le raisonnement, calculer la masse d’aluminium nécessaire à la « protection cathodique » pendant une durée de 25 ans.
Réponse :
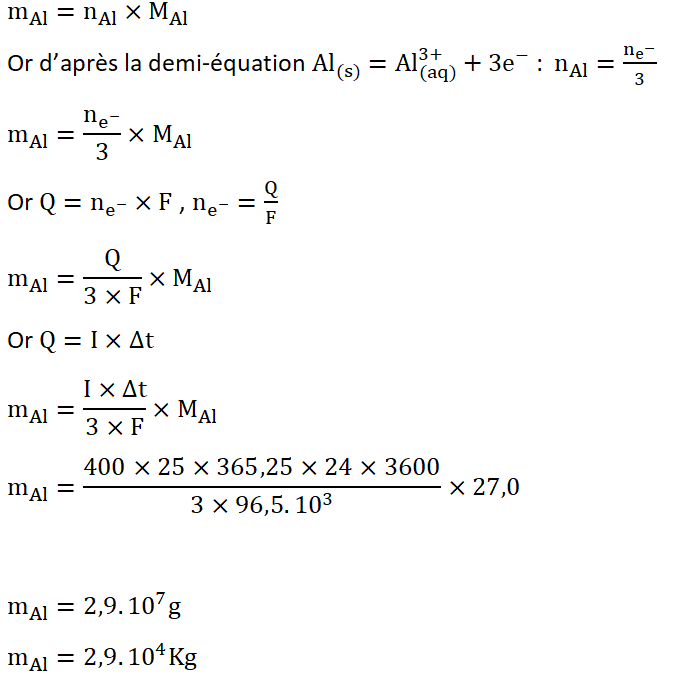
B.3. Citer au moins un argument expliquant que le constructeur ait finalement renoncé à la protection par anode sacrificielle.
Réponse :
La masse d’aluminium nécessaire est trop grande (29 tonnes). Son utilisation rejetterait une quantité de métaux importante dans la mer. De plus son cout n’est pas négligeable.
