Bac Liban 2023 Sujet 1
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°23-PYCJ1LI1
Sujet et corrigé
EXERCICE 3 : STOCKAGE DANGEREUX DU PEROXYDE D’HYDROGÈNE (4 POINTS)
Les solutions aqueuses de peroxyde d’hydrogène H2O2 (ou eau oxygénée) sont très utilisées dans différents domaines industriels comme agent de blanchiment ou comme désinfectant.
Le stockage de ces solutions aqueuses doit faire l’objet d’une grande vigilance pour éviter les accidents dus à la surpression engendrée par la production de dioxygène gazeux.
En effet, le peroxyde d’hydrogène en solution aqueuse se décompose selon une transformation modélisée par une réaction chimique dont l’équation est :
2 H2O2(aq) → 2 H2O(ℓ) + O2(g) (équation 1)
Cette transformation étant très lente, les solutions aqueuses de peroxyde d’hydrogène sont relativement stables et peuvent être stockées dans des récipients inertes et rigoureusement propres. Cependant, la décomposition du peroxyde d’hydrogène se trouve accélérée et les solutions deviennent instables sous l’action de certains facteurs :
- des traces de métaux ou d’ions métalliques (comme les ions Cu2+, Fe3+, …) ;
- le pH : les solutions aqueuses de peroxyde d’hydrogène sont moins stables en milieu basique qu’en milieu acide (la stabilité maximale se situe à un pH compris entre 3,5 et 4,5) ;
- une augmentation de la température ;
- les radiations : les rayons UV activent la décomposition.
A. Conditions optimales de stockage
Q.1. Le stockage des solutions de peroxyde d’hydrogène s’effectue dans des conteneurs en acier inoxydable. Justifier qu’il est impératif que ces conteneurs soient opaques à la lumière et entreposés dans des endroits réfrigérés.
La décomposition du peroxyde d’hydrogène se trouve accélérée par les rayons UV qui activent la décomposition. Ainsi, il est impératif que ces conteneurs soient opaques à la lumière.
De plus, la décomposition du peroxyde d’hydrogène se trouve accélérée une augmentation de la température. Ainsi, il est impératif que ces conteneurs soient entreposés dans des endroits réfrigérés.
Q.2. Une solution aqueuse de peroxyde d’hydrogène pour laquelle la concentration en ions oxonium est mesurée à 5,0×10-5 mol∙L-1 se situe-t-elle dans le domaine de stabilité maximale ? Justifier par un calcul.
$$pH=-log\left(\frac{\left[H_3O^+\right]}{c^0}\right)$$
$$pH=-log\left(\frac{5,0\times{10}^{-5}}{1,0}\right)$$
$$pH=4,3$$
La stabilité maximale se situe à un pH compris entre 3,5 et 4,5 : la solution aqueuse de peroxyde d’hydrogène pour laquelle la concentration en ions oxonium est mesurée à 5,0×10-5 mol∙L-1 se situe donc dans le domaine de stabilité maximal.
B. Étude de la vitesse de décomposition du peroxyde d’hydrogène
Un laboratoire spécialisé dans les risques chimiques réalise une étude sur la vitesse de décomposition de solutions aqueuses diluées de peroxyde d’hydrogène en présence d’ions fer (III) Fe3+.
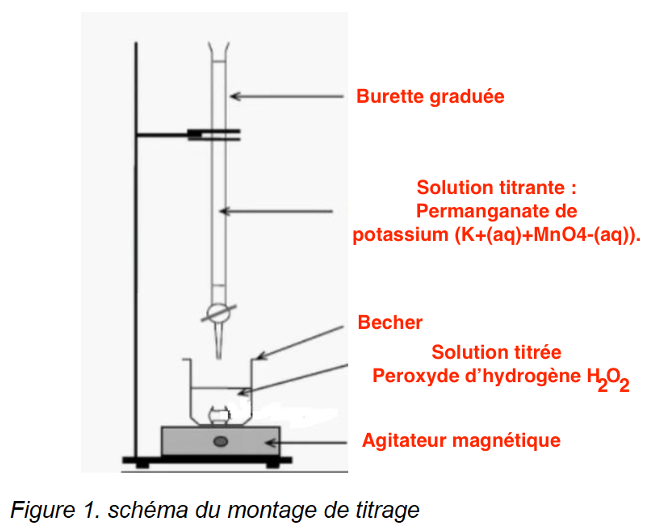
Pour suivre l’évolution temporelle de la concentration en peroxyde d’hydrogène H2O2, la quantité de matière de H2O2 restante à différentes dates est déterminée à partir de titrages colorimétriques successifs par les ions permanganate MnO4– (aq) présents dans une solution de permanganate de potassium (K+(aq)+MnO4– (aq)). La réaction d’oxydoréduction support de titrage a pour équation :
2 MnO4– (aq) + 6 H+(aq) + 5 H2O2(aq) → 2 Mn2+(aq) + 5 O2 (g) + 8 H2O(l) (équation 2)
L’étude est réalisée à partir d’une solution S de peroxyde d’hydrogène de concentration en soluté apporté CS.
Dans un premier temps, la concentration avant décomposition CS est déterminée grâce à un titrage par les ions permanganate selon le protocole expérimental suivant.
Protocole de titrage de H2O2 par MnO4– :
- Verser un volume de 10 mL de solution S dans un bécher de 100 mL.
- Ajouter un volume de 10 mL de solution d’acide sulfurique à 2,5 mol∙L-1.
- Titrer par une solution de permanganate de potassium de concentration C = 5,0 x 10-2 mol∙L-1 en ions permanganate. L’équivalence est marquée par un brusque changement de couleur après avoir ajouté un volume VE = 8,0 mL de solution titrante.
Q.3. Expliquer l’intérêt de l’ajout d’acide sulfurique à la solution S.
L’ajout d’acide sulfurique à la solution S permet d’apporter les ions H+ qui font parti des réactifs de la réaction.
Q.4. Légender le schéma du montage de titrage donné sur la figure 1 en annexe page 13.
Q.5. En exploitant l’équation 2, déterminer la concentration CS de la solution S.
$$2MnO_4^-\left(aq\right)+6H^+\left(aq\right)+5\ H_2O_2\left(aq\right)\rightarrow2{\rm Mn}^{2+}\left(aq\right)+5\ O_2\left(g\right)+8\ H_2O(l)$$
A l’équivalence :
$$\frac{n_{H_2O_2}^i}{5}=\frac{n_{MnO_4^-}^{eq}}{2}$$
$$\frac{C_S\times V_S}{5}=\frac{C\times V_E}{2}$$
$$C_S=\frac{5\times C\times V_E}{2\times V_S}$$
$$C_S=\frac{5\times5,00\times{10}^{-2}\times8,0\times{10}^{-3}}{2\times10,0\times{10}^{-3}}$$
$$C_S=1,0.{10}^{-1}mol.L^{-1}$$
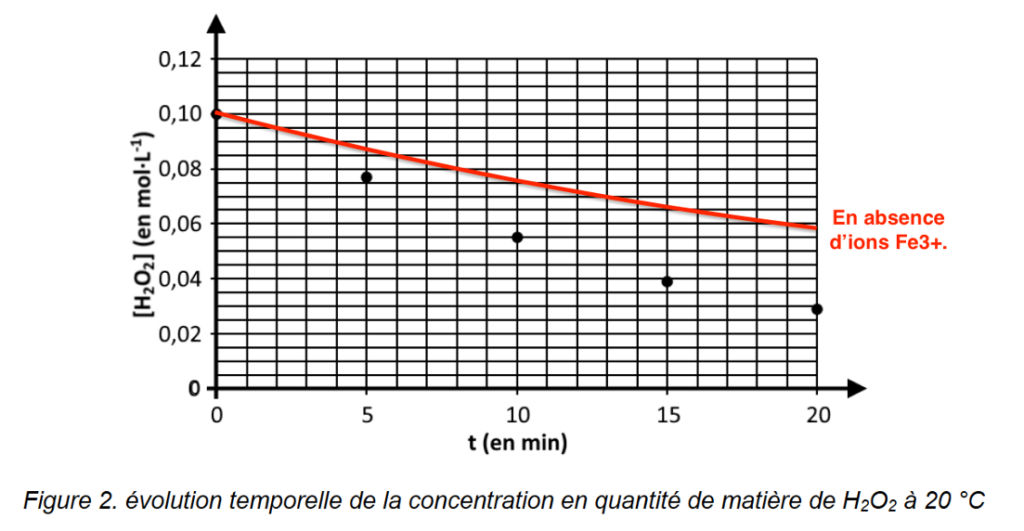
Le peroxyde d’hydrogène présent dans la solution S se décompose selon la réaction d’équation 1 après ajout des ions Fe3+. Le suivi de l’évolution temporelle de la concentration en H2O2 est réalisé par titrages successifs aux dates 5, 10, 15 et 20 minutes.
Les résultats expérimentaux obtenus à la température de 20 °C sont rassemblés sur la figure 2 donnée en annexe.
Q.6. Indiquer le rôle des ions Fe3+ dans la décomposition du peroxyde d’hydrogène.
Les ions Fe3+ jouent le rôle de catalyseur.
Q.7. Compléter la figure 2 en annexe page 13 en traçant ce que serait l’évolution temporelle de la concentration en quantité de matière de H2O2 en absence d’ions Fe3+.
C. Étude d’un accident industriel
En 2015, un accident a eu lieu dans une usine agroalimentaire qui utilise une solution de peroxyde d’hydrogène pour désinfecter la ligne de production. Selon l’inspection des installations classées, l’explosion serait due à une surpression dans le réservoir de stockage de la solution de peroxyde d’hydrogène. Plusieurs pistes sont envisagées pour expliquer la cause de l’accident, parmi lesquelles une réaction violente générée par une impureté présente dans le réservoir de stockage liée au changement de capteur de pression du réservoir effectué 15 jours auparavant. La solution aqueuse de peroxyde d’hydrogène stockée dans ce réservoir a une concentration [H2O2]réservoir = 1,2 mol∙L-1.
Données :
– schéma du réservoir de stockage avant l’accident :

- constante des gaz parfaits : R = 8,314 Pa∙m3∙mol-1∙K-1 ;
- pression dans le réservoir : P = 1,0 x 105 Pa ;
- température dans le réservoir : T = 293 K ;
- 1,0 m3 = 1,0 x 103 L.
Q.8. Déterminer la quantité de matière d’air, notée nair, qui occupe la partie supérieure du réservoir.
$$PV=n_{air}RT$$
$$n_{air}RT=PV$$
$$n_{air}=\frac{PV}{RT}$$
$$n_{air}=\frac{1,0\times{10}^5\times150\times{10}^{-3}}{8,314\times293}$$
$$n_{air}=6,2\ mol$$
On considère que le dioxygène formé par la décomposition accidentelle du peroxyde d’hydrogène ne se dissout pas dans la solution aqueuse.
Q.9. Calculer la pression finale atteinte dans le réservoir, notée Ptot, si le peroxyde d’hydrogène de la solution aqueuse se décompose totalement en considérant que la température est maintenue constante. Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
$$P_{tot}V_{gaz}=n_{total}RT$$
$$P_{tot}=\frac{n_{total}RT}{V_{gaz}}$$
Avec
$$n_{total}=n_{air}+n_{O_2}$$
$$P_{tot}=\frac{\left(n_{air}+n_{O_2}\right)RT}{V_{gaz}}$$
Or
D’après l’équation 1 :
$$2\ H_2O_2\left(aq\right)\rightarrow2\ H_2O(l)+\ O_2\left(g\right)$$
$$n_{O_2}=\frac{n_{H_2O_2}}{2}$$
$$P_{tot}=\frac{\left(n_{air}+\frac{n_{H_2O_2}}{2}\right)RT}{V_{gaz}}$$
Or
$$
n_{H_2O_2}=[H_2O_2]_{\text{réservoir}}\times V
$$
$$
P_{tot}=\frac{\left(n_{air}+\frac{[H_2O_2]{\text{réservoir}}\times V}{2}\right)RT}{V{gaz}}
$$
$$P_{tot}=\frac{\left(6,2\ +\frac{1,2\times1,0\times{10}^3}{2}\right)8,314\times293}{150\times{10}^{-3}}$$
$$P_{tot}=9,8\times{10}^6\ Pa$$
$$\frac{P_{tot}}{P}=\frac{9,8\times{10}^6}{1,0\times{10}^5}=98$$
Si le peroxyde d’hydrogène de la solution aqueuse se décompose totalement, la pression totale est 98 fois plus grande que la pression initiale d’ou l’explosion.
ANNEXE À RENDRE AVEC LA COPIE
EXERCICE 3 – Partie B
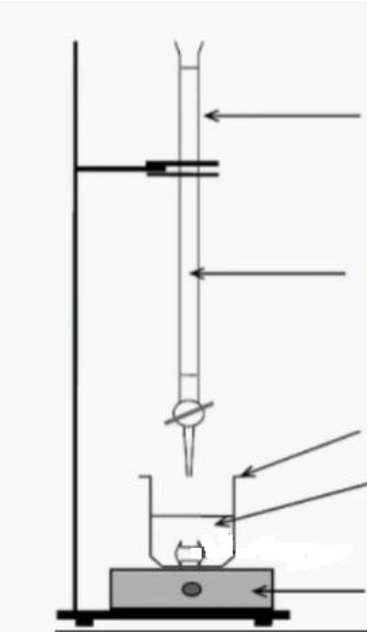
Figure 1. schéma du montage de titrage
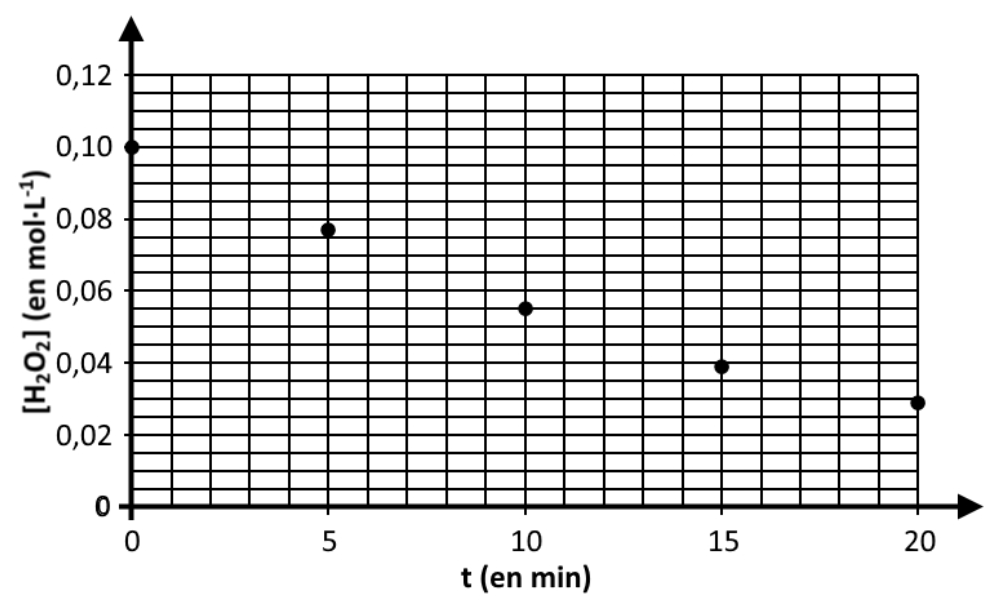
Figure 2. évolution temporelle de la concentration en quantité de matière de H2O2 à 20 °C
