Bac Métropole Juin 2021 Sujet 1
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ1ME2
Sujet et corrigé
Mot-clé : synthèse organique

Source : WIkipedia
En 1853, le chimiste italien Stanislao Cannizzaro développe une synthèse qui porte son nom, permettant d’obtenir l’alcool benzylique et l’ion benzoate à partir du benzaldéhyde. L’ion benzoate est transformé en acide benzoïque par acidification. L’acide benzoïque est une espèce chimique utilisée comme conservateur dans l’industrie agro-alimentaire et l’alcool benzylique, quant à lui, est utilisé comme antiseptique dans l’industrie pharmaceutique.
L’objectif de cet exercice est d’étudier la synthèse de Cannizzaro, puis les techniques permettant d’isoler et de contrôler la pureté des produits obtenus.
Données :
- espèces chimiques :
- couples oxydant / réducteur:
- ion benzoate / benzaldéhyde : C6H5–COO–(aq) / C6H5–CHO(aq) en milieu basique ;
- benzaldéhyde / alcool benzylique : C6H5––CHO(l) / C6H5––CH2–OH(l) ;
- densité de l’éther diéthylique liquide à 25°C par rapport à l’eau liquide : déther = 0,71 ;
- solubilité des espèces chimiques dans l’eau et l’éther diéthylique :
| Espèce chimique Solvant | Alcool benzylique | Acide benzoïque | Ion benzoate | Benzaldéhyde |
| Eau | Insoluble | Peu soluble (solubilité : 2,9 g·L–1 à 20°C et 1,7 g·L–1 à 0°C) | Très soluble | Insoluble |
| Éther diéthylique | Soluble | Soluble | Insoluble | Soluble |
- pKA à 25°C du couple acide benzoïque C6H5––COOH(aq) / ion benzoate C6H5––COO–(aq) : 4,2.
1. Modélisation de la synthèse de Cannizzaro
La synthèse de Cannizzaro peut être modélisée par une réaction d’oxydo-réduction dans laquelle un même réactif, le benzaldéhyde, est à la fois l’oxydant et le réducteur ; on parle alors de réaction de dismutation. L’équation de la réaction est la suivante :
2 C6H5-CHO (l) + HO– (aq) → C6H5-COO– (aq) + C6H5-CH2-OH (l)
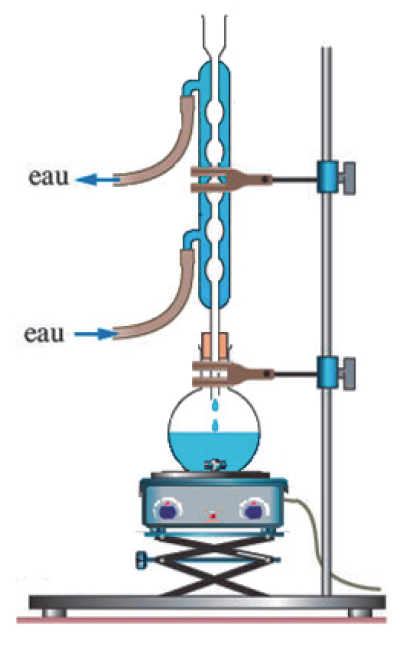
1.1. Recopier la formule topologique du benzaldéhyde, entourer le groupe caractéristique et nommer la famille fonctionnelle correspondante.
Famille : aldéhydes
1.2. Justifier, en identifiant les couples oxydant / réducteur, que la réaction modélisant la synthèse de Cannizzaro est une dismutation.
Couples :
$$C_6H_5-C{\rm OO}_{\left(aq\right)}^-/C_6H_5-CHO_{\left(aq\right)}$$
$$C_6H_5-CHO_{\left(l\right)}/C_6H_5-CH_2-{\rm OH}_{\left(l\right)}$$
Réaction : $$2C_6H_5-CHO_{\left(l\right)}+{\rm HO}_{\left(aq\right)}^-\rightarrowC_6H_5-C{\rm OO}_{\left(aq\right)}^-+C_6H_5-CH_2-{\rm OH}_{\left(l\right)}$$
$C_6H_5-CHO_{\left(l\right)}$ (Benzaldéhyde) se transforme en $C_6H_5-C{\rm OO}_{\left(aq\right)}^-$, le benzaldéhyde à le rôle de réducteur.
$C_6H_5-CHO_{\left(l\right)}$ (Benzaldéhyde) se transforme en $C_6H_5-CH_2-{\rm OH}_{\left(l\right)}$, le benzaldéhyde à le rôle d’oxydant.
D’après le texte : « une réaction d’oxydo-réduction dans laquelle un même réactif, le benzaldéhyde, est à la fois l’oxydant et le réducteur ; on parle alors de réaction de dismutation »
La réaction modélisant la synthèse de Cannizzaro est donc une dismutation.
2. Optimisation de la synthèse de Cannizzaro
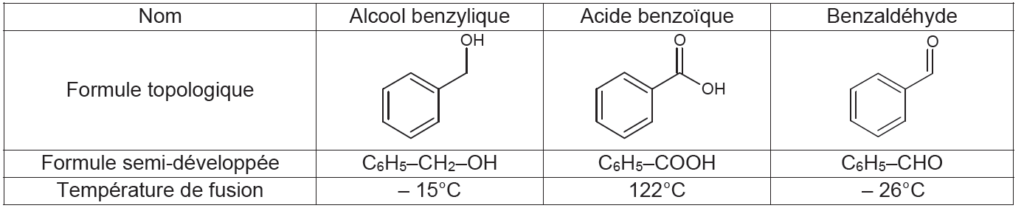
Pour réaliser la synthèse de Cannizzaro, on mélange dans un ballon une solution d’hydroxyde de potassium et du benzaldéhyde commercial, puis on agite vigoureusement. On choisit de travailler avec une solution concentrée d’hydroxyde de potassium et d’utiliser le montage de la figure 1.
Justifier ces choix expérimentaux pour optimiser la synthèse.
La concentration est un facteur cinétique. Ainsi en utilisant une solution concentrée d’hydroxyde de potassium, on augmente la vitesse de réaction.
La température est un facteur cinétique. Ainsi en utilisant le montage de la figure 1, on augmente la vitesse de réaction.
3. Séparation et contrôle de la pureté des produits de la synthèse
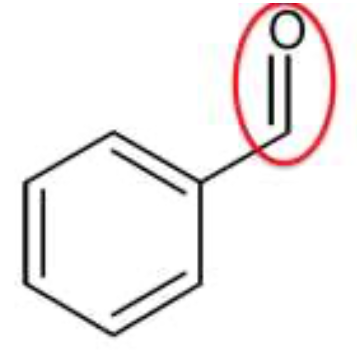
En fin de réaction, on verse le contenu du ballon dans une ampoule à décanter et on réalise une extraction liquide-liquide en utilisant de l’éther diéthylique comme solvant extracteur. Après décantation, on distingue une phase aqueuse et une phase organique non-miscibles que l’on sépare l’une de l’autre.
La phase organique est traitée ensuite grâce à un dispositif qui permet d’évaporer l’éther diéthylique présent et de récupérer un produit A sous forme liquide.
La phase aqueuse est placée dans un grand bécher placé dans un bain d’eau et de glace. On y verse goutte- à-goutte une solution concentrée d’acide chlorhydrique jusqu’à ce que le pH soit inférieur à 2. On observe la formation d’un solide correspondant au produit B.
Une chromatographie sur couche mince des produits A et B obtenus est réalisée sous une hotte aspirante. Tous les produits sont dissous à 1 % dans le dichlorométhane. La plaque est révélée à l’aide d’une lampe UV et le chromatogramme obtenu est présenté sur la figure 2.

(1) : produit A
(2) : alcool benzylique commercial
(3) : produit B
(4) : acide benzoïque commercial
(5) : benzaldéhyde commercial
3.1. Effectuer un schéma légendé de l’ampoule à décanter en précisant les phases présentes et leurs compositions respectives après décantation.
Le mélange comporte des réactifs et des produits de la réaction :
- alcool benzylique
- acide benzoïque
- benzaldéhyde
- Ion benzoate
La densité de l’éther diéthylique liquide à 25°C par rapport à l’eau liquide : déther = 0,71 est plus faible que celle de l’eau. Ainsi l’éther diéthylique est situé au-dessus.
L’alcool benzylique, l’acide benzoïque et le benzaldéhyde sont solubles dans l’éther diéthylique et insolubles dans l’eau. Ils se trouvent donc dans l’éther diéthylique.
L’ion benzoate est insoluble dans l’éther diéthylique et soluble dans l’eau. Il se trouve dans la phase aqueuse.
3.2. Justifier l’utilisation de l’éther diéthylique pour effectuer la séparation des produits de la synthèse.
Pour effectuer la séparation des produits de la synthèse, il faut un solvant extracteur qui est deux caractéristiques :
- Non miscible à l’eau
- L’espèce à extraire doit y être plus soluble
L’éther diéthylique n’est pas miscible à l’eau.
Les deux produits de la réaction sont l’ion benzoate et l’alcool benzylique.
L’alcool benzylique est soluble dans l’éther diéthylique et insoluble dans l’eau.
L’ion benzoate est insoluble dans l’éther diéthylique et soluble dans l’eau.
Les deux produits de la réaction se trouvent dans deux phases différentes : on a séparé les produits de la réaction grâce à l’utilisation de l’éther diéthylique
3.3. Justifier que l’on veuille obtenir un pH inférieur à 2 pour la phase aqueuse.
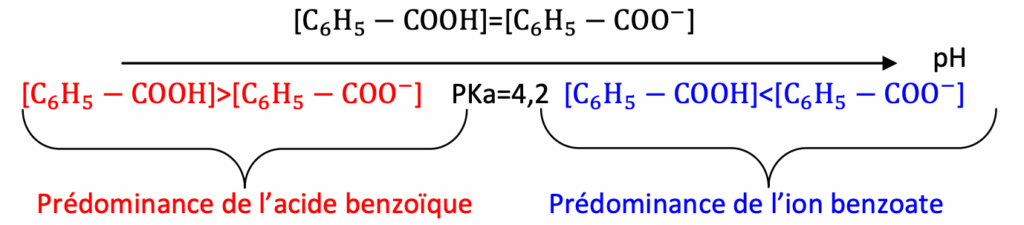
La phase aqueuse contient l’ion benzoate. Lorsque le pH est inférieur à 2, l’acide benzoïque prédomine. Ainsi, l’ion benzoate se transforme en acide benzoïque qui est peu soluble dans l’eau.
3.4. Donner l’intérêt du bain d’eau et de glace.
L’acide benzoïque est moins soluble dans l’eau froide que dans l’eau à 20°C : on récupère l’acide benzoïque sous forme solide.
3.5. Citer une technique permettant d’isoler le produit B de la phase aqueuse.
B est solide. On l’isole de la phase aqueuse par filtration.
3.6. En utilisant le chromatogramme, conclure sur l’efficacité de l’étape de séparation des produits obtenus.
Le produit A est composé de :
- alcool benzylique
- benzaldéhyde
Le produit B est composé d’acide benzoïque

Dans A, on retrouve les espèces chimiques présente dans l’éther diéthylique.
Dans B, on retrouve l’espèce chimique présente dans l’eau (l’ion benzoate qui s’est transformé en acide benzoïque).
3.7. En utilisant le chromatogramme, conclure sur la pureté des produits obtenus.
A est un mélange car il y a deux taches dans le chromatogramme.
B est un corps pur car il y a une tache dans le chromatogramme.

