E3C2 – 10 points – Durée 1h – calculatrice autorisée
Le menthol et la menthone sont deux espèces chimiques organiques présentes dans certaines espèces de menthe.
Le menthol (2-isopropyl-5-méthylcyclohexan-1-ol) est utilisé fréquemment dans les industries agroalimentaire, pharmaceutique et cosmétique.
La menthone (2-isopropyl-5-méthylcyclohenan-1-one) entre dans la composition de certains parfums et arômes naturels ; elle est obtenue par oxydation, en milieu acide, du menthol.
Dans cet exercice, on s’intéresse à la synthèse de la menthone à partir du menthol, réalisable au laboratoire du lycée.
| Menthol | Menthone | |
| Couleur | Blanche | Incolore |
| Masse molaire (g.mol-1) | 156 | 154 |
| Température de fusion (°C) | 43 | – 6,5 |
| Température d’ébullition (°C) | 212 | 209 |
Données :
| Solvant | Dichlorométhane | Cyclohexane | Ethanol | Eau |
| Densité | 1,33 | 0,78 | 0,79 | 1 |
| Miscibilité avec l’eau | Non miscible | Non miscible | Miscible | |
| Miscibilité avec l’éthanol | Non miscible | Non miscible | Miscible | |
| Solubilité du menthol à 25°C | Très soluble | Peu soluble | Soluble | Non soluble |
| Solubilité de la menthone à 25°C | Très soluble | Très soluble | Soluble | Non soluble |
Tableau de données de spectroscopie infrarouge (IR) :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H libre | 3500 – 3700 | Forte, fine |
| O-H liée | 3200-3400 | Forte, large |
| O-H acide carboxylique | 2500-3200 | Forte à moyenne, large |
| C-H | 2800-3000 | Forte |
| C=O aldéhyde et cétone | 1650-1730 | Forte |
| C=O acide carboxylique | 1680-1710 | Forte |
| C=C | 1640-1680 | Moyenne |
1. La formule semi-développée du menthol est représentée ci-après :
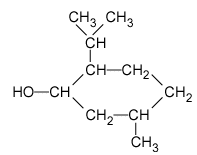
Justifier le fait que le menthol fasse partie de la famille des alcools
2. Sachant que lors de l’oxydation ménagée du menthol en menthone seul le groupe caractéristique est modifié et que la menthone appartient à la famille des cétones, représenter la formule semi-développée de la molécule de menthone.
3. L’oxydation du menthol en menthone s’effectue en milieu acide par l’ion permanganate ![]() qui appartient au couple oxydant-réducteur
qui appartient au couple oxydant-réducteur ![]()
![]() . Cette oxydation est modélisée par une réaction dont l’équation est la suivante :
. Cette oxydation est modélisée par une réaction dont l’équation est la suivante :
![]()
![]() +
+ ![]()
![]()
![]()
![]()
![]()
Justifier le fait que le menthol subit une oxydation.
4. On réalise, au laboratoire du lycée, l’oxydation d’une masse m=15,6 g de menthol par un volume V=200 mL d’une solution aqueuse acide permanganate de potassium dont la concentration en ions permanganate est C=0,5 mol.L-1 . Le mélange est acidifié par quelques millilitres d’acide sulfurique concentré. Le dispositif expérimental utilisé est celui du chauffage à reflux.
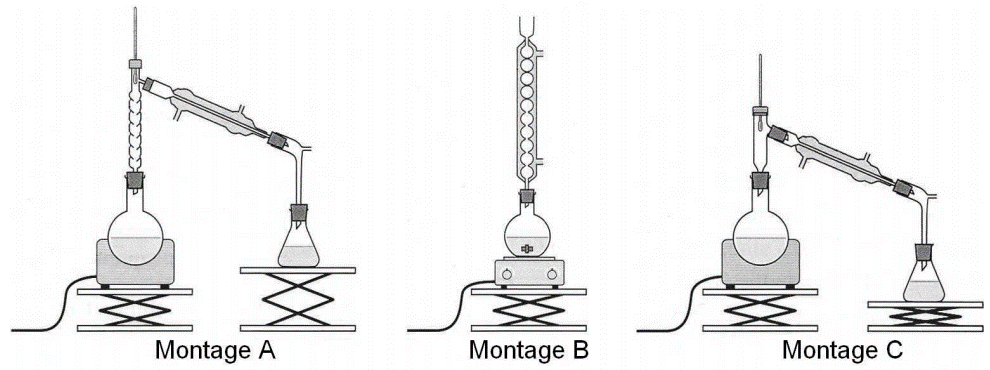
4.1. Parmi les montages A, B et C précédents, indiquer celui qu’il convient de choisir pour réaliser le chauffage à reflux.
4.2. Expliquer le rôle des différents éléments de verrerie dans le montage à reflux.
4.3. En s’aidant éventuellement d’un tableau d’avancement, montrer que, lors de cette oxydation, le menthol est le réactif limitant.
4.4. Déterminer la masse théorique maximum mth de menthone que l’on peut obtenir.
5. On transvase le contenu du ballon dans une ampoule à décanter et on y ajoute 20 mL d’un solvant extracteur. On agite puis on laisse reposer. On observe la séparation de 2 phases, la phase organique surnageant.
Déterminer quel solvant, parmi le dichlorométhane, le cyclohexane, l’éthanol et l’eau, a été utilisé pour extraire la menthone du mélange réactionnel. Justifier.
6. La séparation de la menthone du solvant extracteur se fait en réalisant une distillation. En fin d’opération on obtient une masse mexp = 10,3 g de distillat que l’on considère être de la menthone pure. On réalise le spectre infrarouge du distillat ; il est reproduit ci-après.
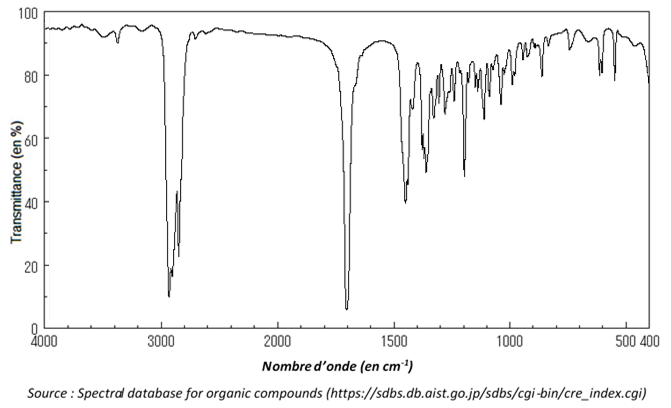
6.1. Justifier que le spectre précédent est compatible avec celui de la menthone.
6.2. Déterminer le rendement de cette synthèse. Conclure.
