Bac Métropole Septembre 2021 Sujet 2
Exercice C – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 21-PYCJ2ME3
Sujet et corrigé
Mots-clés : réactions acide-base ; synthèse organique ; spectroscopie IR
Le terme « sonochimie » est utilisé pour décrire les transformations chimiques qui se produisent en solution grâce à l’énergie apportée par des ultrasons dont la fréquence doit être comprise entre 20 kHz et 1 MHz.
La sonochimie permet de réaliser des transformations chimiques à haut rendement et de minimiser la quantité de déchets. Dans certains cas, l’utilisation des ultrasons permet d’obtenir des produits différents de ceux obtenus sans ultrasons.
On s’intéresse à la transformation entre l’octan-1-ol et l’acide nitrique en présence ou absence d’ultrasons. Les schémas correspondants aux deux transformations sont représentés ci-dessous :
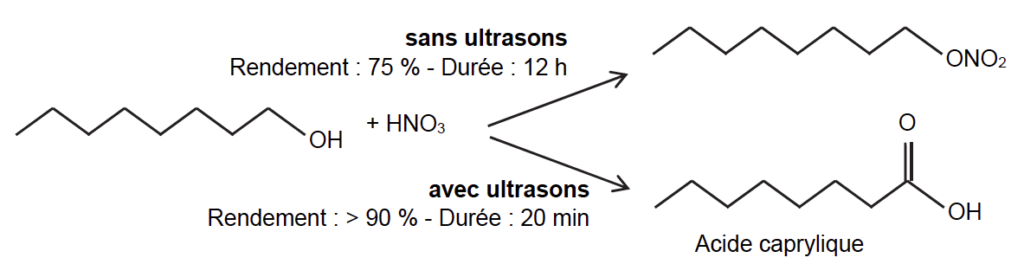
Données :
- caractéristiques physico-chimiques des espèces chimiques mises en jeu :
| Espèce chimique | Masse molaire (g·mol–1) | Masse volumique (g·mL–1) |
| octan-1-ol | 130 | 0,82 |
| acide nitrique | 63 | solution aqueuse à 65 % en masse d’acide nitrique : 1,4 |
| acide caprylique | 144 | – |
- données de spectroscopie IR :
| Liaison | Nombre d’onde (cm–1) | Intensité (F : forte – m : moyenne) |
| C = O cétone ou aldéhyde | 1650 – 1730 | F |
| Ctri – H aldéhyde | 2700 – 2900 | m |
| O – H acide carboxylique | 2500 – 3200 | F à m |
| C = O acide carboxylique | 1680 – 1720 | F |
| C = O ester | 1730 – 1750 | F |
| O – Hlié alcool | 3200 – 3450 | F |
| O – Hlibre alcool | 3600 – 3700 | F |
- pKA du couple acide-base auquel appartient l’acide caprylique, à 25°C : 4,9
- Masse volumique de l’eau : 1 g.mL-1
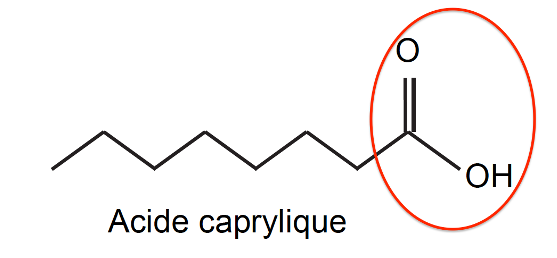
1. L’acide caprylique
1.1. Recopier la formule topologique de l’acide caprylique et entourer son groupe caractéristique. Nommer la fonction chimique associée.
Fonction chimique : acide carboxylique
1.2. L’acide caprylique, noté R- CO2H , est naturellement présent dans la noix de coco et est très peu soluble dans l’eau. À 25°C, on dissout 0,68 g d’acide caprylique dans 1,00 L d’eau. Le pH de la solution obtenue est de 3,6.
1.2.1. Écrire l’équation de la réaction acide-base modélisant la transformation entre l’acide caprylique et l’eau.
$$R-CO_2H_{(aq)}+H_2O_{(l)}\rlhar R-CO_{2(aq)}^-+H_3O_{(aq)}^+$$
1.2.2. Déterminer le taux d’avancement de cette transformation. En déduire si l’acide caprylique est un acide fort ou un acide faible.
Quantités de matière des réactifs :
$$n_{acide\ caprylique}=\frac{m_{acide\ caprylique}}{M_{acide\ caprylique}}$$
$$n_{acide\ caprylique}=\frac{0,68}{144}=4,7\times10^{-3}\ mol$$
| $R-CO_2H_{(aq)}$ | $+H_2O_{(l)}$ | $& \rlhar R-CO_{2(aq)}^-$ | $H_3O_{(aq)}^+$ | |
| État initial | 4,7×10-3 | Solvant | 0 | 0 |
| État intermédiaire | 4,7×10-3-x | Solvant | x | x |
| État final | 4,7×10-3-xf | Solvant | xf | xf |
Calculons l’avancement maximal :
$$4,7\times10^{-3}-x_{max}=0$$
$$x_{max}=4,7\times10^{-3}\ mol$$
Calculons l’avancement final :
$$x_f=n_{H_3O^+}=[H_3O^+]\times V=c^0\times10^{-pH}\times V$$
$$x_f=1,0\times10^{-3,6}\times1,0$$
$$x_f=2,5\times10^{-4}\ mol$$
Calculons le taux d’avancement :
$$\tau=\frac{x_f}{x_{max}}$$
$$\tau=\frac{2,5\times10^{-4}}{4,7\times10^{-3}}$$
$$\tau=0,053$$
La réaction est limitée.
L’acide caprylique ne réagit pas totalement avec l’eau : c’est un acide faible.
1.2.3. Représenter le diagramme de prédominance du couple auquel appartient l’acide caprylique. En déduire la forme prépondérante dans la solution préparée.
Diagramme de prédominance :
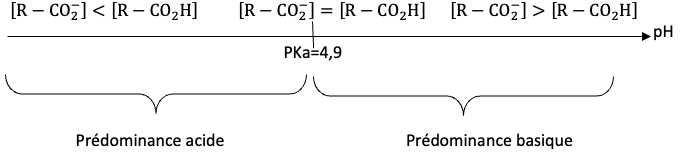
Dans la solution préparée, pH=3,6 : la forme prépondérante est l’acide caprylique 𝐑−𝐂𝐎𝟐𝐇.
2. Synthèse de l’acide caprylique par sonochimie
La synthèse de l’acide caprylique peut être réalisée par sonochimie à partir d’octan-1-ol et d’acide nitrique. Un capteur permet de visualiser le signal à la sortie de l’émetteur d’ultrasons en fonction du temps (figure 1).
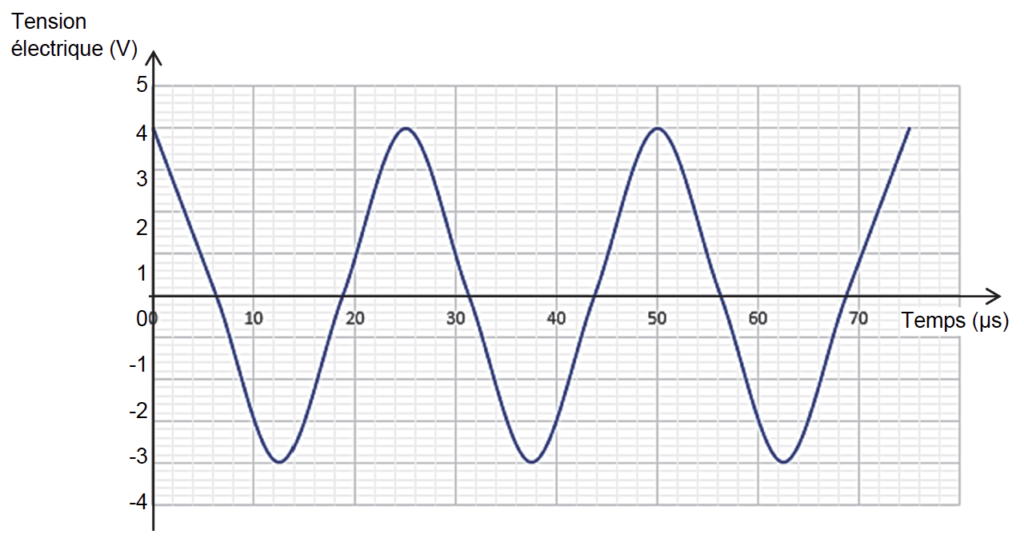
2.1. Justifier que ces ultrasons peuvent être utilisés en sonochimie.
D’après le texte : « Le terme « sonochimie » est utilisé pour décrire les transformations chimiques qui se produisent en solution grâce à l’énergie apportée par des ultrasons dont la fréquence doit être comprise entre 20 kHz et 1 MHz.»
Calculons sa fréquence :
$$2T=50\ \mu s$$
$$T=25\ \mu s$$
$$f=\frac{1}{T}$$
$$f=\frac{1}{25\times10^{-6}}$$
$$f=4\times10^{4}\ Hz$$
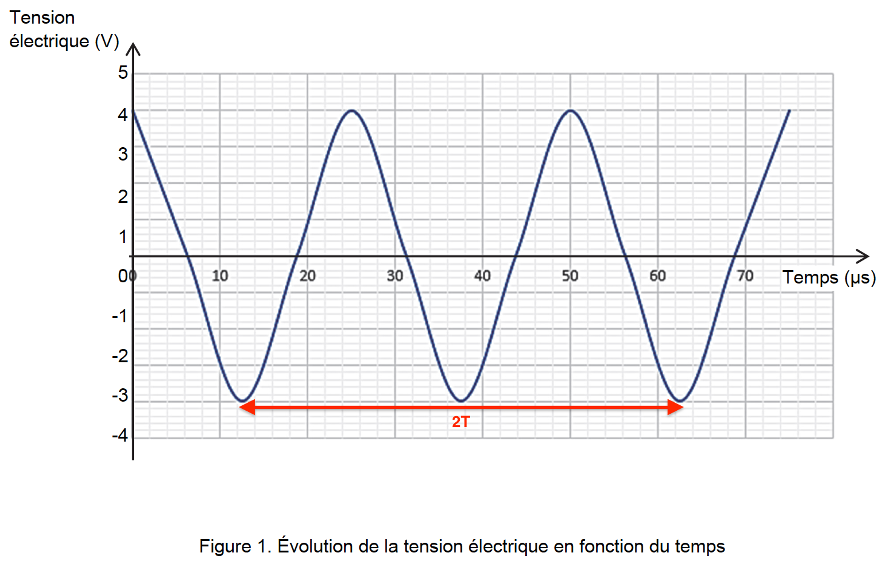
La fréquence est comprise entre 20 kHz et 1 MHz : ces ultrasons peuvent être utilisés en sonochimie.
On introduit 6,3 mL d’octan-1-ol et 3,6 mL d’un mélange aqueux d’acide nitrique à 65 % en masse dans un ballon placé dans le bac à ultrasons. La température est maintenue à 25°C. Au bout de vingt minutes, le générateur d’ultrasons est éteint. On ajoute de l’éther diéthylique et on récupère la phase organique. Après ajout de sulfate de magnésium anhydre et filtration de la phase organique, le solvant est évaporé. La masse expérimentale du produit obtenu est égale à 5,5 g.
2.2. Le milieu réactionnel initial comporte deux phases. Donner la nature et la position relative de chacune des phases. Justifier.
Le milieu réactionnel initial comporte : de l’octan-1-ol et d’un mélange aqueux d’acide nitrique.
L’octan-1-ol est la phase aqueuse. Le mélange aqueux d’acide nitrique est la phase organique.
$$\rho_{octan-1-ol}=0,82\ g.mL^{-1}$$
$$\rho_{acide\ nitrique}=1,4\ g.mL^{-1}$$
$$\rho_{octan-1-ol}<\rho_{acide\ nitrique}$$
L’octan-1-ol est au-dessus de l’acide nitrique.
2.3. Citer deux avantages de la sonochimie.
Avantages de la sonochimie :
La sonochimie permet de réaliser des transformations chimiques à haut rendement et de minimiser la quantité de déchets.
Dans certains cas, l’utilisation des ultrasons permet d’obtenir des produits différents de ceux obtenus sans ultrasons.
Afin d’identifier le produit obtenu, on enregistre son spectre IR (figure 2).
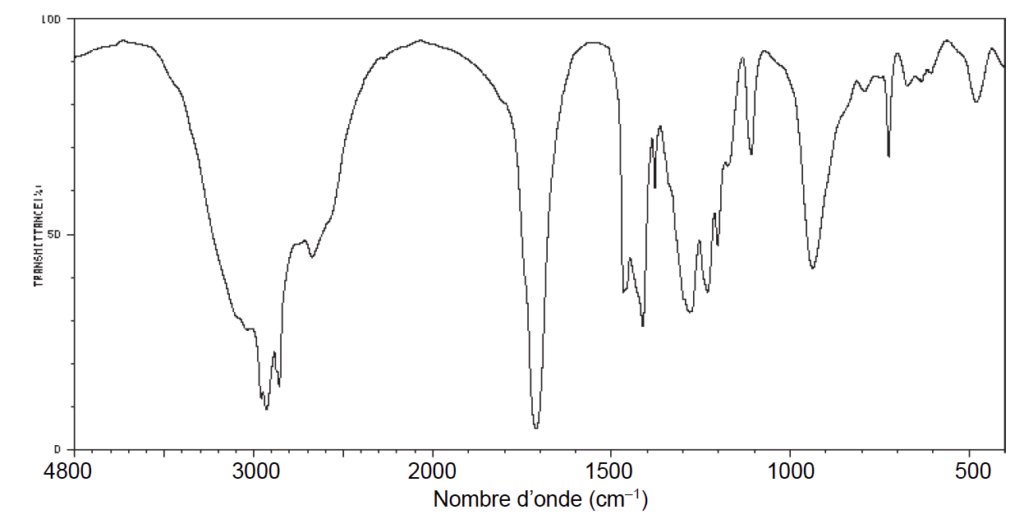
2.4. Montrer que le spectre IR obtenu peut être celui de l’acide caprylique.

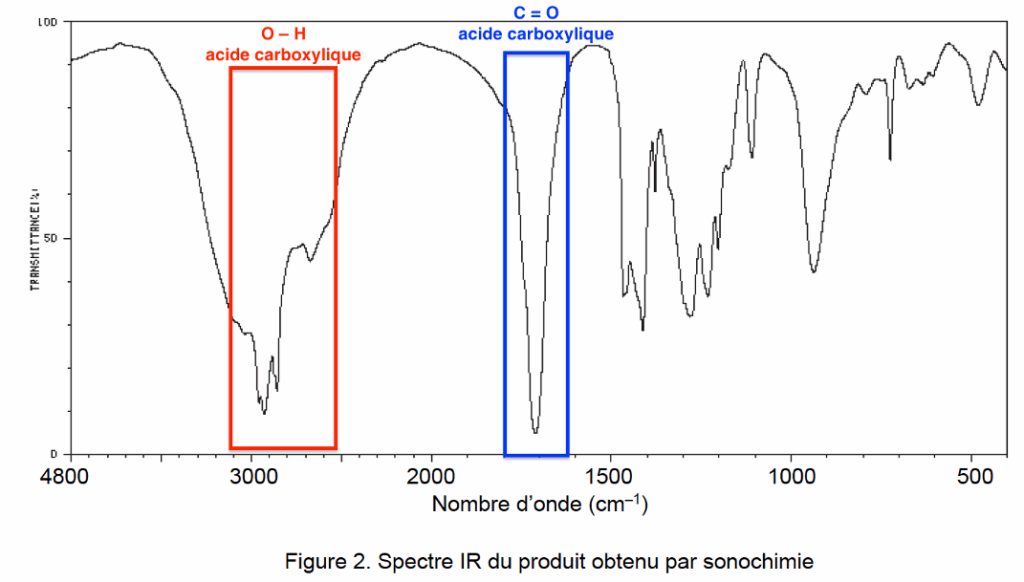
Le spectre IR obtenu comporte une bande caractéristique d’une liaison O – H d’un acide carboxylique et une bande caractéristique C = O d’un acide carboxylique. Ainsi, le spectre IR obtenu peut être celui de l’acide caprylique.
2.5. Calculer le rendement de la synthèse réalisée. Commenter.

Quantités de matière des réactifs :
Octan-1-ol :
$$n_{octan-1-ol}=\frac{m_{octan-1-ol}}{M_{octan-1-ol}}$$
Or
$$\rho_{octan-1-ol}=\frac{m_{octan-1-ol}}{V_{octan-1-ol}}$$
Donc
$$n_{octan-1-ol}=\frac{\rho_{octan-1-ol}\times V_{octan-1-ol}}{M_{octan-1-ol}}$$
$$n_{octan-1-ol}=\frac{0,82\times6,3}{130}=4,0\times10^{-2}\ mol$$
Acide nitrique à 65 % en masse :
$$n_{acide\ nitrique}=\frac{\rho_{acide\ nitrique}\times V_{acide\ nitrique}}{M_{acide\ nitrique}}$$
$$n_{acide\ nitrique}=\frac{1,4\times3,6\times0,65}{63}=5,2\times10^{-2}\ mol$$
Calculons l’avancement maximal :
$$x_{max1}=\frac{n_{octan-1-ol}}{1}=4,0\times10^{-2}\ mol$$
$$x_{max2}=\frac{n_{acide\ nitrique}}{1}=5,2\times10^{-2}\ mol$$
$x_{max1}<x_{max2}$
$$x_{max}=x_{max1}=4,0\times10^{-2}\ mol$$
Calculons la masse maximale de produit :
$$n_{acide\ caprylique}=\frac{m_{acide\ caprylique}}{M_{acide\ caprylique}}$$
$$m_{acide\ caprylique}=n_{acide\ caprylique}\times M_{acide\ caprylique}$$
$$m_{acide\ caprylique}^{théorique}=x_{max}\times M_{acide\ caprylique}$$
$$m_{acide\ caprylique}^{théorique}=4,0\times10^{-2}\times144$$
$$m_{acide\ caprylique}^{théorique}=5,8\ g$$
Calculons le rendement :
$$\eta=\frac{m_{acide\ caprylique}^{exp}}{m_{acide\ caprylique}^{théorique}}$$
$$\eta=\frac{5,5}{5,8}$$
$$\eta=0,95=95%$$
D’après le texte : « Rendement : > 90 % ».
Le résultat obtenu est conforme aux attentes.
