Bac Métropole mars 2023 Sujet 1
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°23-PYCJ1ME1
Sujet et corrigé
EXERCICE 2 – SYNTHÈSE DE L’ARÔME DE BANANE (5 points)
L’arôme de banane est un mélange complexe de plusieurs espèces chimiques naturelles. Le principal constituant de cet arôme est l’éthanoate de 3-méthylbutyle aussi appelé acétate d’isoamyle : il est utilisé en parfumerie et comme additif alimentaire.

Flacon d’arôme alimentaire banane commercial
L’objectif de cet exercice est de comparer plusieurs protocoles permettant de synthétiser au laboratoire cette espèce chimique, afin de déterminer quelle synthèse est la plus éco-responsable.
L’équation de la réaction de synthèse de l’éthanoate de 3-méthylbutyle est la suivante :
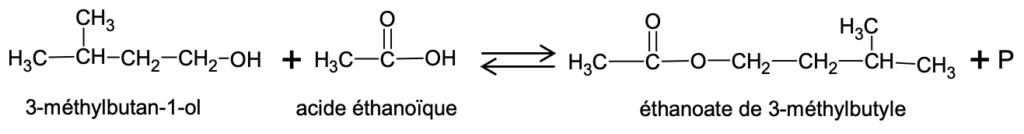
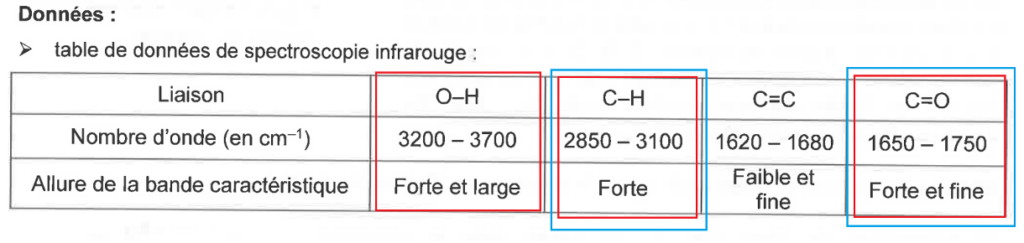
Données :
- table de données de spectroscopie infrarouge :
| Liaison | O–H | C–H | C=C | C=O |
| Nombre d’onde (en cm–1) | 3200 – 3700 | 2850 – 3100 | 1620 – 1680 | 1650 – 1750 |
| Allure de la bande caractéristique | Forte et large | Forte | Faible et fine | Forte et fine |
1. Identification des espèces mises en jeu dans la réaction
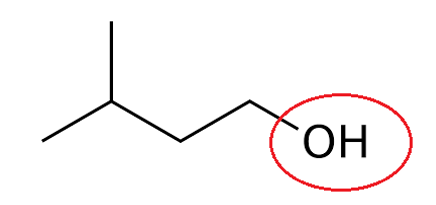
Q1. Représenter la formule topologique des réactifs et de l’éthanoate de 3-méthylbutyle. Entourer les groupes caractéristiques et identifier les familles fonctionnelles correspondantes.
Formule topologique 3-méthylbutan-1-ol :
Famille : Alcool
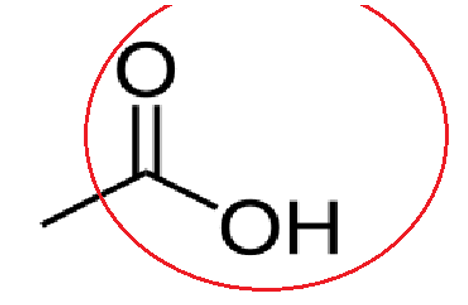
Formule topologique acide éthanoique :
Famille : Acide carboxylique
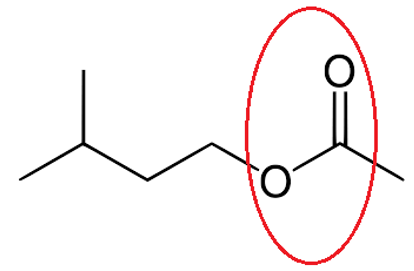
Formule topologique éthanoate de 3-méthylbutyle
Famille : Ester
Q2. Justifier que le produit P obtenu lors de cette synthèse est de l’eau.
| Atomes | Réactifs | Produits (sans P) | Différence |
| C | 7 | 7 | 0 |
| H | 16 | 14 | 16-14=2 |
| O | 3 | 2 | 3-2=1 |
Pour que l’équation soit équilibrée il faut que le produit P soit composé de 2 atomes hydrogenes et 1 atome d’oxygène.
Formule de P : $H_2O$.
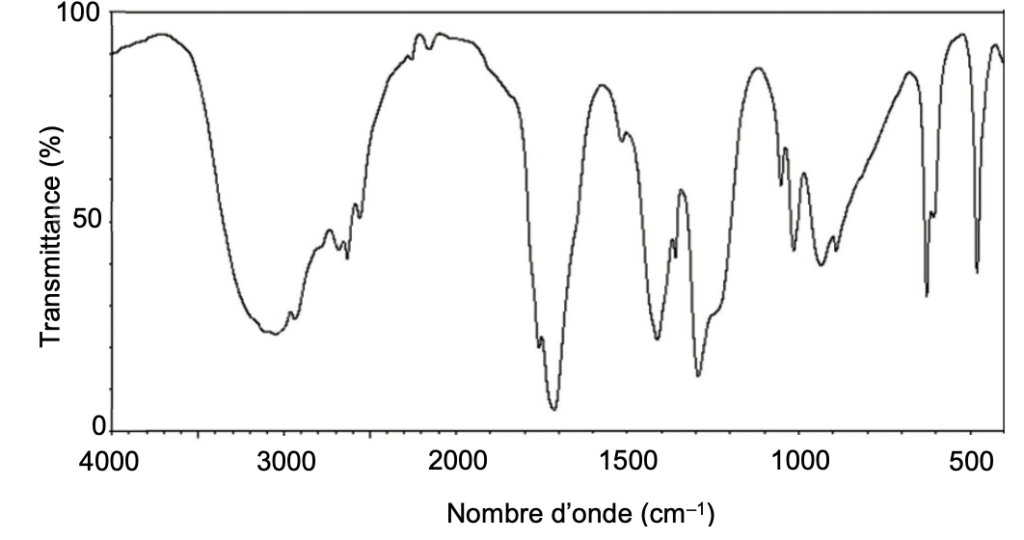
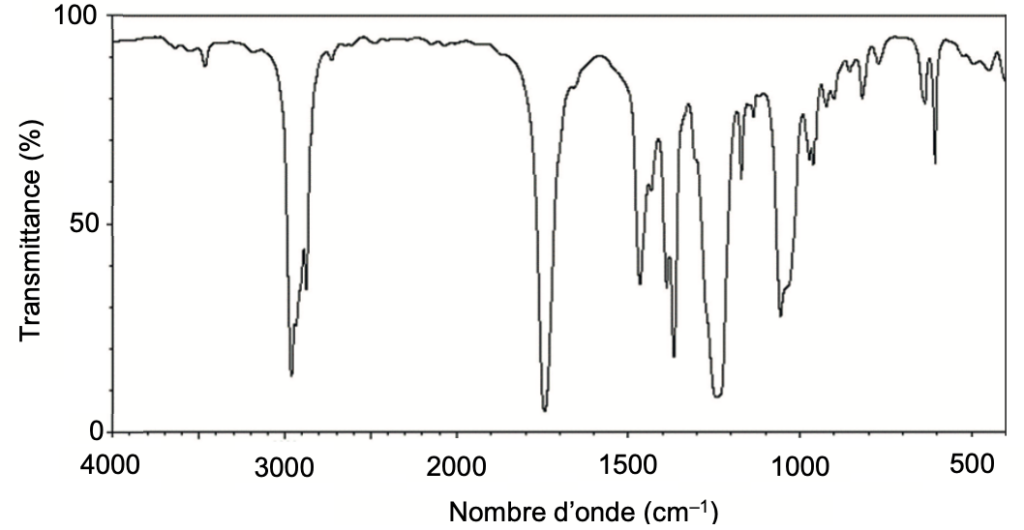
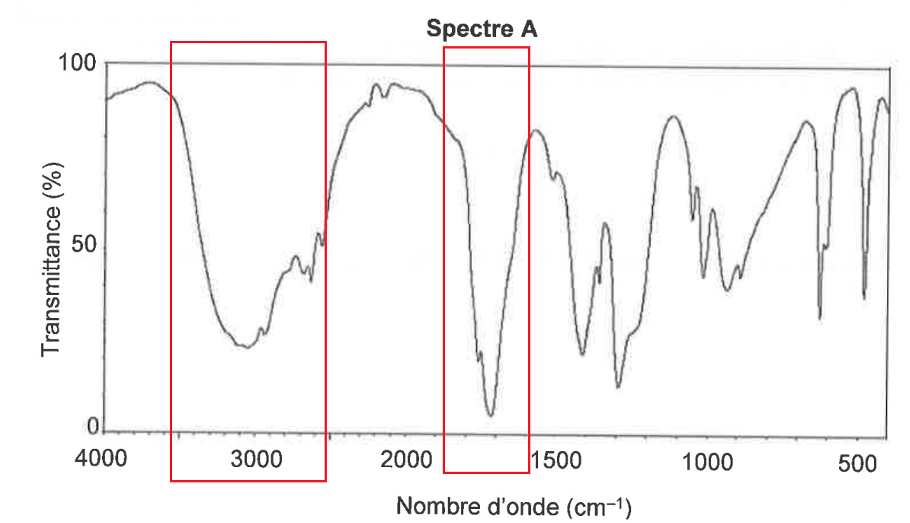
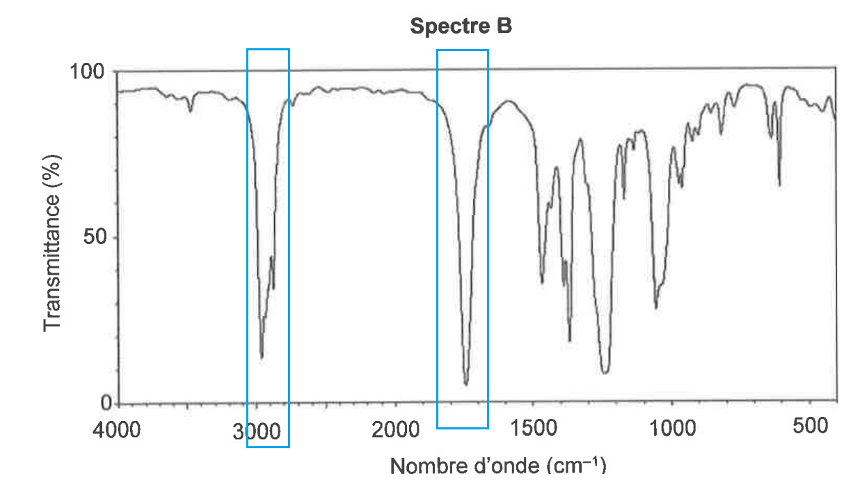
Q3. Attribuer, à l’aide des données et en justifiant, chacun des spectres A et B représentés ci-après soit à l’acide éthanoïque, soit à l’éthanoate de 3-méthylbutyle.
Spectre A
Spectre B
Source : https://sdbs.db.aist.go.jp/
L’acide éthanoïque comporte une liaison O-H (nombre d’onde entre 3200 et 3700 cm-1 Forte et large), une liaison C=O (nombre d’onde entre 1650 et 1750 cm-1 Forte et fine) et des liaisons C-H (nombre d’onde entre 2850 et 3100 cm-1 Forte).
L’ éthanoate de 3-méthylbutyle comporte une liaison C=O (nombre d’onde entre 1650 et 1750 cm-1 Forte et fine) et des liaisons C-H (nombre d’onde entre 2850 et 3100 cm-1 Forte).
Le spectre A correspond à l’acide éthanoïque
Le spectre B correspond à l’éthanoate de 3-méthylbutyle
2. Comparaison de protocoles de synthèse
Données :
- l’ion hydrogénocarbonate HCO3− est une espèce amphotère appartenant aux couples acide-base suivants : HCO3−(aq)⁄CO32−(aq) et (CO2 (g),H2O(l))⁄HCO3−(aq) ;
- données physico-chimiques à 20°C et données de sécurité :
| Espèce chimique | Masse molaire en g∙mol–1 | Densité | Solubilité dans l’eau salée | Pictogrammes de sécurité |
| 3-méthylbutan-1-ol | 88,2 | 0,81 | Peu soluble |  |
| Acide éthanoïque | 60,0 | 1,05 | Très soluble |  |
| Éthanoate de 3-méthylbutyle | 130,2 | 0,87 | Très peu soluble |  |
| Cyclohexane | 84,2 | 0,78 | Insoluble |
Dans la suite de l’exercice on compare trois protocoles de synthèse. Protocole A : synthèse avec montage de chauffage à reflux
- Étape 1 : dans un ballon on introduit 22 mL de 3-méthylbutan-1-ol, 15 mL d’acide éthanoïque pur et 10 gouttes d’acide sulfurique concentré, ainsi que quelques grains de pierre ponce.
- Étape 2 : le mélange est chauffé à reflux pendant 45 minutes puis refroidi à la température ambiante.
- Étape 3 : la phase organique est ensuite lavée avec une solution aqueuse saturée de chlorure de sodium puis avec une solution aqueuse d’hydrogénocarbonate de sodium.
- La phase organique est alors séchée à l’aide de sulfate de magnésium anhydre.
Q4. Nommer les étapes 2 et 3 du protocole A.
Etape 2 : Transformation chimique des réactifs
Etape 3 : Purification
L’acide sulfurique concentré est utilisé comme catalyseur dans ce protocole.
Q5. Préciser le sens du mot catalyseur.
Un catalyseur est une espèce chimique, qui accélère la réaction sans modifier l’état final du système chimique.
Q6. Préciser l’utilité du montage de chauffage à reflux dans ce protocole.
Le chauffage à reflux permet d’accélérer la réaction sans perte de matière.
Lors du second lavage de l’étape 3 du protocole, on observe un dégagement gazeux.
Q7. À l’aide des données, proposer une explication à cette observation et justifier l’utilité de cette étape.
L’ion hydrogénocarbonate ${\rm HCO}_{3(aq)}^-$ réagit avec l’acide restant dans la phase organique et se transforme en $CO_2\left(g\right),H_2O(l)$.
$CO_2\left(g\right)$ est un gaz d’où le dégagement gazeux.
Cette étape permet de supprimer les traces d’acide sulfurique présent dans la phase organique.
Q8. Déterminer le réactif limitant utilisé dans le protocole A puis calculer le rendement de la synthèse réalisée en suivant ce protocole.
Calculons les quantités de matière des réactifs :
$n=\frac{m}{M}$
Or $\rho=\frac{m}{V}$ donc $m=\rho\times V$
$n=\frac{\rho\times V}{M}$
Or $d=\frac{\rho}{\rho_{eau}}$
$\rho=d\times \rho_{eau}$
$n=\frac{d\times \rho_{eau}\times V}{M}$
Quantité de matière du 3-méthylbutan-1-ol :
$$
n_{3\text{-méthylbutan-1-ol} }=\frac{d_{3\text{-méthylbutan-1-ol}}\times\rho_{eau}\times V_{3\text{-méthylbutan-1-ol}}}{M_{3\text{-méthylbutan-1-ol}}
}
$$
$$
n_{3\text{-méthylbutan-1-ol} }=\frac{0,81\times1000\times22\times10^{-3}}{88,2}=2,0\times10^{-1}\ \text{mol}
$$
$$
n_{\text{acide éthanoique}}=\frac{d_{\text{acide éthanoique}}\times\rho_{eau}\times V_{\text{acide éthanoique}}}{M_{\text{acide éthanoique}}}
$$
$$
n_{\text{acide éthanoique}}=\frac{1,05\times1000\times15\times10^{-3}}{60,0}=2,6\times10^{-1}\ \text{mol}
$$
$$
x_{max1}=\frac{n_{3\text{-méthylbutan-1-ol}}}{1}=2,0\times10^{-1}\ \text{mol}
$$
$$
x_{max2}=\frac{n_{\text{acide éthanoique}}}{1}=2,6\times10^{-1}\ \text{mol}
$$
$$
x_{max1}<x_{max2}
$$
$$
x_{max}=x_{max1}=2,0\times10^{-1}\ \text{mol}
$$
$$
m_{\text{éthanoate de 3-méthylbutyle}}^{\text{théorique}}=n_{\text{éthanoate de 3-méthylbutyle}}\times M_{\text{éthanoate de 3-méthylbutyle}}
$$
$$
m_{\text{éthanoate de 3-méthylbutyle}}^{\text{théorique}}=x_{max}\times M_{\text{éthanoate de 3-méthylbutyle}}
$$
$$
m_{\text{éthanoate de 3-méthylbutyle}}^{\text{théorique}}=2,0\times10^{-1}\times130,2
$$
$$
m_{\text{éthanoate de 3-méthylbutyle}}^{\text{théorique}}=26\ g
$$
$$
\eta=\frac{m_{exp}}{m_{\text{éthanoate de 3-méthylbutyle}}^{\text{théorique}}}
$$
$$
\eta=\frac{19,7}{26}
$$
$$
\eta=0,76=76%
$$
Dans les protocoles B et C, les étapes 1 et 3 sont identiques à celles du protocole A mais l’étape 2 est modifiée comme indiqué ci-dessous :
| Protocole B | Protocole C | |
| Synthèse au four à micro-ondes | Synthèse avec un appareil de Dean-Stark | |
| Modifications de l’étape 2 | Chauffage avec une puissance de 800 W pendant 30 s. | Chauffage à l’aide de l’appareil de Dean- Stark permettant d’extraire l’eau au cours de sa formation, en présence de cyclohexane jouant le rôle de solvant. |
| Rendement | 87 % | 85 % |
Le chauffe-ballon utilisé dans les protocoles A et C lors de l’étape 2 consomme une énergie de 4,1×105 J.
Q9. Calculer l’énergie utilisée pour chauffer le mélange réactionnel dans le protocole B. Commenter.
$$
P=E\Delta t
$$
$$
E\Delta t=P
$$
$$
E=P\times \Delta t
$$
$$
E=800\times 30
$$
$$
E=2,4{\times10}^4\ J
$$
L’énergie utilisée dans le protocole B est inférieur à celle utilisée dans les protocoles A et C.
L’objectif de la chimie verte est de réduire l’impact de la chimie sur la santé humaine et l’environnement. Il s’agit donc de rechercher des milieux réactionnels alternatifs et respectueux de l’environnement tout en s’efforçant, dans le même temps, d’augmenter les vitesses et d’abaisser les températures de réaction. Paul
T. Anastas et John C. Warner ont développé 12 principes de la chimie verte en 1991. Ces principes se divisent en deux groupes : « réduire le risque » et « réduire le plus possible l’empreinte environnementale ».
D’après https://www.sigmaaldrich.com/
Figure 1. Schéma illustrant quelques principes directeurs de la chimie verte
Q10. À l’aide de la figure 1, identifier, en le justifiant, quel protocole répond le mieux aux principes directeurs de la chimie verte.
Le protocole B répond au mieux aux principes directeurs de la chimie verte car :
Il limite les dépenses énergétiques (Q9)
Il n’utilise pas de solvant polluant (comme le cyclohexane du protocole C)
